酶-化学法制备麦麸可溶性膳食纤维及其性质研究
朱宣宣,李 华,郭艳艳,刘鑫慧,李玉栋
河南工业大学 粮油食品学院,河南 郑州 450001
麦麸是小麦制粉的主要副产物,是小麦膳食纤维的主要来源[1]。膳食纤维(DF)是食品“七大营养素”之一,对人体健康有诸多有益作用[2-3]。研究表明,DF具有良好的抗氧化、减脂、预防肥胖和便秘等功能[4-5]。根据水溶性差异,DF可分为不溶性膳食纤维(IDF)和可溶性膳食纤维(SDF)[6]。相比IDF而言,SDF更能发挥调节代谢相关功能,具有更好的生理活性[7]。但麦麸膳食纤维中大多是IDF,溶解性差,口感粗糙,限制了其在食品中的应用[8],因此如何提高SDF含量至关重要。
目前,SDF的提取方法有物理法、化学法、酶解法、酶-化学法等,其中运用最为广泛的是酶-化学法,该方法可以有效提高SDF的提取率[9]。陶志杰等[10]对小麦麸皮SDF的酶-化学法提取工艺进行优化,确定了最佳提取工艺为碱用量12%、碱解时间45 min、酶用量0.2%、酶解时间4.5 h,SDF提取率可达16.53%。宋荣珍等[11]从生姜中提取膳食纤维,并对提取工艺进行正交试验优化,按最佳工艺提取SDF得率达到28.58%。但采用酶-化学法处理麸皮的方法目前尚未系统研究,麦麸中SDF和IDF不同组分的理化性质的研究也鲜有报道。因此,本文以麦麸为原料,用酸处理结合酶法提高SDF的含量,并对IDF和SDF进行提取,研究其理化性质,为不同类型麦麸膳食纤维的工业化应用提供理论依据。
1 材料与方法
1.1 试验材料
麦麸:河南天香面业有限公司;大豆油:市售;耐高温α-淀粉酶(40 kU/g)、木瓜蛋白酶(800 kU/g)、纤维素酶(50 kU/g):北京索莱宝科技有限公司;2,2-联苯基-1-苦基肼基(DPPH)、2,2′-联氨-双(3-乙基苯并噻唑啉-6-磺酸)二胺盐(ABTS):上海麦克林生化科技有限公司;无水乙醇:天津市致远化学试剂有限公司。所有试剂均为分析纯。
1.2 仪器与设备
UV-1600B紫外可见分光光度计:上海美谱达公司;Spectrum TWO傅里叶变换红外光谱仪:美国铂金埃尔默股份有限公司;DZKW-S-4电热恒温水浴锅:北京市永光明医疗仪器有限公司;pH计:奥豪斯仪器有限公司;CLF-10C粉碎机:浙江创力药材器械厂。
1.3 试验方法
1.3.1 麦麸前处理及基本成分的测定
首先将麦麸过60目筛,用清水浸泡30 min,然后洗去麦麸中的一些杂质和淀粉,反复清洗至上清液澄清为止,将洗净的麸皮在75 ℃条件下烘干,干燥后用粉碎机粉碎并过80目筛,测定其基本成分:水分(GB 5009.3—2016)、灰分(GB 5009.4—2016)、粗蛋白(GB 5009.5—2016)、粗淀粉(GB 5009.9—2016)、脂肪(GB 5009.6—2016)、膳食纤维(GB 5009.88—2014)。
1.3.2 可溶性膳食纤维改性工艺
称取麦麸5.0 g,按料液比1∶ 10(g/mL)加入蒸馏水,在95 ℃、pH 6.5条件下加入1.2%耐高温α-淀粉酶酶解40 min,冷却至室温,在60 ℃下加入0.12%木瓜蛋白酶酶解40 min,100 ℃灭酶10 min。用1 mol/L HCl调pH值,一定温度下酸解一段时间后,60 ℃、pH 4.8条件下加入1.5%纤维素酶酶解4 h,100 ℃灭酶10 min,冷却后4 000 r/min离心15 min,得到上清液,加入4倍体积乙醇沉淀2 h,抽滤白色絮状物,烘干得SDF。

1.3.3 单因素试验与正交优化试验设计
选取3个单因素,温度(60、70、80、90、100 ℃)、酸处理时间(0.5、1、1.5、2、2.5 h)、pH值(1.0、2.0、3.0、4.0、5.0),分别考察各因素对麦麸SDF提取率的影响。在此基础上,选用L9(33)正交试验对参数进行优化。
1.3.4 麦麸和不同膳食纤维的理化性质测定
1.3.4.1 持水力的测定
参照杨芙莲等[12]的方法,略加修改。准确称取1.0 g样品于离心管中,加入20 mL蒸馏水,振荡均匀室温下静置2 h,3 500 r/min离心15 min,弃上清液,称量吸水后样品的质量,计算持水力。

1.3.4.2 膨胀力的测定
参照张梦云[13]的方法,称1.0 g样品于25 mL量筒中,加入15 mL蒸馏水,室温下静置24 h,记录样品吸附水分后的体积,计算膨胀力。

1.3.4.3 持油力的测定
参照Zheng等[14]的方法,并稍加修改。称取1.0 g样品于离心管中,加入20 mL大豆油后静置2 h,3 500 r/min离心15 min,弃上清液,称量吸油后样品的质量,计算持油力。

1.3.5 麦麸和膳食纤维的抗氧化性分析
1.3.5.1 DPPH自由基清除能力的测定
参照施建斌等[15]的方法,并略加修改。将样品(原麦麸、DF、IDF和SDF)分别配成质量浓度为5、10、15、20、25、30 mg/mL,移取1 mL样液与3 mL DPPH溶液,混匀后室温下避光反应30 min,于波长517 nm处测定吸光度。计算DPPH自由基清除率。

式中:A1为1 mL样品溶液+3 mL DPPH的吸光度;A2为1 mL样品溶液+3 mL乙醇的吸光度;A0为1 mL水+3 mL DPPH的吸光度。
1.3.5.2 ABTS自由基清除能力的测定
参照文献[16],移取样品0.2 mL与ABTS工作液4 mL,混匀后室温避光反应6 min,于734 nm波长处测定吸光度。

式中:A1为0.2 mL样品溶液+4 mL ABTS的吸光度;A2为0.2 mL样品溶液+4 mL乙醇的吸光度;A0为0.2 mL水+4 mL ABTS的吸光度。
1.3.6 麦麸和膳食纤维的傅里叶红外光谱测定
对麦麸和膳食纤维进行傅里叶红外光谱测定[17],测定条件:扫描范围400~4 000 cm-1,扫描次数64次,分辨率4 cm-1。
1.4 数据处理
每组试验重复3次,结果以平均值±标准差表示,采用SPSS 20.0进行数据分析,采用Origin 2021绘图。
2 结果与讨论
2.1 麦麸的基本成分
由表1可知,试验所用的麦麸中DF含量高达75.13%,可作为提取DF的原料。

表1 麦麸的基本成分
2.2 正交优化试验
2.2.1 时间对SDF提取率的影响
将反应体系的pH值控制在2.0,温度80 ℃,考察酸处理时间对SDF提取率的影响。由图1可知,随着酸处理时间延长SDF的提取率显著上升,并在1.5 h时达到最高。但是继续延长时间后,SDF提取率呈下降趋势,这可能是反应时间过长,麦麸中大部分膳食纤维发生水解,SDF的断链化学键数也逐渐减少,不利于SDF的溶解[18]。因此,最佳酸处理时间选1~2 h。
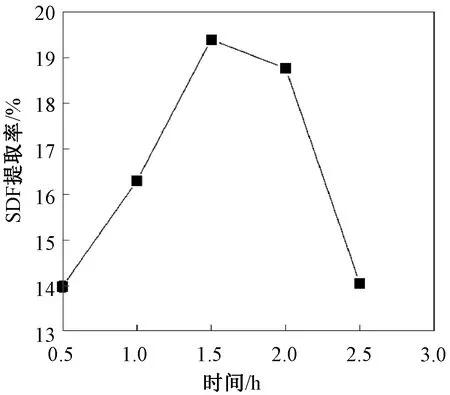
图1 酸处理时间对SDF提取率的影响
2.2.2 pH值对SDF提取率的影响
反应体系保持酸处理时间1.5 h,温度80 ℃,考察pH值对SDF提取率的影响。由图2可知,随pH值增加SDF的提取率逐渐升高,并在 pH 3.0时达到最高。随着pH值继续升高,SDF的提取率逐渐下降,这可能是因为随着pH值的增加,酸浓度变低,大部分膳食纤维酸水解反应能力变弱,SDF不能有效溶出导致其提取率降低[19]。因此,pH值选取2.0、3.0、4.0用于正交试验进一步优化。

图2 酸处理pH值对SDF提取率的影响
2.2.3 温度对SDF提取率的影响
反应体系保持酸处理时间1.5 h,pH 2.0,考察温度对SDF提取率的影响。由图3可知,随着温度逐渐升高,SDF的提取率逐渐上升,并在90 ℃时达到最高。可能是高温有利于分子运动,DF吸水性增强,分子变得更舒展,其中纤维素和半纤维素大量析出,通过后续的纤维素酶的再次改性,将这部分的纤维素和半纤维素转化成为SDF[20],使得SDF的提取率明显增加。故选择温度80、90、100 ℃作为正交试验水平。

图3 酸处理温度对SDF提取率的影响
2.2.4 正交试验结果与验证
在单因素试验的基础上,以反应温度、pH值和反应时间3个因素对SDF提取率进行优化,L9(33)正交试验结果见表2。
由表2可知,3个因素影响SDF提取率的主次顺序为反应pH值>时间>温度,最优条件组合为A3B1C3,即制备条件为反应时间2.0 h、pH2.0、温度100 ℃。此条件下进行验证试验,SDF提取率为21.39%,是原麦麸中SDF含量的5.5倍。

表2 正交试验结果
2.3 麦麸和不同膳食纤维的理化性质测定
一般用持水力、膨胀力等作为膳食纤维水合能力的评判指标[21]。由表3可知,原麦麸的持水力为(3.54±0.11)g/g,经酶-化学处理后的DF、IDF、SDF的持水力分别提高了133.33%、81.07%和119.77%。原麦麸膨胀力为(3.14±0.02)mL/g,处理后DF、IDF、SDF的膨胀力分别提高了105.73%、84.08%和92.68%。经过改性后膳食纤维结构变得疏松多孔,增加了接触面积,使更多的亲水性羟基暴露出来[22],从而提高了麦麸膳食纤维的持水力和膨胀力。研究表明,良好的水合能力可以使面制品吸水性提高,明显缩短面团醒发时间,减少烹饪损失,同时也是其能预防和缓解肥胖、便秘的重要原因[23]。

表3 麦麸和不同膳食纤维的理化性质测定结果
持油力是指膳食纤维吸附油的能力,主要取决于膳食纤维结构的多孔性和疏水性,且良好的持油力可以改善食品的品质[24]。由表3可知,改性后的DF、IDF、SDF的持油力均优于原麦麸,其中IDF持油力(4.21 g/g)明显高于碱-结合酶法[25]制备的IDF(3.51 g/g),这可能是膳食纤维表面结构在酶-化学处理过程中,由于离子间的相互作用会产生更多非极性基团,从而增加了分子疏水性[26]。
2.4 麦麸和膳食纤维的抗氧化性质分析
2.4.1 DPPH自由基清除能力
DPPH与乙醇反应可以形成紫色络合物,当DPPH自由基与抗氧化剂接触后,其自由基含量减少,颜色变浅[27]。由图4可知,在样品质量浓度为5 mg/mL时,原麦麸对DPPH清除率为6.09%,而经过酶-化学处理的DF、IDF、SDF对DPPH清除率分别为33.01%、18.77%、27.49%。随着样品质量浓度的升高,对DPPH清除能力呈现出上升趋势,当质量浓度为30 mg/mL时,DF、IDF、SDF的DPPH自由基清除率分别为78.23%、58.88%、74.99%,明显高于原麦麸(30.40%),且DF对DPPH自由基清除率最强。在质量浓度相同时,对DPPH自由基清除能力的顺序为DF>SDF>IDF>原麦麸,这可能是由于经过酶-化学法改性后膳食纤维中SDF含量明显提高,更多的亲水基团暴露出来,从而提高了对DPPH自由基的清除能力[28]。

图4 麦麸和膳食纤维对DPPH自由基的清除作用
2.4.2 ABTS自由基清除能力
ABTS法也是测定物质抗氧化性的常用方法,ABTS可以与K2S2O8反应生成稳定自由基ABTS+,抗氧化剂能清除ABTS+使其脱色,吸光度下降[29]。由图5可知,各样品对ABTS自由基清除率均随质量浓度升高而提高,5~20 mg/mL时ABTS自由基清除率迅速上升,大于20 mg/mL时ABTS自由基清除率基本趋于平缓,且DF对ABTS自由基清除率最强。综合来看,膳食纤维的抗氧化能力较原麦麸明显提高,可能是适当的酶-化学联合处理,使得膳食纤维接触面积增加,且增加了抗氧化活性物质的溶出。这与王磊等[30]结果一致。
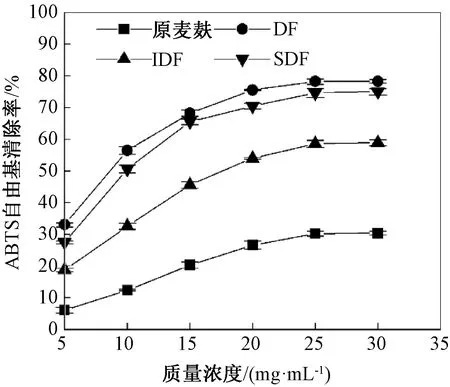
图5 麦麸和膳食纤维对ABTS自由基的清除作用
2.5 麦麸和膳食纤维红外光谱分析

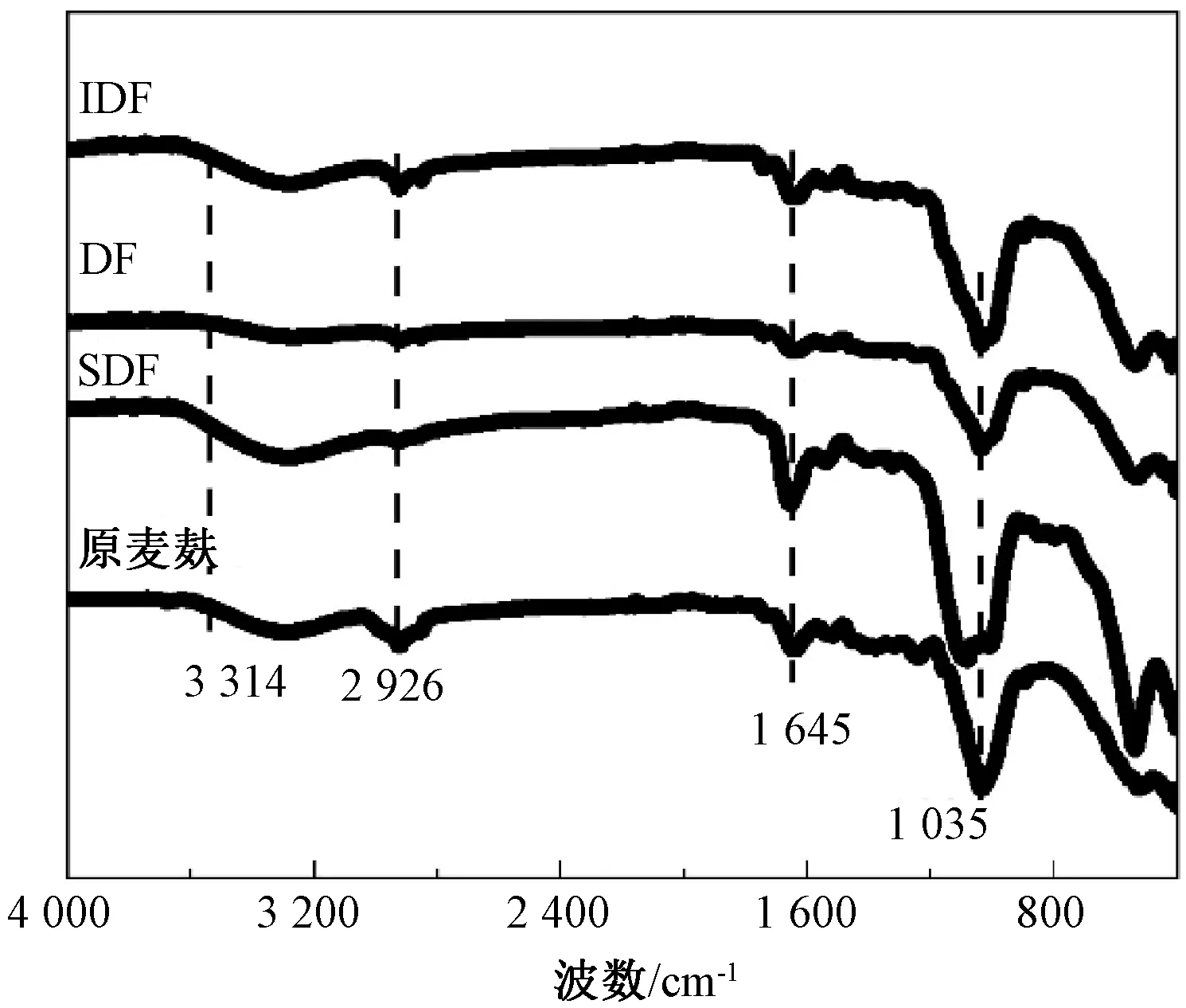
图6 麦麸和膳食纤维红外光谱图
3 结论
酶-化学法联合处理制备麦麸可溶性膳食纤维的最佳工艺条件:pH 2.0,温度100 ℃,时间2.0 h,SDF提取率为21.39%。经酶-化学联合处理后的麦麸膳食纤维的理化性质和抗氧化性均得到改善。总膳食纤维、可溶性膳食纤维和不溶性膳食纤维的持水力、膨胀力和持油力均得到明显提高,抗氧化能力顺序为DF>SDF>IDF>原麦麸,活性与剂量之间呈明显正相关。改性后麦麸膳食纤维吸收峰分布发生略微变化,部分峰强度减弱。麦麸酶-化学联合处理可显著提高麦麸中可溶性膳食纤维的含量,提升了总膳食纤维的吸附特性和抗氧化功能特性,为麦麸副产物的深度加工利用提供了理论参考。

