预知子提取物增敏奥沙利铂诱导结肠癌HCT116细胞凋亡的研究
周婷婷,沈卫星,2,陈桐庆,冯慧,谭佳妮,2,徐长亮,2,余成涛,2,范旻旻,2,程海波,2
(1.南京中医药大学第一临床医学院,江苏 南京 210023;2.江苏省中医药防治肿瘤协同创新中心,江苏 南京 210023)
结直肠癌是发病率最高的消化道恶性肿瘤,对社会造成巨大负担[1]。奥沙利铂(Oxaliplatin,OXA)是第3代铂类药物,临床常用于结直肠癌的治疗。患者常在用药24~48 h内出现急性神经毒性,长期剂量累积会引起慢性神经毒性。若OXA用药累积剂量超过1 165 mg·m-2,大约有50%的患者会出现较严重的神经毒性反应,如肢端感觉麻木、钝痛等,从而导致化疗中止,最终影响疗效[2~3]。OXA神经毒性的产生与药物剂量累积效应呈正相关,此类周围神经毒性被称为蓄积性周围神经毒性[4]。临床研究表明,接受含OXA化疗方案的恶性肿瘤患者中蓄积性周围神经毒性发生率高达60%~90%,不仅影响患者化疗耐受性、依从性及临床疗效,还严重影响患者精神心理健康和生存质量[5]。因此,如何有效防治含有OXA化疗方案造成的周围神经毒性,减轻周围神经系统损伤已成为临床迫切需要解决的问题。
探索一种新的化疗增效药物,在保持或增加化疗效果的前提下,降低OXA使用剂量,或缩短化疗周期,对减轻OXA所致的蓄积性周围神经毒性具有重要意义。近年来,中医药已广泛应用于肿瘤临床治疗。现代药理研究表明,预知子包含有三萜类及皂苷类等成分,具有抗肿瘤的作用[6-7],但对预知子中的成分是否可增效OXA尚未有相关报道。本实验以结肠癌HCT116细胞为研究对象,探索预知子提取物增敏OXA的最佳组合浓度,在保证抗肿瘤药效的前提下,减少OXA的使用剂量,并初步探讨其作用机制,为OXA治疗结直肠癌的临床应用提供思路。
1 材料
1.1 细胞
人结肠癌HCT116细胞由国家中医药管理局名医验方评价与转化重点研究室提供。
1.2 试剂
预知子(河北福君堂药业有限公司,批号:190505,产地:河北);OXA(美国MCE公司,货号:HY-17371);皂苷B(实验室自制,纯度>98%);α-常春藤皂苷(成都瑞芬思生物科技有限公司,货号:27013-91-8);噻唑蓝(德国Biofroxx公司,货号:298-93-1);Annexin V-FITC/PI双染细胞凋亡检测试剂盒(江苏凯基生物技术股份有限公司,货号:KGA107);Cleaved caspase-3抗体(美国Affinity公司,货号:AF7022);Caspase-3、Bcl-2、Bax、Cyt-c抗体(英国Abcam公司,货号:AB13847、AB196495、AB5714、AB133504);p-p38 MAPK、p38 MAPK、抗兔IgG、抗鼠IgG抗体(美国CST公司,货号:4511T、8690T、7074、7076);GAPDH抗体(美国Immuno way公司,货号:YM3029);RIPA裂解液(上海碧云天生物技术有限公司,货号:P0013D);蛋白酶抑制剂、磷酸酶抑制剂(瑞士Roche公司,货号:11697498001、4906845001)。
1.3 仪器
ACQUITY UPLC系统、Xevo TQ检测器、MassLynx4.1质谱工作站(美国Waters公司);全自动酶标仪(美国Bio-Tek公司,型号:ELx80);流式细胞仪(美国Beckman Coulter公司,型号:EPICS XL-MCL ADC);电泳仪(美国Bio-Rad公司,型号:1645050);化学发光凝胶成像仪器(上海天能科技有限公司,型号:Tanon 5500)。
2 方法
2.1 预知子乙酸乙酯萃取物的制备
将10 kg预知子用无水乙醇浸泡3次,第1次7 d,第2次5 d,第3次3 d。合并浸出液过滤后,减压回收溶剂得粗浸膏。将粗浸膏分散于5 L纯水中,用不同极性的溶剂石油醚、乙酸乙酯依次萃取3次,将乙酸乙酯萃取层用旋转蒸发仪减压浓缩,最终得到乙酸乙酯部位干净粉末161.5 g。
2.2 预知子提取物样品活性部位的筛选分离及鉴定
将乙酸乙酯部位161.5 g以硅胶(200~300目)干法拌样,进行中压柱层析(200~300目)分离,用石油醚-乙酸乙酯作流动相进行梯度洗脱(纯石油醚→50∶1→20∶1→10∶1→5∶1→2∶1→纯乙酸乙酯),得到18个馏分,记为1~18。将16馏分12.84 g以反相硅胶(C18)干法拌样,进行低压柱层析(C18)分离,以TLC检测,合并相同的馏分,最后得到25个馏分,记为B1~B25。以对肿瘤细胞的增殖抑制率为效应标准进行筛选,确定B14组分为活性部位[8]。
取B14提取物200 mg,以甲醇/水(1∶1)溶解,制备液相分离。使用HPLC进行分离,色谱柱为Waters X-Bridge C18(4.6 mm×250 mm,5 μm),保护柱为Phenomenex Widepore C18(4 mm×3 mm),流动相为乙腈(A)-水(B),时长50 min。梯度洗脱程序:0~50 min,40%A;检测波长为210 nm;流速为1 mL·min-1;柱温为26 ℃;进样量为20 μL。
2.3 细胞培养与药物溶解
HCT116细胞在含10%胎牛血清的DMEM培养液、37 ℃,5%CO2培养箱中培养。将B14用DMSO溶解,以DMEM培养液稀释至所需浓度,对照组含相应浓度的DMSO而不含B14。将OXA用双蒸水溶解,以DMEM培养液稀释至所需浓度。
2.4 MTT法检测细胞增殖抑制率
2.4.1 B14对HCT116细胞的增殖抑制作用 将HCT116细胞培养至对数生长期,以每孔1×104个细胞接种于96孔板中,设不同浓度B14组(0、2、4、6、8、16、32 μg·mL-1),设置3个复孔,孵育24 h后,每孔加入MTT溶液(5 g·L-1)20 μL,37 ℃避光4 h,每孔加150 μL DMSO振荡10 min,测定490 nm处光密度值(OD),计算细胞增殖抑制率。细胞增殖抑制率=(1-OD给药组/OD对照组)×100%。实验重复3次。
2.4.2 B14增敏OXA对HCT116细胞的增殖抑制作用 将HCT116细胞培养至对数生长期,以每孔1×104个细胞接种于96孔板中,采用正交试验设计方法,B14组设浓度(0、3、6、12、24、32 μg·mL-1),OXA组设浓度(0、7.5、15、25、40、80 μg·mL-1),孵育时间为24 h,均设置3个复孔。检测方法同“2.4.1”。实验重复3次。采用CompuSyn软件分析两药联合效应,并采用中位数效应原理确定复合指数(CI)值。CI=D1/Dx1+D2/Dx2,其中,D1和D2分别表示B14和OXA联合使用产生同等效果所需的剂量,Dx1和Dx2分别表示抑制一定水平细胞生长所需的B14和OXA游离药物剂量。CI<1表示两药联用为协同效应,CI=1为相加作用,CI>1为拮抗作用。
根据MTT的实验数据和软件分析结果,为后续实验确定联合用药最佳药物量效比浓度。
2.5 细胞形态学观察
将HCT116细胞培养至对数生长期,以每孔1×106个细胞接种于6孔板。根据“2.4.2”实验中软件分析得到的最佳量效浓度,将细胞分为对照组、B14组(6 μg·mL-1)、OXA组(15 μg·mL-1)和联合组(6 μg·mL-1B14+15 μg·mL-1OXA)。给药作用24 h后,倒置显微镜下观察细胞形态改变。
2.6 流式细胞术检测细胞凋亡
将HCT116细胞培养至对数生长期,以每孔1×106个细胞接种于6孔板中,分组同“2.5”。加药培养24 h后,消化、离心收集细胞,按照Annexin V-FITC/PI试剂盒说明操作,避光室温孵育15 min后,上流式细胞仪检测各组细胞凋亡率。实验重复3次。
2.7 流式细胞术检测细胞周期
将HCT116细胞培养至对数生长期,以每孔1×106个细胞接种于6孔板中,分组同“2.5”。细胞贴壁后,换不含血清的DMEM培养液,饥饿细胞24 h使细胞周期同步化。加药培养24 h后,消化、离心收集细胞,加入10 mL预冷的70%乙醇,-20 ℃固定过夜。固定结束后,用预冷的PBS洗2遍,再用碘化丙啶(PI)染色,避光、室温反应10 min后上流式细胞仪检测各组细胞周期百分率。实验重复3次。
2.8 Western blot法检测细胞凋亡相关蛋白
各组细胞给药培养24 h后,移去上清,PBS洗3次后吸除,加入含蛋白酶抑制剂和磷酸酶抑制剂的RIPA裂解液,提取细胞总蛋白。BCA法定量蛋白,将各组蛋白浓度调整一致,加入适量4×蛋白上样缓冲液,100 ℃沸水浴10 min,冷却备用。SDS-PAGE凝胶电泳分离后,转移至PVDF膜上,5%脱脂奶粉常温封闭2 h。依次加入PBST稀释的一抗(Bcl-2 1∶2 000;Bax 1∶1 000;Cyt-c 1∶5 000;Cleaved caspase-3 1∶1 000;Caspase-3 1∶5 000;p-p38 MAPK 1∶1 000;p38 MAPK 1∶1 000),4 ℃孵育过夜,PBST洗3次,每次10 min。二抗用PBST稀释至1∶5 000,室温下孵育2 h。洗膜后显色、曝光、拍照,用Image J分析各条带光密度值,蛋白相对表达量=目的蛋白灰度值/GAPDH蛋白灰度值。实验重复3次。
2.9 统计学分析
3 结果
3.1 预知子活性部位B14的测定结果
根据2015年版《中国药典》[9],结合HPLC的检测结果(图1~2),初步分析预知子活性部位B14的主要成分为皂苷B和α-常春藤皂苷。图2中1号峰保留时间为35 min左右,鉴定为皂苷B,全称:3-O-β-D-xylopyranosyl-(1→2)-α-L-arabinopyranosyl hederagenin[10-11];2号峰保留时间为37 min左右,鉴定为α-常春藤皂苷,全称:3-O-α-L-rhamnopyranosyl-(1→2)-α-L-arabinopyranosyl hederagenin[12]。

图1 标准品色谱图Fig.1 The HPLC chromatograms of standard products
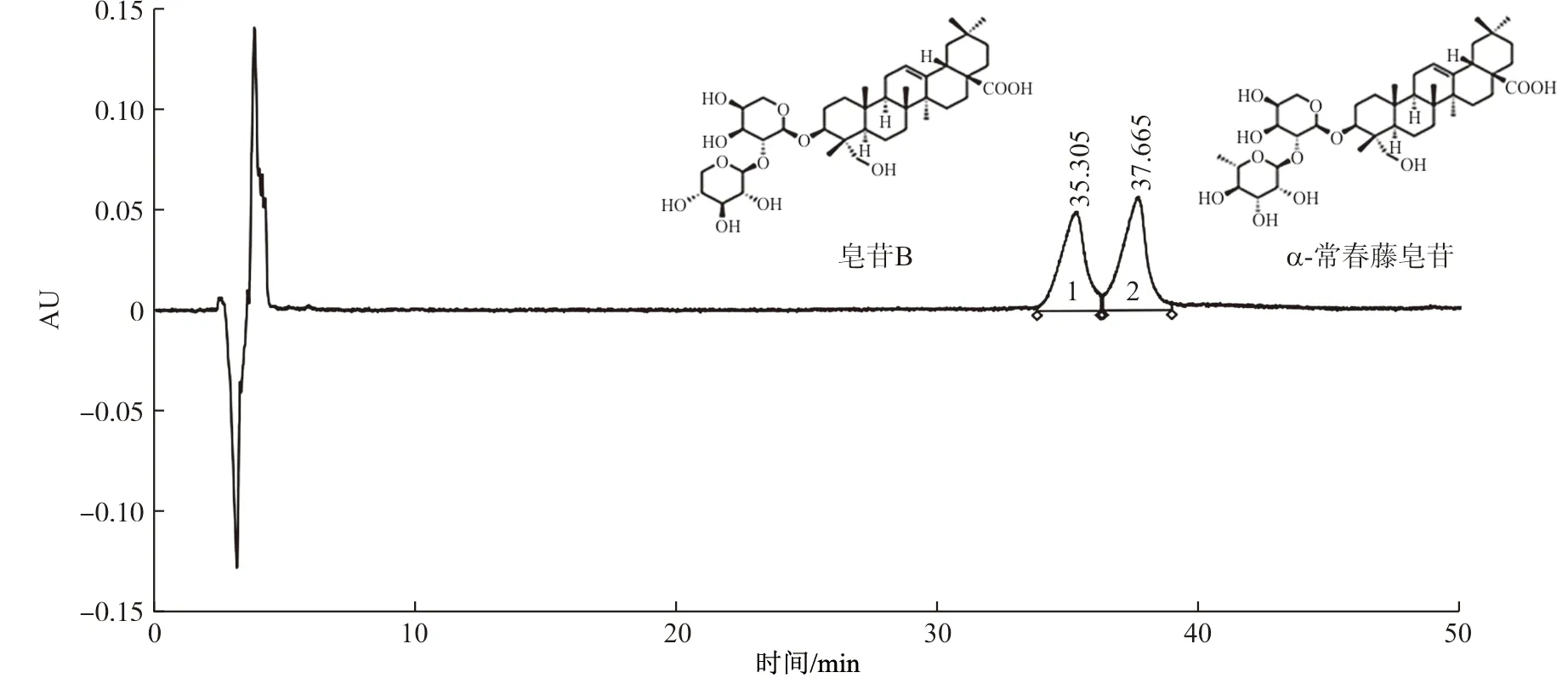
注:1.皂苷B;2.α-常春藤皂苷图2 B14的HPLC图谱Fig.2 The HPLC chromatogram of B14
3.2 B14与OXA对HCT116细胞的增殖抑制作用
B14能抑制HCT116细胞增殖,IC50为18.6 μg·mL-1,且抑制作用呈时间与剂量依赖性,见图3。通过表1分析,联合组的抑制作用强于单药组。6 μg·mL-1B14对HCT116细胞无明显毒性,但与OXA 7.5、15、25、40、80 μg·mL-1联合应用时,其抑制率比单独使用OXA显著提高(P<0.001)。
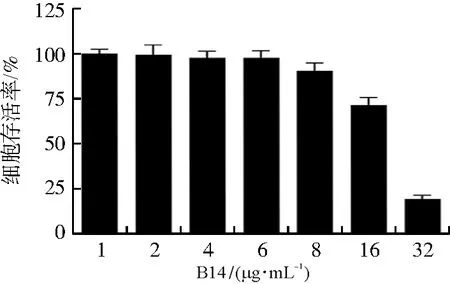
图3 B14对HCT116细胞增殖的作用Fig.3 The effect of B14 on HCT116 cells proliferation

表1 各组HCT116细胞增殖抑制率的比较Table 1 Comparison of inhibitory rates of HCT116 cells proliferation in each group
3.3 联合用药药效评价
将B14联合OXA的不同浓度(3+7.5、6+15、12+25、24+40、32+80 μg·mL-1)抑制率数据输入CompuSyn软件生成图4。提示本研究所选择的药物浓度配比中,6 μg·mL-1B14+15 μg·mL-1OXA方案CI值最小,协同作用最强,为最佳配比,故作为后续实验的浓度。

图4 不同浓度B14+OXA抑制HCT116细胞增殖的联合指数图Fig.4 Fa-CI plot of HCT116 cells proliferation inhibition with different concentrations of B14+OXA
3.4 B14与OXA对HCT116细胞形态的影响
对照组HCT116细胞生长状态良好。B14组与OXA组细胞密度降低,细胞状态变差。联合组相邻细胞连接疏松,细胞增殖减少且形态发生明显变化,出现细胞变圆皱缩等现象,见图5。

A.空白组;B.B14组;C.OXA组;D.联合组图5 各组HCT116细胞形态比较(×100)Fig.5 HCT116 cell morphology in each group (×100)
3.5 B14与OXA对HCT116细胞凋亡的影响
与对照组比较,B14组凋亡率有轻度升高,但无明显统计学意义。OXA组细胞凋亡率高于对照组(P<0.01),但联合组具有显著诱导HCT116细胞凋亡的作用,差异均有统计学意义(P<0.001),见图6。
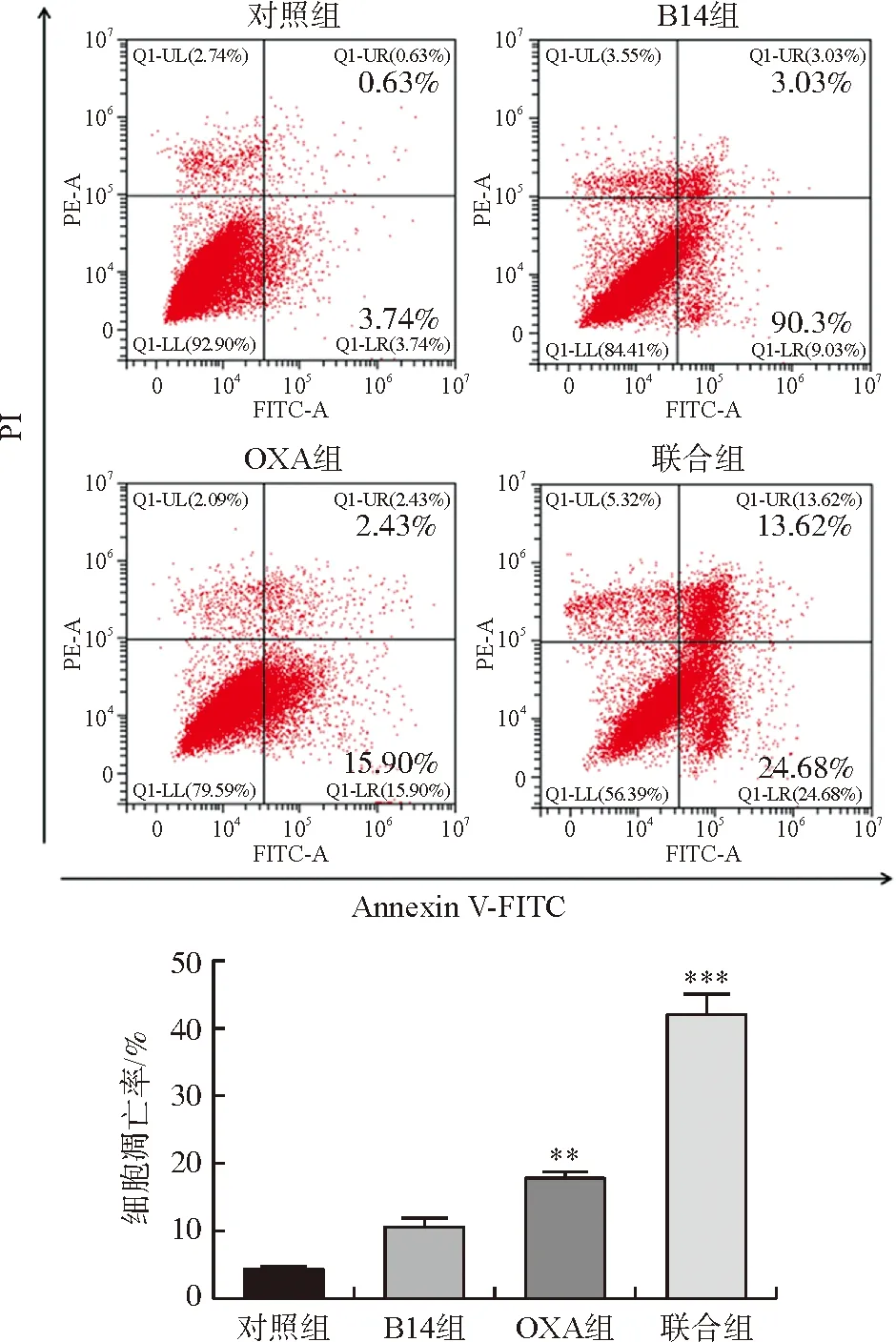
注:与对照组比较,图6 各组HCT116细胞凋亡的比较Fig.6 The apoptosis rates of HCT116 cells in each group
3.6 B14与OXA对HCT116细胞周期的影响
与对照组比较,OXA组和联合组HCT116细胞明显被阻滞于G2/M期,S期细胞减少,差异均有统计学意义(P<0.001),见图7。
3.7 B14与OXA对HCT116细胞内蛋白表达水平的影响
与对照组比较,OXA组和联合组HCT116细胞中Bcl-2、Caspase-3蛋白表达及Bcl-2/Bax比值显著降低(P<0.01,P<0.001),Bax、Cyt-c、Cleaved caspase-3、Cleaved caspase-3/Caspase-3比值及p-p38 MAPK显著升高(P<0.05,P<0.01,P<0.001)。与OXA组比较,联合组Bcl-2、Caspase-3及Bcl-2/Bax比值显著降低(P<0.01,P<0.001),Bax、Cyt-c、Cleaved caspase-3、Cleaved caspase-3/Caspase-3比值及p-p38 MAPK显著升高(P<0.05,P<0.01,P<0.001),见图8。
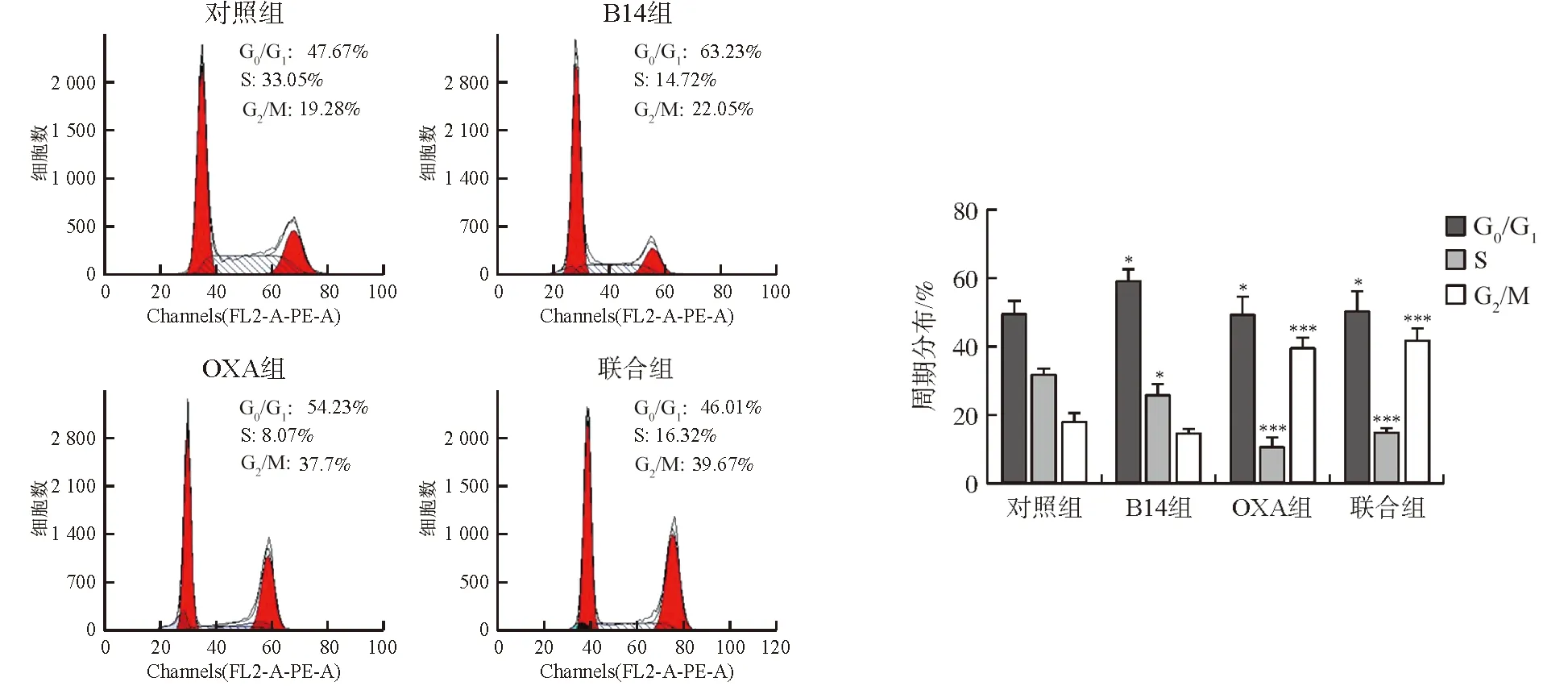
注:与对照组比较,图7 各组HCT116细胞周期的比较Fig.7 The cycle distribution of HCT116 cells in each group
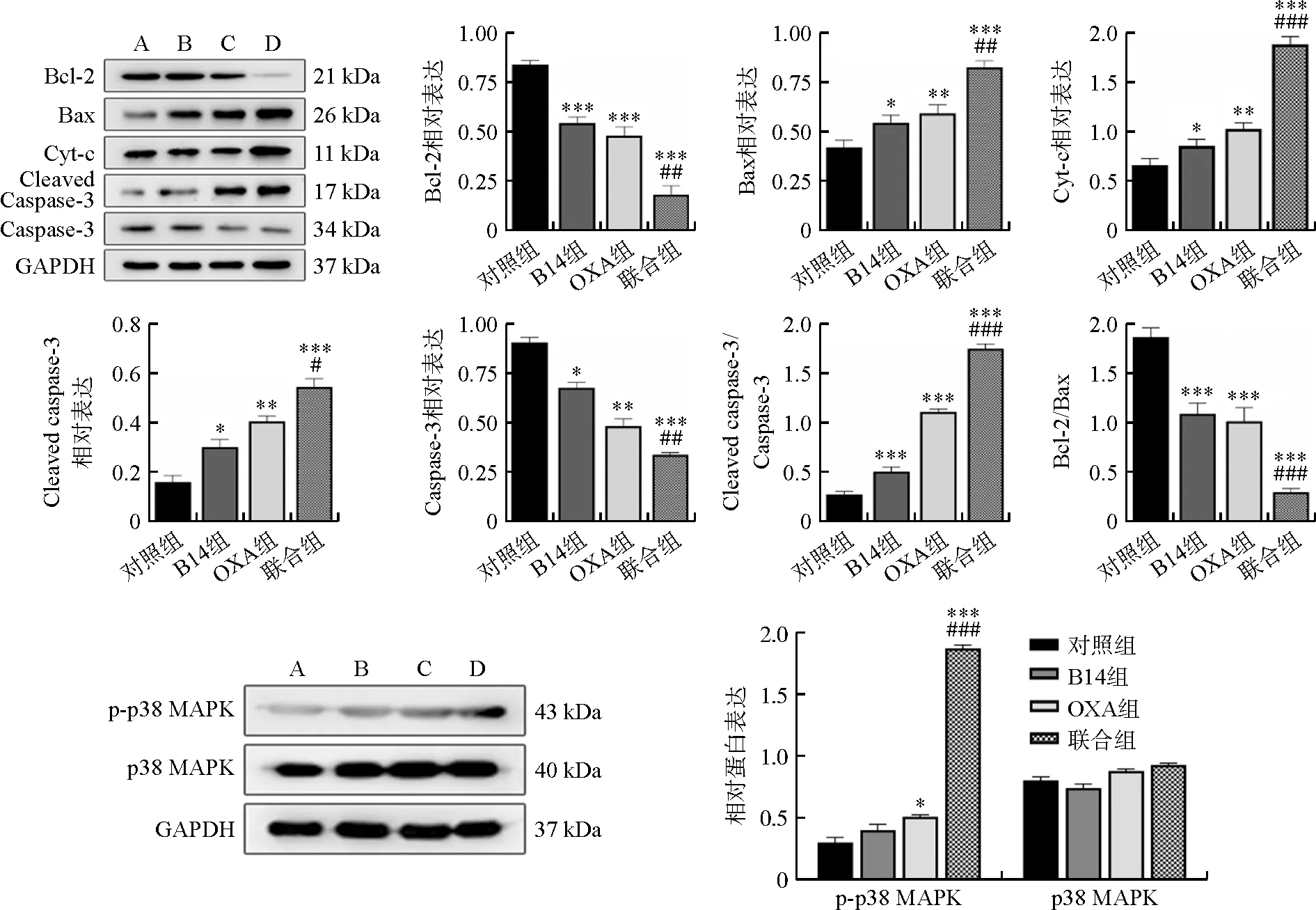
注:A.对照组;B.B14组;C.OXA组;D.联合组;与对照组比较,*P<0.05,**P<0.01,***P<0.001;与OXA组比较,图8 各组p38 MAPK信号通路及凋亡相关蛋白的表达情况Fig.8 The expressions of p38 MAPK signal pathway and apoptosis related proteins in each group
4 讨论
结直肠癌常由致癌因子引起细胞无限增殖,治疗的关键是诱导肿瘤细胞凋亡[13]。OXA常用于治疗Ⅱ、Ⅲ期结直肠癌,其抗肿瘤作用显著,但也常引起骨髓抑制、神经毒性等不良反应,降低患者生活质量,影响临床化疗效果。OXA毒副作用的产生与剂量累积密切相关[14]。近年来,基于增效减毒目的的OXA与其他药物联合使用的临床与实验研究表明,在不影响OXA抗肿瘤疗效的前提下,降低OXA的使用量是减少其毒副作用的可能途径之一。肖海娟等[15]研究发现,肠胃清粗提物协同增效OXA对结肠癌HCT116细胞的化疗敏感性。冯杰等[16]研究发现,葫芦素B促进Cleaved caspase-3和Bax蛋白表达,抑制Caspase-3和Bcl-2蛋白表达,诱导结肠癌SW480细胞凋亡,与OXA联合后抑制作用更显著。
研究表明,预知子是中医治疗肿瘤行气活血治法的代表药,对肝癌、大肠癌、胃癌等具有抑制作用,但研究成果主要集中在临床经验及实验研究中,预知子抗肿瘤的机制研究仍有相当大的空间。吴晓等[17]研究发现,预知子醇提物协同雷公藤红素具有显著抑制SMMC7721细胞增殖及凋亡的作用,其机制可能与内质网应激和自噬有关。张瑜等[18]研究发现,预知子醇提物可抑制H22细胞小鼠移植瘤的生长,减轻化疗的毒副作用。
根据本研究HPLC图显示,通过与对照品比对,乙腈溶剂峰对皂苷B和α-常春藤皂苷的峰没有影响;对照品与B14样品溶液中的皂苷B和α-常春藤皂苷的保留时间基本相同,RSD值均小于2.0%,故该色谱条件适合作为B14定性的HPLC色谱条件,预知子的抗肿瘤活性部位B14的主要成分为皂苷B和α-常春藤皂苷。MTT结果提示,联合组细胞增殖抑制率显著高于B14单药组(P<0.001)或OXA单药组(P<0.05,P<0.001),提示B14可以增强HCT116细胞对OXA的化疗敏感性。CompuSyn结果提示,B14与OXA联合可能存在最佳抑制效果的浓度配比,即浓度分别为6 μg·mL-1和15 μg·mL-1。B14促进细胞凋亡的作用并不显著,但可以显著增加OXA诱导的细胞凋亡(P<0.001)。与对照组比较,联合组和OXA组细胞G2/M期比例明显升高,S期细胞百分率降低,差异均有统计学意义(P<0.001),说明联合组和OXA组将HCT116细胞阻滞在了G2/M期。
既往研究表明,p38 MAPK属于丝裂原活化蛋白激酶,参与调控肿瘤细胞的增殖、凋亡等多种生物学过程。一旦肿瘤形成,p38 MAPK常处于低活化状态。本实验发现低剂量6 μg·mL-1B14联合OXA可以诱导结直肠癌细胞凋亡,激活p38 MAPK磷酸化,可能与介导Bax释放至线粒体膜上,破坏膜内外离子浓度差,进而使Cyt-c释放到细胞质中,激活Caspase-3,引发的细胞凋亡级联反应[19]相关。Bcl-2/Bax是调节细胞存活与凋亡的经典信号通路,其中Bcl-2是抗凋亡因子,Bax是促凋亡因子[20]。二者结合后可以激活Caspase-3途径,加速结直肠癌细胞凋亡[21]。Cleaved caspase-3是调控细胞凋亡过程的核心因子,也是预知子治疗肿瘤的潜在靶点,通过活化Caspase-3,激活级联反应,诱导细胞凋亡[22]。因此,B14可能成为一种潜在的OXA化疗增敏剂,可降低OXA的使用量,进一步限制其副作用。
综上所述,预知子提取物B14可增加结肠癌HCT116细胞的OXA化疗敏感性,这种作用可能与阻滞细胞周期在G2/M期及激活p38 MAPK介导的线粒体凋亡通路有关。本研究结果为临床减轻OXA毒副作用、提高化疗疗效提供了方向和线索。同时,由于B14是包含2种成分的混合物,其确切的增敏OXA的活性成分及机制将在今后进行深入研究。

