逍遥散通过PI3K/AKT/mTOR通路调节mPFC-BLA髓鞘功能改善VaD小鼠焦虑抑郁行为
单楠,谭子虎,2,杨冰,尹茜茜,马峥玲
(1.湖北中医药大学中医临床学院,湖北 武汉 430065;2.湖北省中医院老年病科,湖北 武汉 430061;3.湖北省第三人民医院中医科,湖北 武汉 430030)
血管性痴呆(Vascular dementia,VaD)是仅次于阿尔茨海默病的第二大痴呆类型[1]。随着心脑血管疾病患病率的显著增加,VaD发病率也呈明显上升趋势[2]。获得性认知能力下降是痴呆的主要特征,但越来越多的证据表明,神经精神症状在VaD中非常普遍,最常见的行为和情绪症状是抑郁、冷漠、躁动和易怒[3]。痴呆伴随的精神行为异常,导致医疗和社会负担加重、预后恶化,与认知障碍一起作为两大核心标准被纳入诊断指南[4]。目前对其机制还缺乏足够清晰全面的阐释。仅以神经元死亡难以解释精神症状的波动性[5],提示其他病理机制存在的可能。
少突胶质细胞(Oligodendrocyte,OL)和髓鞘异常与精神性疾病发病密切关联[6-8]。一些脱髓鞘疾病如多发性硬化症等,除运动-感觉功能异常外,也会有部分精神异常症状[9]。白质病变和脱髓鞘是VaD的重要病理特征,而VaD患者缺血性白质损伤可以导致脑内功能网络结构紊乱和功能连接障碍[10]。提示髓鞘受损很可能是VaD合并焦虑抑郁独立于神经元死亡以外的重要病理基础。
目前,痴呆伴随精神行为异常缺乏安全有效的治疗方法,非药物干预在临床实践中常难以得到执行,而抗精神病药物的使用反而加剧认知功能恶化[11],增加死亡风险[12]。有研究显示,使用5-羟色胺再摄取抑制剂类抗抑郁药舍曲林,12周治愈率仅为33%[13],因此,针对VaD伴随精神行为异常进行机制研究和药物开发,显得尤为迫切。逍遥散(Xiaoyao Powder,XYP)源于宋代《太平惠民和剂局方》,已有临床研究初步发现,逍遥散可以改善VaD伴随的抑郁症状,降低康奈尔痴呆抑郁量表评分及中医证候积分[14-15]。因此,本研究拟采用VaD合并焦虑抑郁动物模型,深入研究逍遥散对髓鞘结构和功能的影响及其具体作用机制,从而为逍遥散在痴呆伴随精神行为异常中的应用提供更充分的研究证据。
1 材料
1.1 动物
60只3月龄SPF级雄性C57BL/6小鼠,体质量24~30 g,购于湖北省实验动物中心,许可证号:SCXK(鄂)2020-0018,饲养于湖北省中医院实验动物中心,温度(21±3)℃,相对湿度(60±5)%,自由摄食摄水,12 h明暗交替。本实验获得湖北省中医院伦理委员会批准,伦理审批号:HBZY2020-C47-01。
1.2 药物
逍遥散剂量参照《方剂学》[16]所载(60 kg成人日用量),由柴胡9 g,当归9 g,白术9 g,白芍9 g,茯苓9 g,生姜9 g,炙甘草4.5 g,薄荷1.5 g组成,均购于湖北省中医院药剂科,浸泡30 min后,分3次煎煮,过滤合并水煎液,生药浓度为1 g·mL-1,低剂量逍遥散用超纯水稀释至生药浓度为0.5 g·mL-1的水煎液,高剂量逍遥散浓缩至生药浓度为2 g/mL的水煎液,分装后-20 ℃保存。盐酸氟西汀胶囊(每粒20 mg,法国Patheon公司,批号:J20170012)购于湖北省中医院,氟西汀溶于生理盐水制成浓度为1 mg·mL-1的溶液。
1.3 试剂
DAPI、BCA试剂盒、ECL显影液购于上海碧云天生物技术有限公司(批号:C1006、P0012、P0018AM),一抗MAG、MOG、GAPDH购于武汉三鹰生物技术有限公司(批号:14386-1-AP、12690-1-AP、60004-1-Ig);MBP、PI3K、p-PI3K(Tyr458/Tyr199)、AKT、p-AKT(Ser473)、mTOR、p-mTOR(Ser2448)抗体购于美国Cell Signaling Technology公司(批号:78896、4249、17366、2920、4060、2972、5536);化学二抗羊抗鼠、羊抗兔购于美国Jackson ImmunoResearch公司(批号:115-005-003、111-005-003),荧光二抗驴抗兔AF555购于SouthernBiotech(批号:6441-32)。
1.4 仪器
蛋白电泳及转印装置(美国Bio-Rad公司,044BR8277),超声破碎仪(上海净信实业发展有限公司,XM-650T),全自动倒置荧光显微镜(德国Carl Zeiss公司,Observer Z1),酶标仪(上海科华生物工程股份有限公司,KHB ST-360),高速冷冻离心机(美国Beckman公司,AllegraX-30R),体视显微镜(上海光学仪器厂,PXS-1040)。
2 方法
2.1 双侧颈总动脉狭窄(Bilateral carotid artey stenosis,BCAS)法构建VaD小鼠模型
术前12 h予各组小鼠禁食不禁水,1%戊巴比妥钠腹腔注射麻醉后,剪开颈部正中皮肤,分离小鼠双侧颈总动脉。在体视显微镜下,将微型线圈(直径0.08 mm,内径0.18 mm,螺距0.5 mm,全长2.5 mm)以螺旋转入方式固定于双侧颈总动脉,造成BCAS。2周后进行水迷宫实验,筛选认知功能障碍小鼠应用于后续实验。假手术组只分离颈总动脉,不予弹簧圈置入。
2.2 慢性束缚应激(Chronic restraint stress,CRS)方法
将通过筛选的VaD小鼠给予束缚应激(50 mL离心管管壁均匀开小窗,供小鼠呼吸及散热,束缚期间禁食禁水),于每日固定时间9:00 am开始,束缚6 h,假手术组只禁食禁水,不予束缚。
2.3 动物分组及给药
其中10只假手术+无束缚小鼠为对照组,将50只BCAS+CRS造模小鼠随机分为模型组,氟西汀组以及逍遥散低、中、高剂量组,每组10只,给药过程中同时继续CRS维持。其中逍遥散低、中、高剂量组小鼠给予的生药剂量分别为5、10、20 g·kg-1·d-1,氟西汀组小鼠按10 mg·kg-1·d-1剂量给予氟西汀溶液,对照组和模型组每日予等量生理盐水,每日1次,共计4周。
2.4 行为学检测方法
2.4.1 强迫游泳实验 强迫游泳实验测试工具为透明塑料圆筒(20 cm×10 cm),水面高12 cm,温度(22±3)℃。实验开始时将小鼠放入水中,测试时间为6 min,视频记录整个过程,统计每只小鼠在测试后4 min内的不动时间。
2.4.2 旷场实验 将小鼠放置在一个50 cm×50 cm×40 cm的白色敞箱中,敞箱底面平均划分为16个小方格。统计5 min内小鼠在旷场内的运动总距离、旷场中心区域时间,评估小鼠焦虑状态。
2.4.3 高架十字迷宫实验 将小鼠置于中央区为5 cm×5 cm,开放臂和闭合臂长为35 cm,距离地面50 cm的高架十字迷宫装置中。记录小鼠在高架十字迷宫装置5 min内进入开放臂和封闭臂的次数,在开放臂和在封闭臂内的停留时间。进入开放臂次数百分比=开放臂进入次数/(开放臂进入次数+封闭臂进入次数)×100%;开放臂停留时间百分比=开放臂停留时间/(开放臂停留时间+封闭臂停留时间)×100%。
2.4.4 糖水偏好实验 测试前训练小鼠适应含糖饮水,每笼同时放置2个水瓶,第1个24 h内,2瓶均为1%蔗糖水,随后的24 h内,1瓶盛1%蔗糖水,另1瓶为纯水。正式测试时,首先禁食禁水24 h,再予每只小鼠事先定量好的1瓶1%蔗糖水和1瓶纯水,测试期间每6 h更换水瓶位置,24 h后,取2瓶水称量,计算小鼠糖水偏好率=糖水消耗量/总液体消耗量×100%。
2.5 动物处理及取材
行为学检测后,每组随机取4只小鼠,1%戊巴比妥钠麻醉,4%多聚甲醛心脏灌注后取脑,蔗糖溶液梯度脱水,包埋,冰冻切片后置入防冻液,-20 ℃保存,用于免疫荧光和LFB染色;剩余6只小鼠取新鲜脑组织,取前额叶皮层(Medial prefrontal cortex,mPFC)、基底外侧杏仁核(Basolateral amygdala,BLA)装于不同EP管,-80 ℃保存,用于Western blot实验。
2.6 免疫荧光染色
取脑片贴于玻片上,待干,组化笔画圈,0.5%Triton破膜40 min,PBS洗3遍,5%BSA封闭1 h,一抗(MBP 1∶1 000稀释)4 ℃过夜,弃一抗,PBS洗3遍,二抗(AF555 1∶500稀释)室温孵育4 h后,弃二抗,PBS洗3遍,DAPI封片,荧光显微镜采集图像。
2.7 Western blot检测
分别取适量脑组织加入RIPA裂解液,在超声下破碎,离心后取上清,BCA试剂盒检测蛋白浓度,配平待测。电泳、转膜,5%脱脂奶粉封闭2 h,一抗(均按1∶1 000稀释)4 ℃过夜;PBS洗3遍,二抗室温孵育2 h(1∶10 000);PBS洗3遍,ECL发光液使条带可视化,Image J测条带灰度值进行分析。
2.8 LFB染色
将冰冻切片贴于明胶包被的玻片,待干后复水2次,然后置于0.1%LFB中,在28 ℃恒温箱中过夜。次日用95%乙醇去除多余染料、蒸馏水漂洗,再用0.05%碳酸锂分化,梯度脱水,二甲苯透明后封片,随后进行图像采集。
2.9 统计学分析
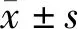
3 结果
3.1 逍遥散对小鼠焦虑抑郁表型的影响
与对照组相比,模型组小鼠存在明显抑郁、焦虑行为,表现在旷场实验中运动总距离、中心区运动时间,高架十字迷宫中开放臂停留时间百分比、进入次数百分比减少(P<0.01);给予高剂量逍遥散干预后,运动总距离、中心区运动时间,开放臂停留时间百分比、进入次数百分比增加(P<0.01)。与对照组相比,模型组小鼠表现出不动时间增加(P<0.01),糖水偏好率降低(P<0.01)。中、高剂量逍遥散干预后,模型小鼠糖水偏好率增加(P<0.01),不动时间缩短(P<0.05,P<0.01)。见图1。
注:与对照组比较,##P<0.01;与模型组比较,图1 逍遥散对小鼠焦虑抑郁表型的影响Fig.1 Effect of XYP on anxiety and depression phenotype in mice
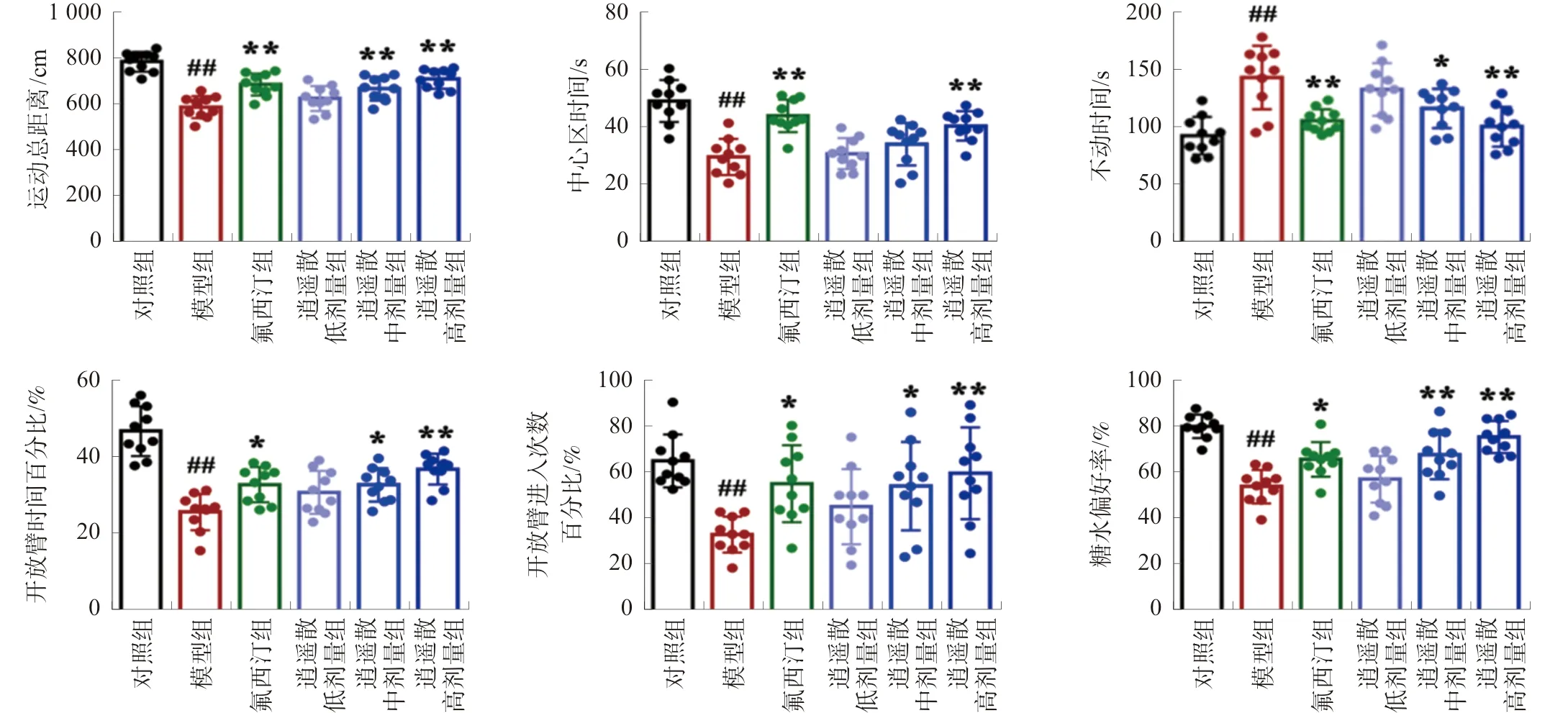
3.2 逍遥散对模型小鼠mPFC和BLA中髓鞘相关蛋白表达的影响
Western blot结果显示:与对照组相比,模型组小鼠mPFC和BLA中髓鞘相关蛋白MBP、MAG、MOG均显著下降(P<0.01);与模型组比较,逍遥散中、高剂量组mPFC和BLA中髓鞘相关蛋白MBP、MAG、MOG显著上调(P<0.01)。见图2。
注:与对照组比较,##P<0.01;与模型组比较,图2 逍遥散对小鼠mPFC-BLA髓鞘相关蛋白表达的影响Fig.2 Effect of XYP on the expressions of myelin associated-proteins in mPFC and BLA of mice
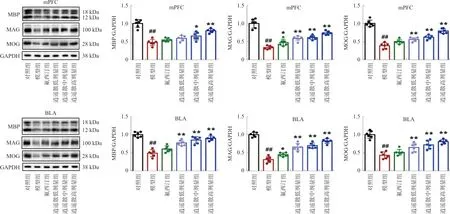
3.3 逍遥散对模型小鼠mPFC和BLA髓鞘蛋白MBP荧光表达的影响
与对照组相比,模型组小鼠mPFC和BLA中MBP荧光强度明显降低(P<0.01),结构显示不清;与模型组比较,逍遥散各剂量组和氟西汀组荧光强度均显著增加(P<0.05,P<0.01)。见图3~4。
3.4 逍遥散对模型小鼠胼胝体(Corpus callosum,CC)髓鞘损伤的影响
免疫荧光染色结果显示:与对照组相比,模型组小鼠CC中MBP荧光强度明显降低(P<0.01),结构欠清晰,通过药物干预后,各组小鼠MBP荧光强度有不同程度增加(P<0.01)。LFB染色结果显示:对照组小鼠CC髓鞘蓝染清晰,无脱髓鞘改变;模型组小鼠CC着色变浅,髓鞘纤维排列疏松,提示在模型组小鼠中存在明显脱髓鞘变化。给予中、高剂量逍遥散和氟西汀干预后,小鼠CC染色程度及髓鞘结构有所恢复。见图5~6。
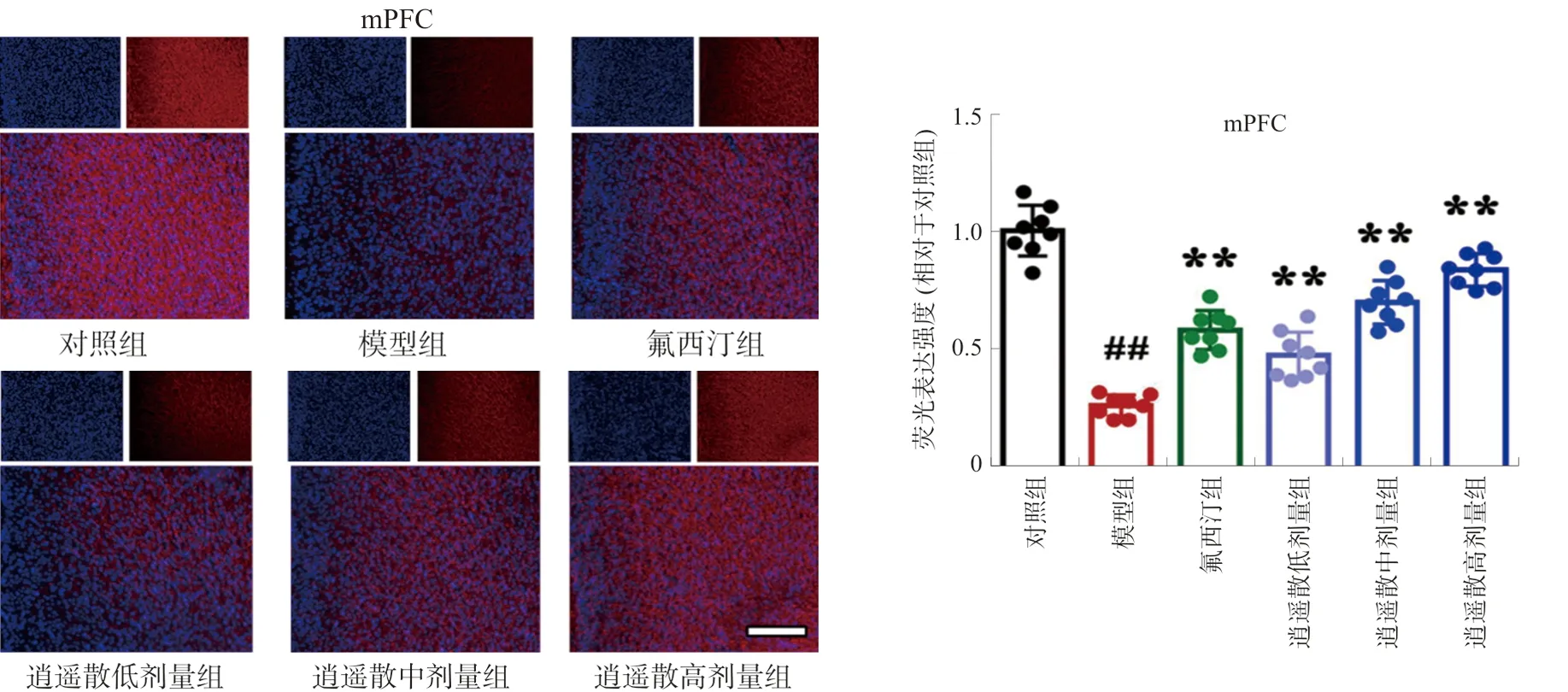
注:与对照组比较,##P<0.01;与模型组比较,图3 逍遥散对mPFC中MBP荧光表达的影响Fig.3 Effect of XYP on the fluorescence expression of MBP protein in mPFC
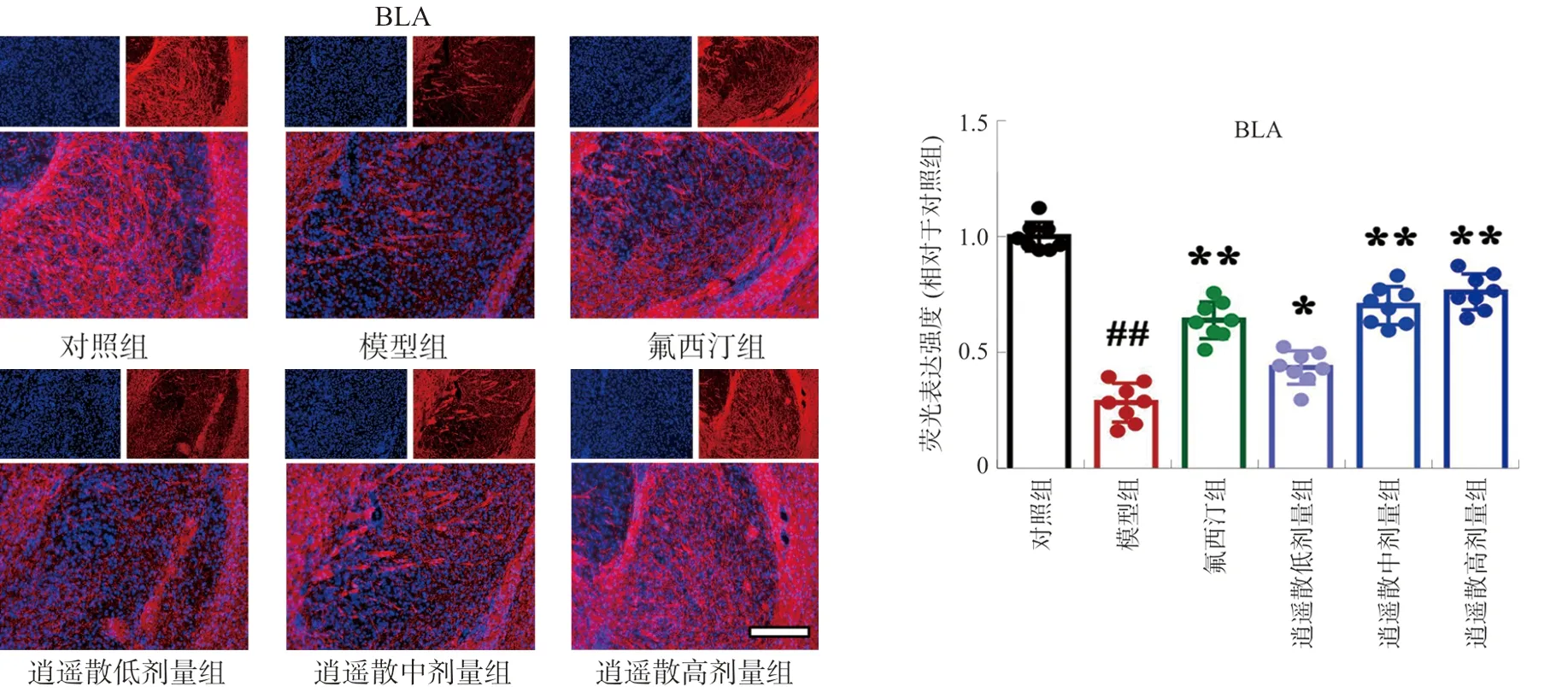
注:与对照组比较,##P<0.01;与模型组比较,图4 逍遥散对BLA中MBP荧光表达的影响Fig.4 Effect of XYP on the fluorescence expression of MBP protein in BLA

注:与对照组比较,##P<0.01;与模型组比较,图5 各组小鼠CC中MBP免疫荧光图及相对荧光强度统计图Fig.5 Immunofluorescence diagram and relative fluorescence intensity statistical diagram of MBP in CC in each group

图6 各组小鼠CC LFB染色代表图Fig.6 Representative diagram of LFB staining in CC in each group
3.5 逍遥散对模型小鼠mPFC和BLA中PI3K/AKT/mTOR通路蛋白表达的影响
Western blot结果显示:与对照组相比,模型组小鼠mPFC和BLA中p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR蛋白相对表达水平明显降低(P<0.01);与模型组比较,逍遥散中、高剂量组及氟西汀组小鼠mPFC和BLA核团中p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR蛋白相对表达水平有不同程度增加(P<0.01)。见图7。
4 讨论
本研究通过BCAS模拟慢性脑低灌注,结合CRS模拟VaD常有的行动受限。在我们此前研究中,VaD合并焦虑抑郁动物模型已被证实具有很好的表面效度和建构效度[17]。本研究结果显示,与对照组相比,模型组小鼠表现出明显的焦虑抑郁行为:强迫游泳实验中小鼠不动时间显著增加,糖水偏好率降低,在旷场实验中表现出中心区活动时间明显减少,高架十字迷宫实验表现进入开放臂次数及时间明显减少。逍遥散干预后模型组小鼠的糖水偏好率以及在旷场实验中的中心区时间、高架十字迷宫实验中进入开放臂次数及时间均显著增加,强迫游泳实验中的不动时间减少。以上行为学测试结果表明逍遥散能有效地改善模型组小鼠焦虑抑郁行为表型。
mPFC和BLA是参与抑郁症和焦虑症等精神疾病发病过程的关键核团[18]。mPFC与其他大脑区域的丰富联系在记忆、认知、决策、社会行为和情绪中起着关键作用[19]。BLA被认为是编码情绪效价并指导行为的关键结构,主导焦虑、恐惧及其他负面情绪形成。mPFC通过对BLA的纤维投射形成自上而下的抑制性控制,这一过程需要环路神经元之间信号传递的高度协同[20]。缺血导致的髓鞘受损引起神经电传导延迟,使空间上离散的神经核团在信息传递的时间同步性上出现不协调,以致大脑在执行自发行动时产生预测错误,引起行为混乱[21-22]。本研究结果显示:模型组小鼠mPFC、BLA髓鞘相关蛋白MBP、MAG和MOG表达显著降低,逍遥散可以部分逆转这一改变;同时,对mPFC、BLA及大脑重要的神经纤维束CC进行MBP免疫荧光染色和LFB染色,证实逍遥散能减轻髓鞘损伤,可能是其改善模型小鼠精神行为异常的重要作用机制。

注:与对照组比较,##P<0.01;与模型组比较,图7 逍遥散对小鼠mPFC-BLA PI3K/AKT/mTOR通路蛋白表达的影响Fig.7 Effect of XYP on the expression of mPFC and BLA PI3K/Akt/mTOR pathway protein in mice
髓鞘损伤后,机体启动包括少突胶质前体细胞(OPC)迁移、增殖、分化成新的OL并重新包裹轴突形成髓鞘等一系列复杂过程,以恢复轴突传导功能。有研究表明PI3K/AKT/mTOR是参与OPC迁移、增殖的重要信号通路[23]。PI3K是由调节亚基p85和催化亚基p110构成的二聚体,与生长因子受体结合后,可改变AKT蛋白结构使其活化,并以磷酸化作用激活下游mTOR,从而调节OPC的增殖、分化以及迁移等[24-25]。研究显示,上调AKT/mTOR信号通路明显增加小鼠CC髓鞘厚度及脑白质体积[26],而条件性敲除PI3K/AKT上游抑制剂PTEN会导致小鼠中枢系统髓鞘明显增加[27]。脑慢性低灌注会抑制PI3K/AKT/mTOR通路的激活,使OPC募集及正常分化受阻,导致脑白质损伤加重[28]。通过对逍遥散中136种有效成分进行生信分析及体外验证显示,PI3K/AKT信号通路是逍遥散减轻缺血性卒中损伤的主要效应通路[29]。我们检测了mPFC和BLA神经核团中PI3K/AKT/mTOR信号通路蛋白表达变化。模型组小鼠p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR水平明显降低,而在给予逍遥散干预后,mPFC和BLA神经核团中p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR蛋白表达水平显著增加。提示逍遥散可能通过激活PI3K/AKT/mTOR信号通路,参与调节mPFC-BLA神经环路髓鞘的形成,从而改善VaD焦虑抑郁表型。
VaD伴抑郁、焦虑可归属于中医“郁证”范畴。郁证以气郁为先,总体虽可概括为虚、郁、瘀三个方面,但在脑血管疾病的病理基础下,气郁血滞则精血不能上荣于头窍,瘀血阻滞于脑脉经络而致神机失用,则以“气郁”与“留滞”互为因果,病情更甚。逍遥散由柴胡、当归、白芍、白术、茯苓、甘草、薄荷、生姜共8味药物组成,肝脾同调,气血兼顾,刚柔相济,疏散有度。针对VaD气郁血虚、脑窍失养的病机特点,逍遥散疏肝解郁、气血条达,精血津液之精华上达头目,充髓养神。逍遥散在长期临床应用中,其安全性和有效性得到了充分证实。我们的研究结果也表明,逍遥散可能是治疗VaD伴精神行为异常更好的选择。
综上所述,本研究从神经环路髓鞘功能角度探讨了逍遥散改善VaD伴随精神行为异常的作用机制,显示逍遥散可能通过激活PI3K/AKT/mTOR信号通路,促进mPFC-BLA神经环路髓鞘再形成,增加神经核团间信息整合能力,从而改善VaD小鼠焦虑抑郁表型。在后续工作中我们将进一步利用光遗传学调控、在体场电位记录等工具,针对髓鞘病理在VaD合并焦虑抑郁中角色进行验证探索和更深入的药物机制研究,可能为这一临床棘手难题提供有希望的干预靶点和药物选择。

