利用大孔树脂分离灵芝菌丝体中水溶性抗氧化成分
韩 伟,郑丹婷,姚泽远,卜原玲,冯 杰
(1.华东理工大学 药学院 a.制药工程与过程化学教育部工程研究中心,b.上海市新药设计重点实验室,上海 200237;2.上海市农业科学院食用菌研究所 国家食用菌工程技术研究中心,上海 201403)
氧自由基的不断积累会导致细胞内多种物质氧化,造成DNA、蛋白质和生物膜的损伤,继而引发许多重大疾病,如:动脉粥样硬化、风湿性关节炎、糖尿病、癌症等[1],因此抗氧化剂的开发对于上述疾病的预防具有重要意义.曾被大量使用的化学合成抗氧化剂,如二丁基羟基甲苯(BHT)、丁基羟基茴香醚(BHA)经动物实验发现有一定的毒性和致畸作用[2],故安全、低毒的天然抗氧化剂开发成为了学者研究热门课题.
灵芝(Ganodermalucidum)是我国传统名贵药用真菌之一,现代研究发现灵芝中粗多糖[3]、三萜[4]、甾醇[5]、蛋白质[6]、生物碱[7]等物质,均具有一定的抗氧化活性.野生灵芝受地域、季节、原料等因素的影响,品质较差、生长周期长且成本较高[8].灵芝菌丝体为灵芝营养体的基本结构,可通过液态发酵技术快速获得,且可以通过对培养条件的调整,得到含有更多目标成分(如三萜、生物碱、氨基酸等)的菌丝体[9-11],使得灵芝天然抗氧化剂的开发成为可能.
大孔树脂凭借其高选择性、易解吸、低能耗以及目标产物活性不被破坏等优势在天然产物分离中得到广泛应用.本文在课题组前期研究的基础上[12],以DPPH清除率、ABTS清除率和羟自由基清除率为评价指标,采用大孔树脂对灵芝菌丝体水提液(Ganoderma lucidum mycelium water extraction,GLMw)中的抗氧化活性物质进行分离,并对大孔树脂分离前后物质的抗氧化活性进行比较.
1 材料和方法
1.1 实验材料
灵芝菌丝体样品,由上海市农科院食用菌所提供.
ABTS,上海毕得医药科技有限公司;过硫酸钾、水杨酸、七水合硫酸亚铁、30%过氧化氢、氢氧化钠、磷酸二氢钠、磷酸氢二钠(分析纯),上海凌峰化学试剂有限公司;DPPH,上海耐澄生物科技有限公司;无水乙醇,上海泰坦化学有限公司;X-5、D-101、AB-8、NKA-9大孔树脂,天津浩聚树脂科技有限公司;DM-130、HPD-400大孔树脂,郑州和成新材料科技有限公司;DM-301大孔树脂,罗恩试剂;S-8大孔树脂,北京索莱宝科技有限公司.
UV1900紫外-可见光分光光度计,上海亚研电子科技有限公司;AL104分析天平,梅特勒-托利多仪器有限公司;LCD-SK5210HP功率可调台式加热系列超声仪,上海科导超声仪器有限公司;H1650-W台式微量高速离心机,湖南湘仪实验室仪器开发有限公司;RE-2010旋转蒸发器,上海予华仪器设备有限公司;PHS-25 pH计,上海仪电科学仪器有限公司.
1.2 实验方法
1.2.1 灵芝菌丝体浓缩液的制备
根据课题组前期研究的结果[12],确定灵芝菌丝体浓缩液制备方式如下:
分别称取5份灵芝菌丝体样品粉末各1.0 g,于圆底烧瓶中,按液固比50∶1各加入50 mL去离子水,摇匀,充分浸润5 min后,于50 ℃、156 W的条件下超声提取60 min.抽滤后将滤液浓缩合并,得到灵芝菌丝体浓缩液.
1.2.2 大孔树脂的预处理
表1表示出了不同型号大孔树脂的性能指标,取适量不同型号的大孔树脂,分别于100 mL锥形瓶中,用95%乙醇浸泡24 h,除去上浮的碎片和杂物后湿法装柱.95%乙醇洗至流出液无浑浊后,用去离子水将树脂洗至无乙醇味.用5% NaOH浸泡4 h后,水洗至pH=7,再用5% HCl浸泡4 h,水洗至pH=7.将处理好的大孔树脂用去离子水密封置于冰箱保存,备用.

表1 不同型号大孔树脂的性能指标
1.2.3 大孔树脂静态吸附-解吸实验
1)大孔树脂的筛选
①将1.2.1制备的灵芝菌丝体浓缩液稀释为5 mg/mL的样品溶液,由于灵芝菌丝体浓缩液为混合物,为使不同溶液的体外抗氧化活性具有比较意义,此处参考蔡梦婷等[13]的表述方法,将待测物表示为每毫升提取液中含有的原材料质量(如5 mg/mL表示为5 mg灵芝菌丝体原材料经提取和大孔树脂分离等操作后得到1 mL溶液,下同).
②量取1.2.2中经预处理得到的大孔树脂各50 mL于100 mL锥形瓶中,向每个瓶中各加入上述水提液50 mL,盖上塞子,在室温下吸附12 h,待吸附充分后抽滤,将滤液浓缩后定容至25 mL容量瓶,稀释10倍后测定水提液经各大孔树脂吸附后的体外抗氧化活性.
③抽滤后的大孔树脂用少量去离子水洗涤后,分别用50 mL 95%乙醇转移至锥形瓶,盖上塞子后在室温下解吸16 h,然后进行抽滤,抽滤后的大孔树脂进行再生处理,将滤液中的乙醇旋干后用去离子水定容至25 mL,稀释10倍后测定解吸后各样品溶液的体外抗氧化活性.
2)上样质量浓度的筛选
将1.2.1中制备的灵芝菌丝体浓缩液稀释为50 mg/mL的样品溶液后,再分别稀释至1、2、4、6、8、10、15、20、30、40、50 mg/mL各25 mL的灵芝菌丝体水提液.按1.2.2对筛选得到的大孔树脂进行预处理,量取15 mL预处理好的大孔树脂11份分别于锥形瓶中,并分别加入各质量浓度的提取液,盖上塞子,在室温下吸附12 h,吸附充分后抽滤,将滤液分别稀释至1 mg/mL,测定未被吸附溶液的体外抗氧化活性.
抽滤后的大孔树脂用少量去离子水清洗后,分别用50 mL 95%乙醇转移至锥形瓶,盖上塞子后在室温下解吸16 h并进行抽滤,抽滤后的大孔树脂进行再生处理,将滤液中的乙醇旋蒸除去后用去离子水稀释至1 mg/mL,测定解吸后各样品溶液的抗氧化活性.
1.2.4 大孔树脂动态梯度洗脱实验
量取经过预处理筛选得到的大孔树脂50 mL,湿法装入2 cm×50 cm的树脂柱中(树脂柱中预先装入适量去离子水),装柱时不断敲击树脂柱,使大孔树脂均匀紧密沉降,将过量的水从下端放出.上样时,沿树脂柱内壁缓慢加入灵芝菌丝体水提液,为防止树脂顶层浮起,在树脂层上方放置一块适宜大小的滤纸.
1)上样体积的选择
将1.2.1制备的灵芝菌丝体浓缩液稀释至10 mg/mL,沿树脂柱内壁将溶液缓缓添加到树脂柱中,控制流速为2 BV/h,同时在树脂柱下方出口接收流出液,每10 mL收集一份,共30份.将收集得到的流出液适当合并成15份,每份流出液稀释5倍,测定其DPPH、ABTS和羟自由基清除率,判断大孔树脂的最大上样体积.
2)洗脱液体积分数的选择
向含有50 mL筛选得到的大孔树脂的树脂柱中缓慢加入10 mg/mL的灵芝菌丝体水提液100 mL,随后用100 mL去离子水洗涤大孔树脂,除去未被吸附的物质,随后依次用体积分数梯度为30%、50%、70%、95%的乙醇各200 mL对树脂柱进行洗脱,收集各部分洗脱液并将乙醇旋干,用去离子水溶解各部分的洗脱物,配置成2 mg/mL的待测液,测定各部分待测液的抗氧化活性.
1.2.5 大孔树脂吸附前后抗氧化活性对比
1)灵芝菌丝体水提液样品制备
精密称取灵芝菌丝体样品1.0 g,加入50 mL去离子水,浸润5 min后,在超声条件50 ℃、156 W下提取60 min,溶液放冷后进行抽滤,重复提取4份,将滤液合并后蒸去溶剂,得到灵芝菌丝体水提液浸膏,将浸膏于55 ℃条件下烘干,研磨成粉末,备用.
2)大孔树脂洗脱液样品制备
精密称取灵芝菌丝体样品1.0 g,加入50 mL去离子水,浸润5 min后,在超声条件50 ℃、156 W下提取60 min,溶液放冷后进行抽滤,重复提取4份,将滤液合并后,稀释至10 mg/mL,根据确定的大孔树脂最佳吸附和解吸方法,收集洗脱液,旋蒸除去溶剂,得到大孔树脂洗脱液浸膏,将浸膏于55 ℃条件下烘干,研磨成粉末,备用.
3)大孔树脂吸附前后抗氧化活性对比
将1.2.5中1)和2)制备的不同样品稀释成适宜体积分数梯度的待测液,分别测定DPPH、ABTS和羟自由基清除率,计算经大孔树脂吸附处理前后样品对不同自由基清除率的半数抑制质量浓度(EC50),对比抗氧化活性的变化.
1.2.6 抗氧化检测方法
1)DPPH自由基清除率
参考文献[14]的方法,本文改进实验步骤如下:称取DPPH粉末12.5 mg,用乙醇(95%)溶解,定容至100 mL,将所得0.031 7 mmol/L的DPPH自由基储备液避光保存.使用时稀释5倍,使其吸光度为0.7左右,得到DPPH自由基工作溶液.测量时,取样品溶液2 mL于5 mL棕色容量瓶,加入2 mL DPPH自由基工作溶液后摇匀,避光反应30 min后用紫外-可见光分光光度计于517 nm处测定吸光度,用95%乙醇调零.按式(1)计算DPPH自由基清除率(S1),重复3次,取平均值.
(1)
其中:Ai为样品溶液与DPPH溶液反应后的吸光度,Aj为用95%乙醇代替DPPH溶液测得样品溶液的本底吸光度,A0为以去离子水代替样品溶液的空白吸光度.
2)羟自由基清除率
采用水杨酸法测定提取液的羟自由基清除率,参考文献[15]并加以改进.在10 mL具塞试管中依次加入1 mL样品溶液、1 mL 9 mmol/L FeSO4和8.8 mmol/L H2O2溶液,室温下静置10 min,再向试管中移入1 mL 9 mmol/L水杨酸乙醇溶液,混合均匀后在37 ℃水浴条件下保温30 min,离心后检测上清液在510 nm处的吸光度,用去离子水调零.羟自由基清除率(S2)计算方法如式(2),重复实验3次,取平均值.
(2)
其中:A′i为样品溶液与水杨酸体系反应后的吸光度,A′j为用去离子水代替H2O2测得样品溶液的本底吸光度,A′0为以去离子水代替样品溶液的空白吸光度.
3)ABTS自由基清除率
参考IlSasov等[16]的方法并加以改进.移取5 mL 7 mmol/L ABTS溶液和100 μL 140 mmol/L过硫酸钾溶液于10 mL棕色容量瓶中,摇匀后避光反应12~16 h,用pH=7.4的磷酸盐缓冲液稀释90倍左右,使其吸光度为0.7附近,得到ABTS自由基溶液.取样品溶液1 mL于5 mL棕色容量瓶,加入4 mL ABTS自由基溶液后摇匀,避光反应6 min后测定溶液在734 nm的吸光度.按式(3)计算ABTS自由基清除率(S3),重复实验3次,取平均值.
(3)
其中:A″i为样品溶液与ABTS溶液反应后的吸光度,A″j为用磷酸盐缓冲液代替ABTS测得样品溶液的本底吸光度,A″0为以去离子水代替样品溶液的空白吸光度.
2 结果与讨论
2.1 大孔树脂静态吸附-解吸实验
2.1.1 大孔树脂的筛选
各型号大孔树脂在静态条件下对5 mg/mL 灵芝菌丝体水提液的吸附和解吸情况如表2所示,为直观对比各种树脂的性能,绘制柱状图(图1).
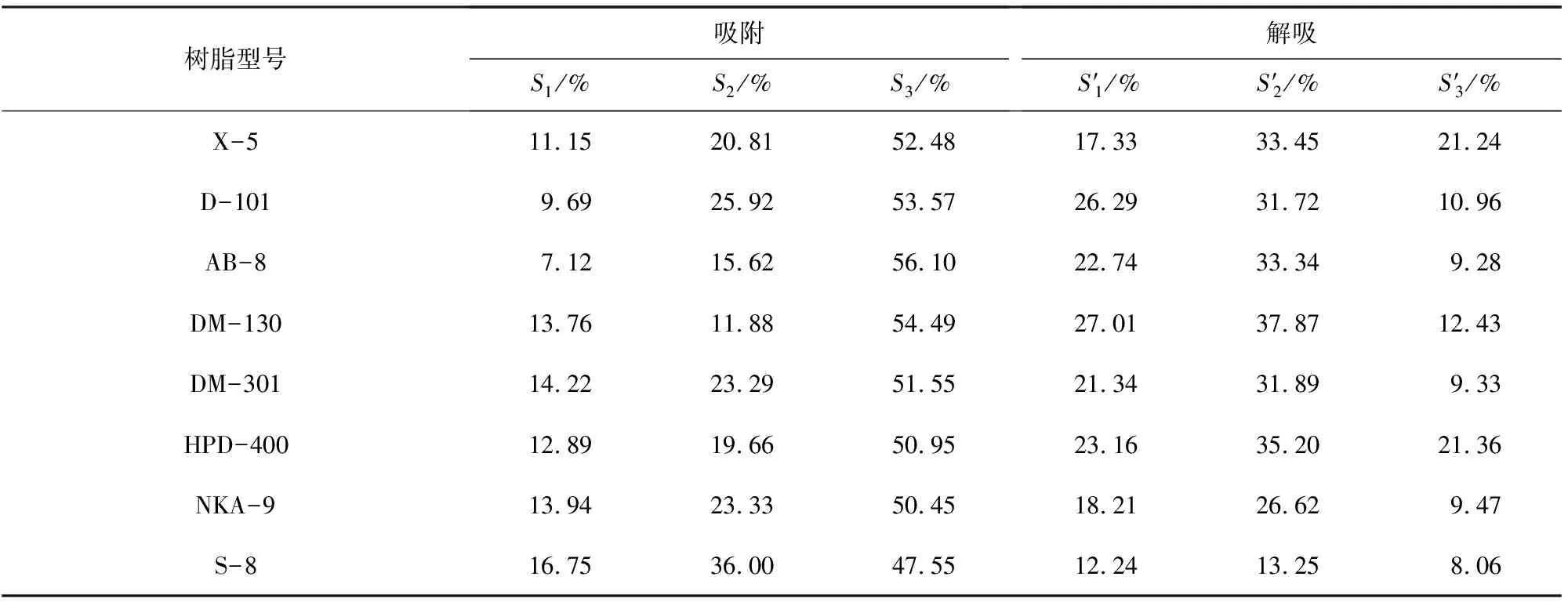
表2 不同型号大孔树脂对灵芝菌丝体水提液的吸附与解吸情况
如图1所示,从羟自由基清除效果来看,大孔树脂对灵芝菌丝体水提物抗氧化活性物质的吸附能力较弱;对于DPPH·和ABTS+·清除法来说,除S-8大孔树脂外,其余型号大孔树脂对灵芝菌丝体水提物的抗氧化活性成分均具有较好的吸附能力.为了全面评价各型号大孔树脂对灵芝菌丝体水提物抗氧化活性物质的吸附与解吸能力,对表2中解吸后的自由基清除率(S1、S2、S3)进行正向归一化处理(式(4)),对未被吸附(即上清液)的自由基清除率(S′1、S′2、S′3)进行反向归一化处理(式(5)),随后按熵权法[17]求取各指标权重.
(4)
(5)
利用熵权法对评价指标S1、S2、S3、S′1、S′2、S′3各自所占的权重进行计算.以表2中的8组数据为样本,首先对Sij进行离差标准化得到yij后,按式(6)计算信息熵Ej,按式(7)计算权重wj.
(6)
(7)
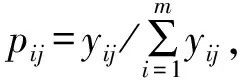
定义加权后的综合抗氧化活性为Z,其计算方法如下:
(8)
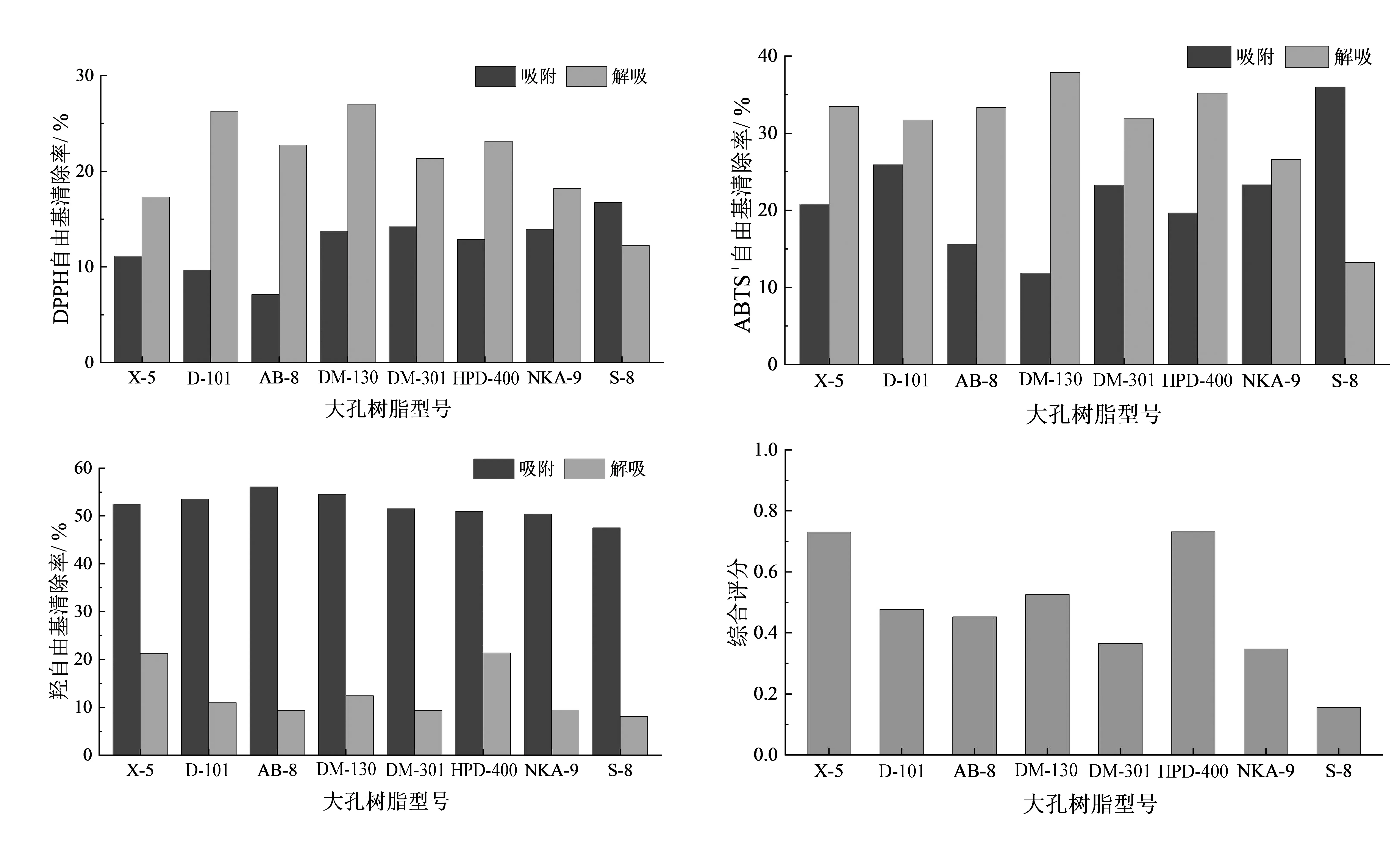
图1 各型号大孔树脂对灵芝菌丝体水提液的吸附与解吸情况
各型号大孔树脂的综合吸附-解吸能力如表3所示.结果表明,HPD-400和X-5大孔树脂的综合评分相近并明显高于其它大孔树脂,且HPD-400在DPPH法和ABTS法中明显优于X-5大孔树脂,因此选择中等极性HPD-400大孔树脂进行后续灵芝菌丝体水提液抗氧化活性物质的分离.

表3 各型号大孔树脂的吸附-解吸能力综合评分
2.1.2 上样质量浓度的确定
不同上样质量浓度下HPD-400大孔树脂的吸附与解吸情况分别如图2~3所示.

图2 不同质量浓度上样液吸附后溶液的体外抗氧化活性

图3 不同质量浓度上样液洗脱后的体外抗氧化活性
从图2可以看出,随着上样质量浓度的增加,吸附后溶液的自由基清除率逐渐升高,由此推测未经大孔树脂吸附的抗氧化活性成分逐渐增多.而图3则说明了大孔树脂对于水提液抗氧化活性成分的解吸情况,即当上样质量浓度小于10 mg/mL时,解吸液的体外抗氧化活性持续上升;上样质量浓度在10~20 mg/mL内,解吸液的体外抗氧化活性趋于平缓,说明在该上样质量浓度范围内,大孔树脂的吸附性能达到饱和;上样质量浓度大于20 mg/mL以后,解吸液的活性显著下降,这是因为高质量浓度的上样液黏度较大,且包含很多杂质,使得大孔树脂的吸附能力受到影响,导致泄漏点提前出现.
综上所述,考虑到吸附效率以及后续稀释的难易,选择10 mg/mL为最佳上样质量浓度.
2.2 大孔树脂动态梯度洗脱实验
2.2.1 上样体积的选择
不同上样体积流出液抗氧化活性折线图如图4所示,对于DPPH·和ABTS+·清除法来说,上样体积低于100 mL时,从树脂柱下口流出溶液的自由基清除率随体积逐渐增加,100 mL以后自由基清除率几乎平稳并接近原始提取液的活性.而对于羟自由基清除法来说,上样体积为40 mL时吸附便已趋于饱和,这可能是因为大孔树脂本身对于能够清除羟自由基的化合物的吸附性较差,因此较少的上样体积即可使大孔树脂对于具有羟自由基清除效果的化合物的吸附达到饱和.综合考虑,确定最大上样体积为100 mL,即2 BV的10 mg/mL的灵芝菌丝体水提液.

图4 不同上样体积流出液的抗氧化活性
2.2.2 洗脱液体积分数的选择
考察不同体积分数乙醇洗脱液的体外抗氧化活性,绘制直方图如图5所示,从图中可以直观看出:灵芝菌丝体水提物被HPD-400大孔树脂吸附的绝大部分抗氧化活性成分都能被30%的乙醇洗脱下来,其在ABTS+·清除法中体现得最为明显,随着乙醇体积分数的增大,洗脱物的抗氧化活性逐渐下降.对于羟自由基清除法来说,由于本身被吸附的具有羟自由基清除功能的物质就比较少,因此30%乙醇洗脱物的羟自由基清除率虽大于其他组分,但总体差别没有DPPH法和ABTS法显著.综上,选择30%乙醇洗脱部位进行后续的进一步分离.

图5 不同乙醇体积分数梯度洗脱的洗脱液抗氧化活性
2.3 大孔树脂吸附前后抗氧化活性对比
表4为灵芝菌丝体水提液经大孔树脂吸附处理前后,在不同体积分数下对不同自由基清除效果的拟合曲线及EC50值.

表4 大孔树脂吸附前后的自由基清除效果比较
将待测物在不同评价方法下的EC50制成直方图进行对比,见图6.如图6所示,经大孔树脂处理后的水提液清除DPPH·和ABTS+·的能力有了明显提高,对DPPH·的清除能力提高了1倍,ABTS+·清除能力为原始水提液的4倍.但对于羟自由基清除法来说,经大孔树脂处理后的30%乙醇洗脱液的EC50升高到了原来的2.13倍,进一步说明了羟自由基法和DPPH及ABTS法所针对化合物的抗氧化机理有所不同,且中等极性大孔树脂分离得到的物质羟自由基清除能力较差,但有着很高的清除DPPH·和ABTS+·的能力.与Wang等[18]有关桑树槲皮素提取物的研究一致:经AB-8大孔树脂纯化后的桑树槲皮素提取物DPPH自由基清除率高于提取液,但羟自由基的清除率有所下降.
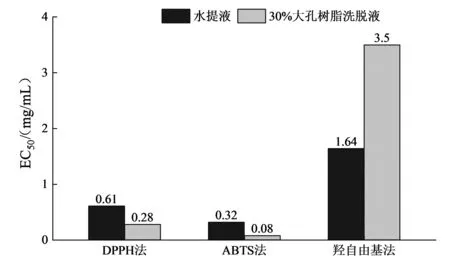
图6 不同评价方法的EC50对比
3 结论
以DPPH、ABTS和羟自由基清除率为评价指标,利用大孔树脂吸附灵芝菌丝体水提液中抗氧化活性成分,研究发现大孔树脂对可清除DPPH·和ABTS+·的物质吸附效果较好,吸附可清除羟自由基的物质效果较差,中极性的HPD-400大孔树脂对具有目标活性的化合物吸附效果最佳.用不同梯度体积分数的乙醇对吸附完全的HPD-400大孔树脂柱进行洗脱,发现30%乙醇洗脱部位的抗氧化活性明显高于其他部位,对比30%乙醇洗脱物与灵芝菌丝体水提物的抗氧化活性,发现经大孔树脂分离得到的物质能够有效提高对DPPH·和ABTS+·的清除效果,其中DPPH·清除效果提高1倍,ABTS+·清除效果提高3倍,但清除羟自由基的能力有所降低.

