布拉氏酵母壁多糖发酵条件的优化及其对早期断奶羔羊盲肠中微生物的影响
■刘孟健 刘武军 臧长江 姚 峻 董 玲 张文举*
(1.石河子大学动物科技学院,新疆 石河子 832000;2.新疆农业大学动物科学学院,新疆 乌鲁木齐 830000;3.辽宁省农牧业机械研究所有限公司,辽宁 沈阳 110036)
布拉氏酵母壁多糖(Saccharomyces boulardii Poly⁃saccharides)是一种天然的益生元,主要由β-葡聚糖和甘露聚糖组成[1]。布拉氏酵母壁多糖作为布拉氏酵母的主要生物活性部分,不仅具有无毒副作用、安全可靠等优点,还具有调节肠道菌群平衡、防治腹泻等生物学功能,有报道其可用于婴幼儿腹泻的治疗[2-3]。我国北方牧区在换季时期温差较大,加之羔羊提前断奶饲养方式的普及,因此加剧了断奶羔羊的应激反应和肠道菌群紊乱,普遍出现了断奶羔羊腹泻、脱水、免疫力低下等情况,对当地的羊业发展产生了较为严重的影响。在我国禁抗的大趋势下,急需找到全部或部分具有抗生素效用的天然绿色添加剂,以此改善早期断奶羔羊较为剧烈的应激反应和肠道菌群紊乱等问题。因此,若通过优化布拉氏酵母的发酵条件以提高其细胞壁多糖产量,并评估其理化特性和生物活性,制备成绿色、安全、有效的益生元,定会在我国无抗养殖的大环境下,特别是在北方养羊业有广阔的应用前景。
目前,大部分研究主要集中于布拉氏酵母菌的生物学功能、作用机制及其相关应用,鲜有对布拉氏酵母壁多糖发酵的工艺优化、理化特性及体内、外生物学功能方面进行报道。因此,本研究首先通过单因素试验研究培养基、pH、转速和温度对多糖产量的影响,再通过响应面法得到最适发酵条件,并用高效凝胶色谱技术检测其多糖分子量以及单糖组成;然后通过布拉氏酵母壁多糖对氧自由基的清除效率和抑菌试验评价其抗氧化活性和抑菌特性;最后通过饲喂试验研究其对早期断奶羔羊盲肠中微生物的影响,为布拉氏酵母壁多糖的生产和应用提供理论依据。
1 材料与方法
1.1 材料与试剂
供试菌株:布拉氏酵母菌株,由石河子大学动物科技学院提供,菌种编号为BLS-06。
药品试剂:葡萄糖标样(纯度≥99.00%),美国Sig⁃ma公司;D(+)-甘露糖标样(纯度≥99.99%),德国Dr.Ehrenstorfer公司;酵母提取物、大豆蛋白胨、酵母膏、葡萄糖、蔗糖、甘油、中性蛋白酶、胰蛋白酶、异丙醇、无水乙醇等均为国产有机试剂;抗坏血酸(VC),德国Sig⁃ma-Aldrich公司;1,1-二苯基-2-三硝基苯肼(DPPH),美国Sigma公司;盐酸、硝酸钠、磷酸二氢钾、氯化钾、硫酸镁、硫酸亚铁、硫酸铵、氯化钙、D-泛酸钙、氯化钠、乙酸钠、氢氧化钠、过氧化氢等均为国产分析纯。
1.2 仪器与设备
MLS-3781L-PC高压蒸汽灭菌锅,松下健康医疗器械株式会社;PL602E 电子天平,梅特勒-托利多仪器(上海)有限公司;SJIA-5FE抽真空冷冻干燥机,宁波市双嘉仪器有限公司;UV-2102 PCS紫外可见光分光光度计,上海尤尼柯仪器有限公司;BF260强制对流培养箱,德国宾得集团;GTR16-2高速冷冻离心机,北京时代北利仪器有限公司;DZKW-S-4电热恒温水浴锅,北京市永光明仪器有限公司;快流速琼脂糖凝胶,美国艾尔特公司;BIOTECH-10BG-7000A全自动发酵罐,上海保兴生物设备工程有限公司;ZWYR-D2402恒温培养振荡器,上海智城分析仪器制造有限公司;SB-804 HQ 凝胶过滤色谱,日本昭和电工株式会社;Agilent 1100高效液相色谱仪,美国安捷伦科技公司。
1.3 试验方法
1.3.1 培养基对多糖产量的影响
以全自动发酵罐为试验设备(下同),在无菌条件下将活化好的布拉氏酵母分别接入到8 L下列供试发酵培养基中,其基础发酵条件为接种量5%、pH 为7、温度32 ℃、转速300 r/min、发酵时间72 h,每个处理3 个重复[4],培养结束后按1.3.7 中方法提取多糖并对其进行称量。
发酵培养基:①酵母浸粉葡萄糖培养基:酵母提取物10 g、蛋白胨20 g、葡萄糖20 g、纯化水1 L;②改良察氏培养基:蔗糖30 g、硝酸钠3 g、磷酸氢二钾1 g、氯化钾0.5 g、硫酸镁0.5 g、硫酸亚铁0.01 g、纯化水1 L;③自配1 培养基:蔗糖50 g、大豆蛋白胨40 g、酵母膏30 g、甘油16 g、纯化水1 L;④自配2培养基:蔗糖50 g、葡萄糖20 g、酵母膏50 g、硫酸铵10 g、硫酸二氢钾3 g、甘油2 g、氯化钙1 g、纯化水1 L;⑤自配3 培养基:蔗糖60 g、酵母膏40 g、硫酸铵10 g、硫酸二氢钾3 g、甘油10 g、纯化水1 L;⑥自配4 培养基:蔗糖50 g、葡萄糖20 g、蛋白胨60 g、硫酸铵30 g、甘油3 g、氯化钙3 g、硫酸镁1 g、D-泛酸钙0.6 g、纯化水1 L。以上培养基均为自然pH,并以121 ℃灭菌30 min[5-10]。
1.3.2 pH对多糖产量的影响
以氢氧化钠和盐酸对优化后的培养基pH进行调节,使其pH 分别达到3.0、4.0、5.0、6.0、7.0、8.0 进行初筛。再以0.4为梯度对培养基pH进行复筛,每个处理3个重复,确定此培养基产多糖的最适发酵pH区间。
1.3.3 温度对多糖产量的影响
发酵温度分别设定为24、26、28、30、32 ℃和34 ℃,在无菌环境下接种后以基础培养条件进行发酵,结束后提取酵母壁多糖并精确称量,每个处理3个重复,确定此培养基产多糖的最适发酵温度区间。
1.3.4 转速对多糖产量的影响
分别将转速设定为200、300、400、500、600 r/min和700 r/min,在无菌环境下接种后以基础发酵条件进行发酵,结束后提取酵母壁多糖并称量,每个处理3个重复,确定此培养基产多糖的最适转速区间。
1.3.5 响应面优化试验
在单因素试验结果的基础上,以多糖产量为考察指标,选择发酵pH、温度和转速作为需要组合优化的3个因素,每个因素设定3个水平,通过响应面法对其进行优化,见表1。

表1 布拉氏酵母壁多糖最佳发酵条件的响应面试验设计
1.3.6 发酵验证试验
在理论最佳发酵条件的基础上进行验证试验,测定布拉氏酵母壁多糖的实际最佳产量,3次重复,并计算实际多糖产量与预计产量之间的相对误差。
1.3.7 多糖的提取和纯化
将酵母发酵液放入离心机中以5 000 r/min 离心5 min,去上清液。沉淀物用3~5倍体积的纯化水溶解,搅拌10 min,除去杂质后,用组织捣碎机机械破壁8 min,再加入中性蛋白酶300 IU/g,恒温40 ℃下酶解36 h,离心去除上清液。沉淀物用2%氢氧化钠处理3 h,再用5%盐酸中和至pH为7.0,2倍乙醇醇析,真空干燥48 h后,粉碎制得粗多糖,精确称量,测3次取其平均值[11]。
在粗多糖中加入2 倍体积丙酮,搅拌20 min,离心去除上清液,反复上述步骤3次进行脱脂。然后加入5倍于壁多糖溶液体积的Sevag液(氯仿∶正丁醇=4∶1,V/V),并调节使其pH为3,充分振荡30 min后,置于4 ℃冰箱冷藏24 h除去蛋白质,5 000 r/min离心10 min,倾出上清液,吸出上层水相,除去中间层变形蛋白和下层氯仿,反复上述步骤至少3 次。将5 倍95%乙醇缓慢加入到壁多糖溶液中,边加边搅拌,多糖以白色絮状沉淀物析出,静置过夜后去除上清液,用无水乙醇洗涤脱水3次并烘干粉碎。取烘干多糖溶于蒸馏水后于3 500 u透析袋中透析48 h,0.22 μm滤膜除杂质,抽真空冷冻干燥并制得纯多糖[12]。
1.3.8 多糖的分离
将纯化好的酵母壁多糖配成2 mL 50 mg/mL 的水溶液,5 000 r/min离心5 min后用DEAE 52-Sepha⁃rose Fast Flow 阴离子柱层析分段洗脱。平衡液为0.05 mol/L、pH为9.18的硼酸盐、流动相分别为0.1、0.5、0.9、1.3、1.7 mol/L NaCl梯度溶液,流速1.0 mL/min,每6 mL收集1管,通过苯酚-硫酸法检测各管OD490nm值,绘制洗脱曲线,分别收集各梯度中主要含糖组分,浓缩后透析脱盐冷冻干燥保藏[13]。
1.3.9 多糖分子量的测定
通过高效凝胶渗透色谱(HPGPC)法检测酵母壁多糖的分子量,选用TSK-GEL 凝胶过滤色谱柱(G3000PWXL,7.8 mm×30.0 cm),以404、212、112、47.3、22.8、11.8、5.9、2.5 ku的右旋糖酐制作多糖分子量双对数(log-log)保留时间标准曲线。准确称取样品并与流动相制成5 mg/mL溶液,离心吸取上清液20 μL进样,对照标准曲线,根据回归方程计算样品的分子量。分析柱条件为SB-804 HQ色谱柱;流动相为0.1 mol/L的Na2SO4;流速为0.5 mL/min;柱温为35 ℃;进样量为20 μL;最大柱压为2 500 kPa[14-15]。
1.3.10 多糖组成的测定
参考徐婷婷等[16]和袁志梅等[17]的方法对布拉氏酵母壁多糖进行处理,通过高效液相色谱(HPLC)测定多糖中葡聚糖和甘露聚糖的含量。准确称取干燥葡萄糖和甘露糖标准品并与纯化水配制成2 g/L的标准储备液,并稀释制成质量浓度分别为200、400、600、800、1 000 μg/mL 的葡萄糖和甘露糖标准溶液,进样测定标准物质质量浓度与色谱峰面积之间的回归方程,并绘制标准曲线。准确称取干燥待测样品并与纯化水配制成2 g/mL 溶液,吸取50 μL 进样,得到待测样品的液相色谱图,并通过补偿系数公式以及标准曲线回归方程,得出多糖中葡聚糖和甘露糖的含量。色谱柱条件为Welch Sugar-Ca 色谱柱(7.8 mm×300 mm),流动相一级水,流速0.5 mL/min,柱温为85 ℃,进样量50 μL。
1.3.11 多糖抗氧化活性的测定
准确称量1 g经过冷冻干燥后的布拉氏酵母壁多糖,用纯化水定容至100 mL,配成10 mg/mL的多糖溶液,避光保存。
1.3.11.1 DPPH·清除能力的测定
对上述多糖溶液进行稀释,配制成100、200、400、600、800、1 000、2 000 μg/mL 的梯度浓度溶液,分别精确吸取2 mL梯度溶液并与等量5 mmol/L的DPPH·乙醇溶液混合并振荡均匀,室温静置30 min,在λ为517 nm下测定其吸光度A0,并测定2 mL无水乙醇、2 mL纯化水混合液吸光值A1,并测定2 mL 纯化水、2 mL 5 mmol/L DPPH·乙醇溶液混合液吸光值A2,每个处理3 个重复,取其平均值,通过清除率公式计算其对DPPH·的清除率[18-19]。
1.3.11.2 羟自由基(·OH)清除能力的测定
精确称取9.0 mmol/L 硫酸亚铁1 mL 于试管中,依次加入1 mL 9.0 mmol/L的水杨酸-乙醇溶液、1 mL不同浓度的布拉氏酵母壁多糖溶液(如上述所示)、5 mL纯化水、振荡均匀后加入1 mL 0.06%过氧化氢,室温反应1 h,在λ为510 nm下测定其吸光度A0,将上述各处理试管中的过氧化氢换成纯化水测其吸光度A1,将上述处理各试管中的多糖溶液换成等量纯化水测其吸光度A2,每个处理3个重复,取其平均值,通过清除率公式计算其对·OH的清除率[20-21]。
1.3.11.3 超氧自由基(·O2-)清除能力的测定
准确称量1 mL不同浓度的布拉氏酵母壁多糖溶液(如上述所示),并加入3 mL Tris-盐酸缓冲液(pH 8.2),25 ℃下保温20 min,加入25 ℃7 mmol/L的邻苯三酚0.3 mL,精准反应4 min 后加入1 mL 19 mmol/L HCl 终止反应,在λ为420 nm 下测定其吸光度A0,将上述各处理试管中的多糖溶液换成纯化水测其吸光度A1,将上述处理各试管中的邻苯三酚溶液换成等量纯化水测其吸光度A2,每个处理3个重复,取其平均值,通过清除率公式计算其对·O2-的清除率[22]。

1.3.12 多糖抑菌活性的测定
在无菌条件下,将浓度为109CFU/mL 大肠杆菌K88、金黄色葡萄球菌、沙门氏菌分别均匀涂布在琼脂培养基上,在培养皿周围以相同间隔放置5个牛津杯(9 mm),分别加入浓度为30、60、120、240、480 μg/mL的布拉氏酵母壁多糖混合液,分别以无菌水和200 μg/mL头孢类抗生素做其阴性对照和阳性对照,37 ℃培养48 h,测量抑菌圈直径,每个培养皿做3 个平行试验。无抑菌圈即无抑菌能力,记为“-”;抑菌圈直径为9~12 mm 即低抑菌能力,记为“+”;抑菌圈直径为12~15 mm 即高抑菌能力,记为“++”;抑菌圈直径为15~18 mm即极高抑菌能力,记为“+++”[23]。
1.3.13 多糖对早期断奶羔羊盲肠微生物的影响
选取遗传背景相近、胎次体重相近和健康状况良好的32-35日龄羔羊(萨福克羊♂×阿勒泰羊♀×哈萨克羊♂)48 只,其中公羔36 只,母羔12 只。试验采用单因素设计方法,按同质原则将试验羔羊分为4 组,每组3 个重复,每个重复4 只羔羊(3 只♂和1 只♀),所有试验羔羊均于32 日龄强制断奶。4 个试验组分别饲喂羔羊代乳料(Ⅰ组)、代乳料+0.1%布拉氏酵母壁多糖(Ⅱ组)、代乳料+0.3%布拉氏酵母壁多糖(Ⅲ组)和代乳料+0.5%布拉氏酵母壁多糖(Ⅳ组)。代乳料参照NRC(2007)体重20 kg、日增重300 g绵羊的营养需要量标准进行配制。饲喂期为30 d,期间羔羊自由采食代乳料,每日饲喂4次,自由饮水。
于试验结束当天早晨10:00未采食前,随机从每个重复中选取1只羔羊(确保每个处理均能随机选取2 只♂和1 只♀),肌肉注射4%戊巴比妥钠溶液对其麻醉,待其完全昏迷后,通过颈部放血将其处死。用手术刀沿腹线划开腹腔,用棉绳将带有内容物的盲肠肠段分别于中间和两端结扎,在无菌环境下(酒精灯火焰上方的无菌环境),快速将盲肠段中的内容物取出并放入充满ATCC冷冻保护剂(10%甘油+5%二甲亚砜+培养液)的样品袋中,缓慢降温后置于液氮中冷冻。盲肠中乳酸菌、双歧杆菌、大肠杆菌、沙门氏菌、产气荚膜梭菌和总好氧菌均用培养皿计数法测定。
1.4 数据处理
采用Excel 2017 软件对数据进行统计,采用SPSS 18.0 对数据进行单因素方差分析,对发酵条件优化的组间显著性差异对比采用Design Expert 软件进行响应面曲线设计与分析。
2 结果与分析
2.1 发酵培养基对多糖产量的影响(见表2)

表2 5种培养基对布拉氏酵母壁多糖产量的影响(mg/100 mL)
由表2 所示,布拉氏酵母在自配2、自配4 发酵培养基的多糖产量显著高于其他组(P<0.05),分别达到341.00 mg/100 mL和347.92 mg/100 mL,说明自配2、自配4 培养基更有利于布拉氏酵母壁多糖的生成。由于自配2 培养基的配方成本低,故采用自配2 培养基为后续发酵进行优化。
2.2 pH对多糖产量的影响(见表3)
如表3所示,在pH初筛阶段,随着pH的升高,布拉氏酵母壁多糖的产量增加,当pH 为6.0 时达到高峰,其多糖产量为402.92 mg/100 mL,显著高于其他组(P<0.05),而后产量下降。由此推断,pH 在5~7 的区间为布拉氏酵母产细胞壁多糖的适宜pH,故在此范围内进行复筛。由pH 复筛结果可知,当pH=5.8时,酵母壁多糖的产量最高为437.86 mg/100 mL,显著高于其他组(P<0.05),故选取pH 水平为5.4、5.8、6.2进行后续响应面优化试验。

表3 pH对布拉氏酵母壁多糖产量的影响(mg/100 mL)
2.3 发酵转速对多糖产量的影响(见表4)
如表4 所示,当转速为300~500 r/min 时,其多糖的产量较高,当转速为400 r/min 时,多糖产量最高为403.43 mg/100 mL,显著高于其他试验组(P<0.05)。故选择转速水平为300、400、500 r/min 进行响应面优化试验。

表4 不同转速对布拉式酵母壁多糖产量的影响(mg/100 mL)
2.4 发酵温度对多糖产量的影响(见表5)
如表5 所示,随着温度的升高,布拉氏酵母壁多糖的产量先升后降,28 ℃时的多糖产量最高,达到383.85 mg/100 mL,显著高于其他组(P<0.05);其次26 ℃和30 ℃的多糖产量分别达到363.56 mg/100 mL和370.68 mg/100 mL,其组间差异不显著(P>0.05),故选择温度水平为26 ℃、28 ℃和30 ℃进行响应面优化试验。

表5 不同温度对布拉式酵母壁多糖产量的影响(mg/100 mL)
2.5 响应面试验结果
2.5.1 数学模型的建立及显著性检验(见表6)
以pH(A)、温度(B)、转速(C)为考察因素,每个因素3 水平,以发酵液中多糖含量为响应值,运用响应面设计试验探讨布拉氏酵母壁多糖的最佳发酵条件。如表6所示,在发酵条件pH为5.8、温度28 ℃、转速400 r/min时多糖产量最高,均能达到520 mg/100 mL以上,显著高于其他组合(P<0.05)。
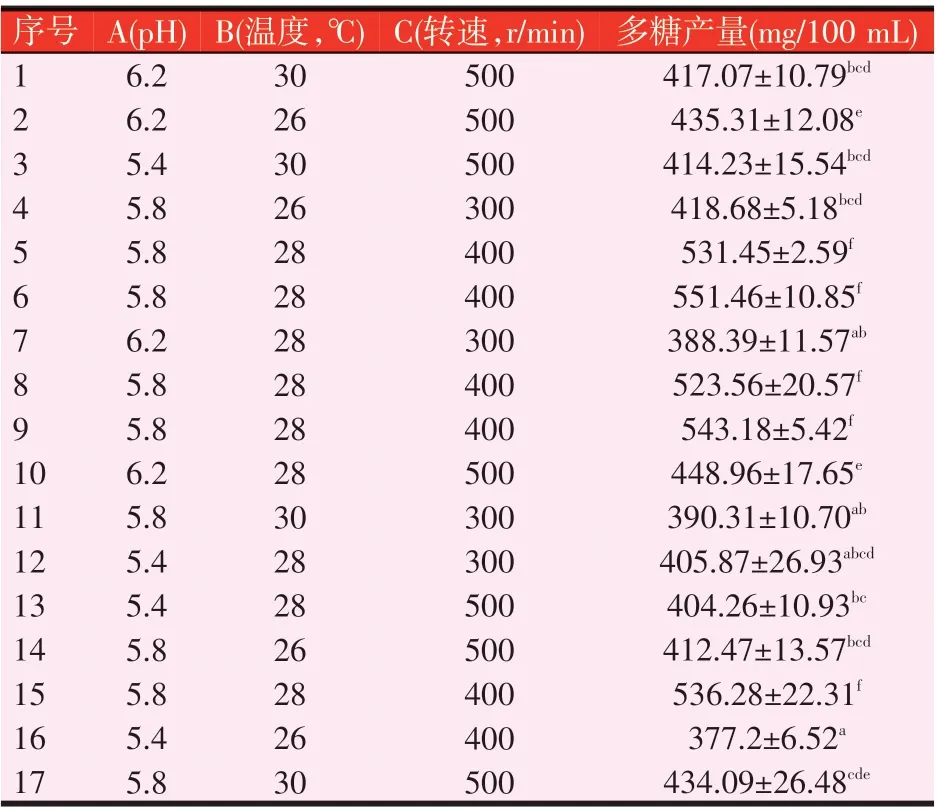
表6 发酵条件影响布拉氏酵母壁多糖产量的响应面试验结果
2.5.2 ANOVA分析(见表7)
发酵条件对布拉氏酵母壁多糖产量影响的模型方差分析如表7 所示,3 个因素的F值从大到小分别为C>A>B,因此确定在此发酵因素水平下对多糖产量影响程度的大小顺序分为转速>pH>温度。以多糖产量为响应值,利用Design Expert软件进行二元回归拟合,得到壁多糖产量对编码自变量pH(A)、温度(B)、转速(C)的二次多项回归方程为:多糖产量(Y)=537.19+11.02×A+1.50×B+12.07×C-13.82×AB+15.54×AC+12.50×BC-64.12×A2-62.11×B2-61.19×C2。在方差分析中,P<0.000 1,即模型达到极显著水平;多糖含量失拟项P=0.548 6,P>0.05,即模型失拟项不显著,证明模型选择合适,本试验的模型有意义。回归系数R2=0.987 7>0.9,说明模型相关性良好,可以用于响应值的变化分析。
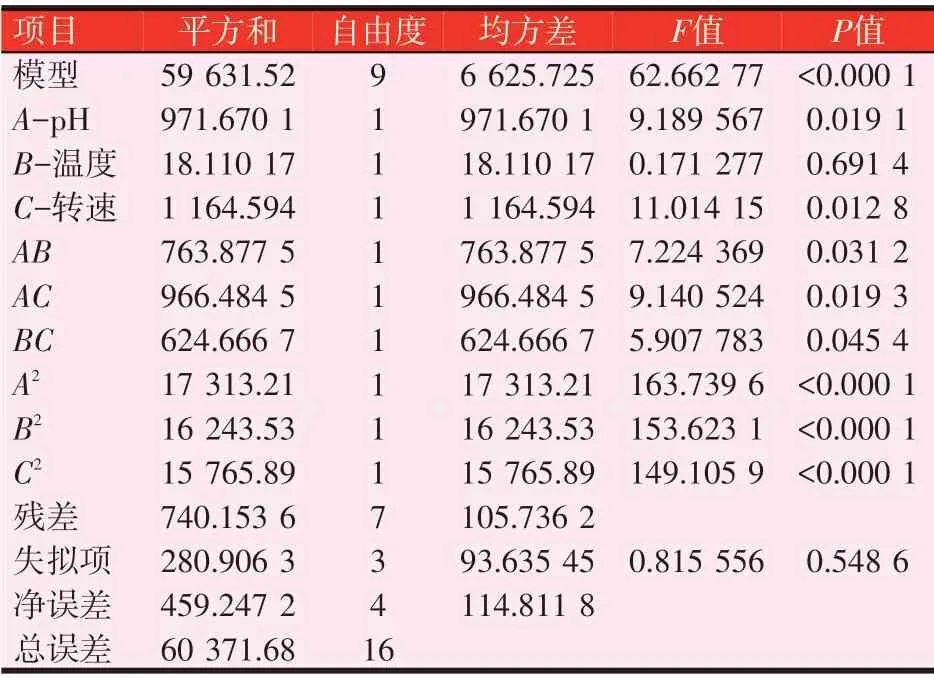
表7 发酵条件影响布拉氏酵母壁多糖产量的响应面方差分析结果
2.5.3 响应面分析(见图1~图3)
为了进一步研究相关变量间的交互作用并确定最优发酵条件,采用Design Expert软件绘制响应面曲线图,并对其数据进行二次多元回归拟合,所得到的二次回归方程的响应面如图1~图3 所示。当固定pH、发酵转速和发酵温度任意一个因素为固定水平时,显示其余两个因素的交互作用以及对应的多糖产量。其产量初期随着任意两个变量的增加而增加,当到达某一固定值后(此时多糖产量为最高点),多糖产量随着变量的增加而降低,呈不对称抛物线形状。由图1~图3及回归方程方差分析可知,pH与温度、pH与转速、温度与转速均有显著的交互作用。
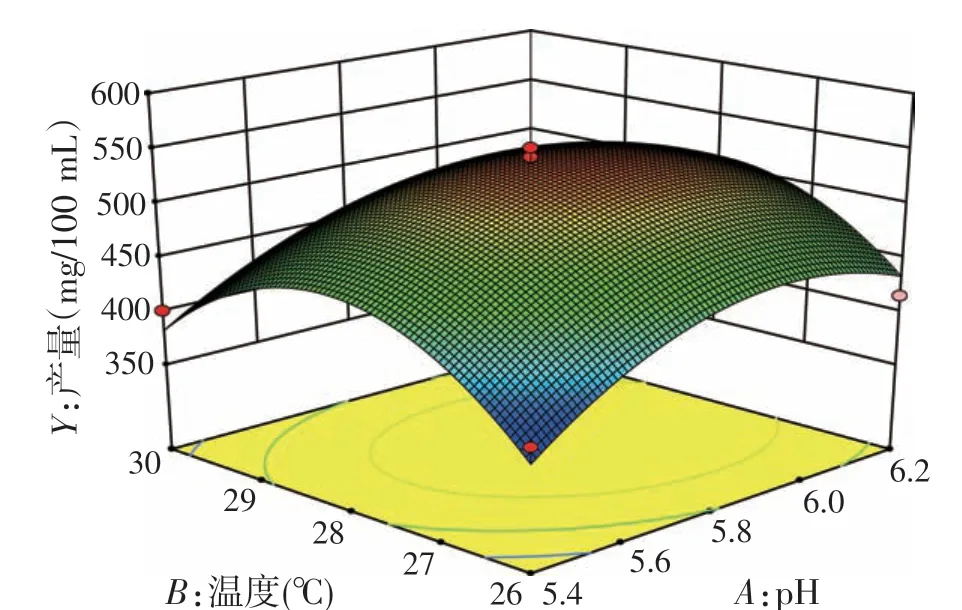
图1 温度和pH交互作用对多糖产量的影响

图2 转速和pH交互作用对多糖产量的影响

图3 转速和温度交互作用对多糖产量的影响
2.5.4 验证试验
通过对回归模型方程求解,得出布拉氏酵母产细胞壁多糖最佳发酵条件为pH 5.93、温度29.71 ℃、转速426.81 r/min,此条件下的多糖预计产量为590.48 mg/100 mL。为方便试验,验证试验的发酵条件调整如下:pH 6.0、温度30 ℃、转速420 r/min,进行3 组平行试验,最终在此条件下的多糖产量分别为:565.10、571.60 mg/100 mL 和584.40 mg/100 mL,其平均产量为573.70 mg/100 mL,与预计产量的相对误差为2.84%,证明该方程可用于指导生产实践。如图4所示,优化前后布拉氏酵母壁多糖产量分别为357.92 mg/100 mL 和573.70 mg/100 mL,优化后多糖产量是优化前1.6倍。
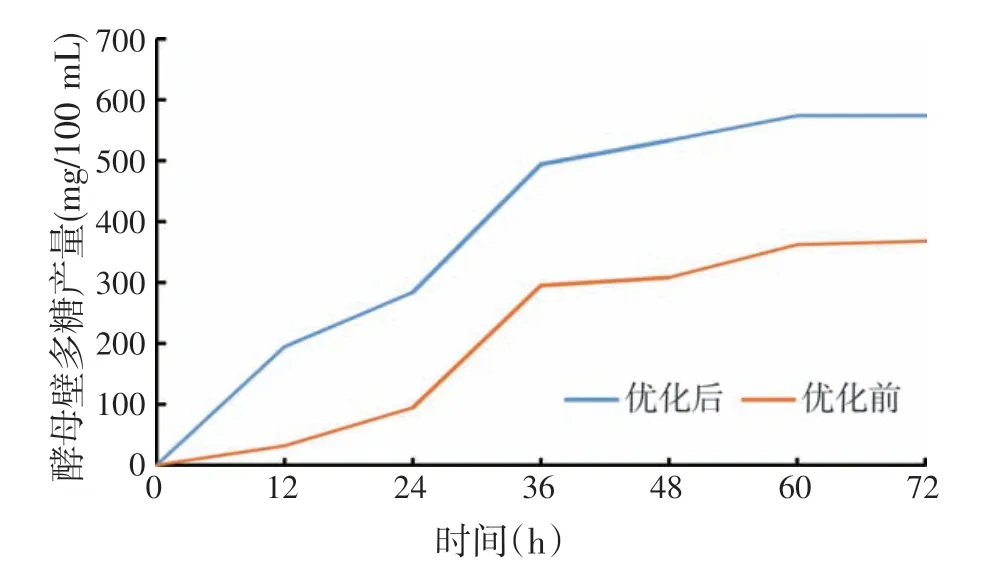
图4 优化前后酵母壁多糖产量变化
2.6 布拉氏酵母壁多糖的分子量测定(见图5~图7)
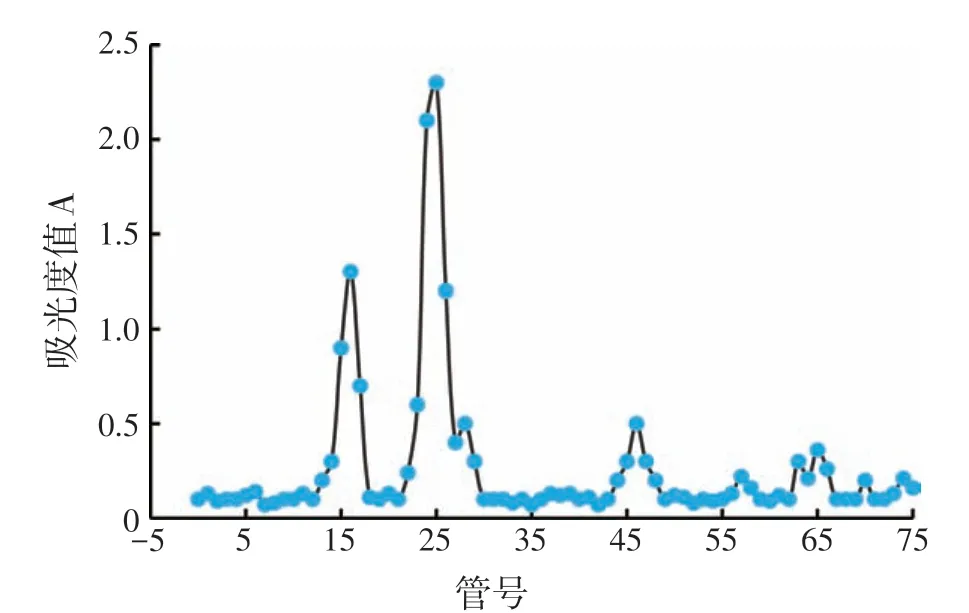
图5 纯化壁多糖的梯度洗脱图
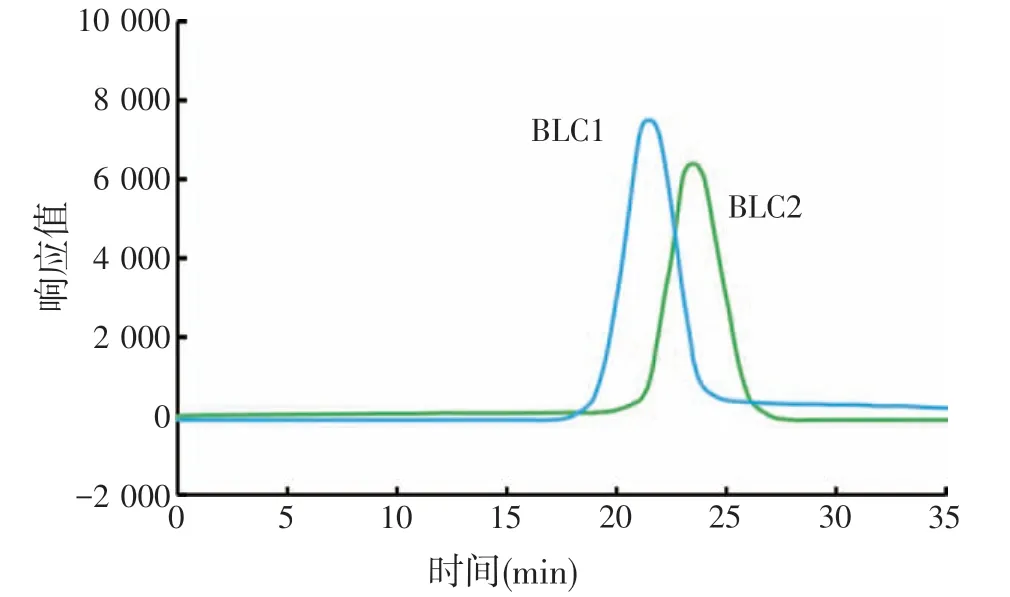
图6 BLC1和BLC2的凝胶渗透色谱
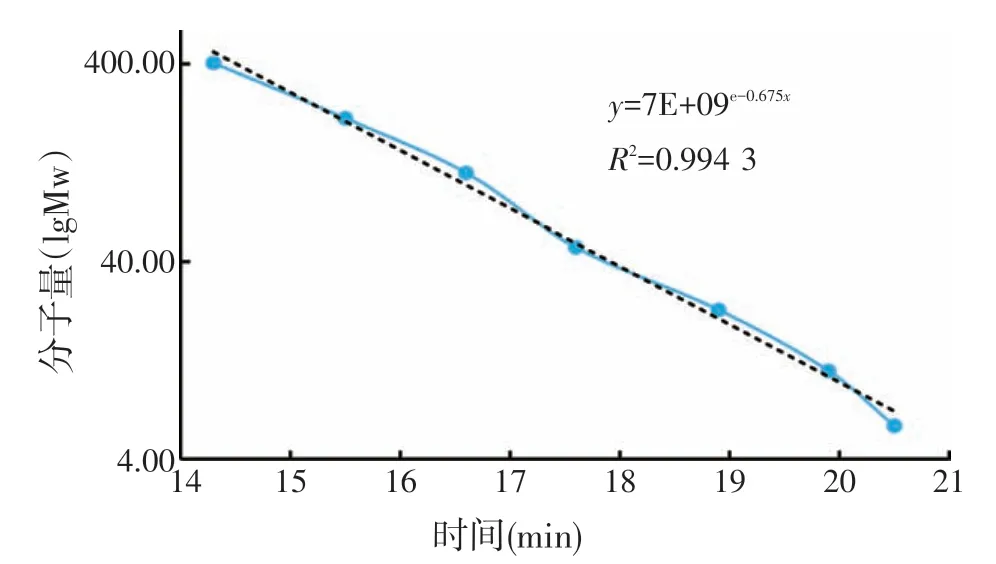
图7 标准分子量多糖的标准曲线
如图5所示,纯化后的多糖经过DEAE-52阴离子交换层析柱分段洗脱后,分离出了2 个主要组分,并命名为BLC1和BLC2。收集各管中多糖组分,透析除盐后浓缩冻干,计算各组分的比重。BLC1和BLC2组分为白色粉末状,分别占比多糖总量的63.12%和28.70%。将BLC1 和BLC2 组分别通过高效凝胶渗透色谱(HPGPC)进行检测,并用分子量标准品制作标准曲线,根据已知分子量的出峰时间推算BLC1和BLC2多糖的分子量。如图6 所示,BLC1 和BLC2 均呈现单一对称峰,证明其多糖组分纯度较高,可进行下一步分析。BLC1 和BLC2 的出峰时间分别代入右旋糖苷标准品绘制的标准曲线(图7)的公式中,计算得出BLC1和BLC2的分子质量分别为22.76 ku和9.09 ku。
2.7 布拉氏酵母壁多糖的单糖组成测定(见图8~图11)
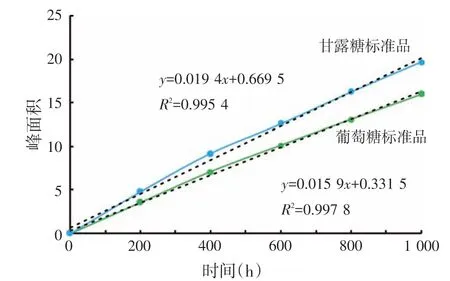
图8 标准样品浓度与其峰面积的标准曲线
图8 所示的是葡萄糖和甘露糖的浓度与其液相色谱峰面积的标准曲线,图9和图10所示葡萄糖与甘露糖标准品在液相色谱中的出峰时间,分别为13.584 min和15.710 min。图11表示布拉氏酵母壁多糖组分BLC1 的液相色谱图,通过校正公式和回归方程计算得出葡聚糖和甘露糖浓度分别为864 μg/mL和591 μg/mL,分别占BLC1 多糖组分的43.20%和29.55%。

图9 葡萄糖标准品的液相色谱图
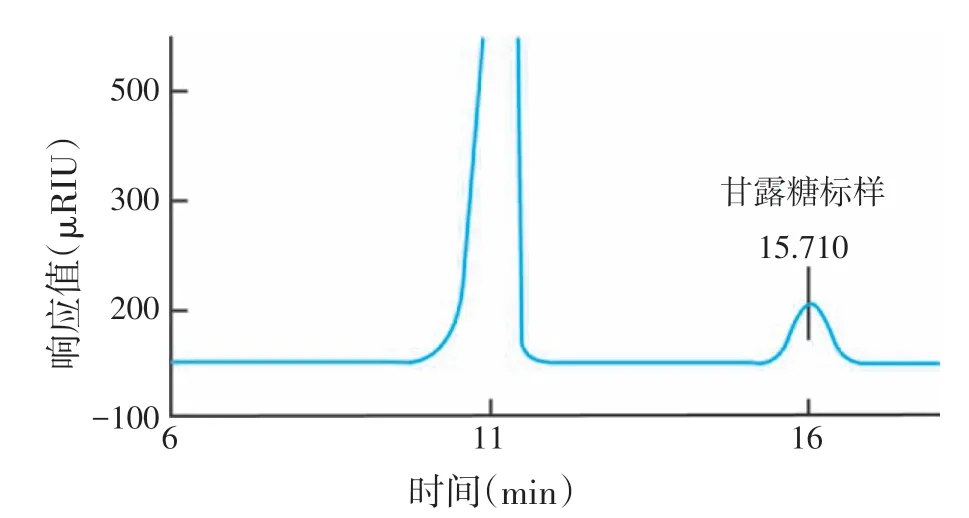
图10 甘露糖标准品的液相色谱图
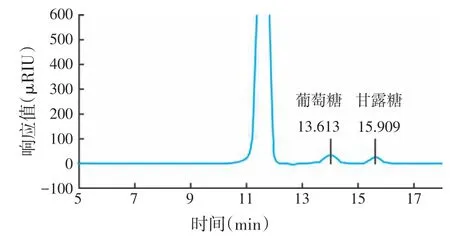
图11 待测样品的液相色谱图
2.8 布拉氏酵母壁多糖抗氧化活性的测定(见图12)
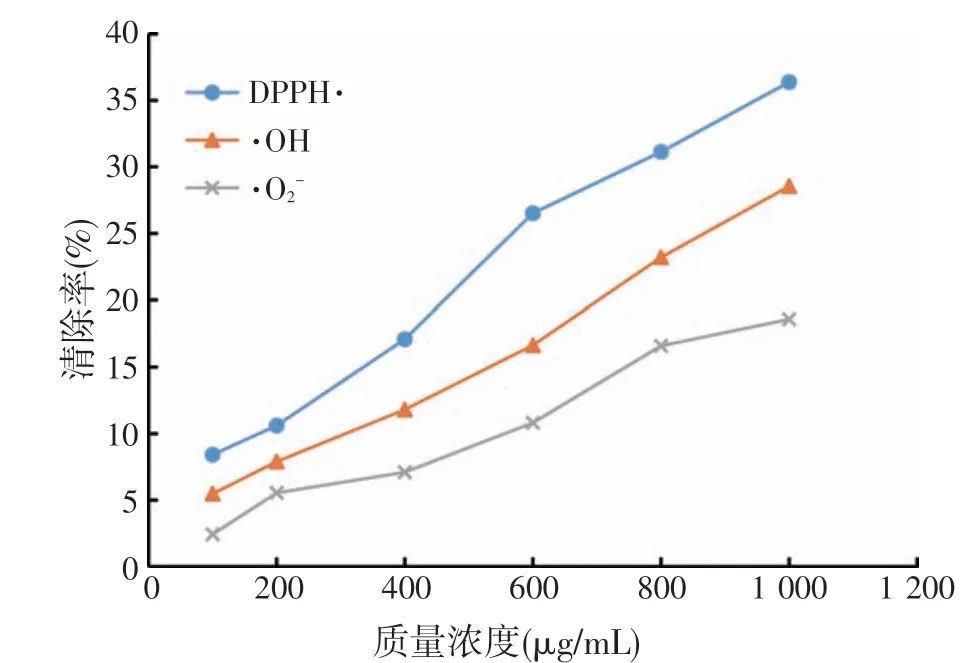
图12 布拉氏酵母壁多糖分别对DPPH·、·OH、·O清除作用
由图12所示,布拉氏酵母壁多糖具有一定的抗氧化性,并有明显的量效关系,但清除不同自由基的能力存在差异。总体来看,布拉氏酵母壁多糖对DPPH·的清除能力最强,清除率为36.38%,而对·OH和·O的清除效率较低,分别为28.55%和18.60%。
2.9 布拉氏酵母壁多糖的抑菌结果分析(见表8)
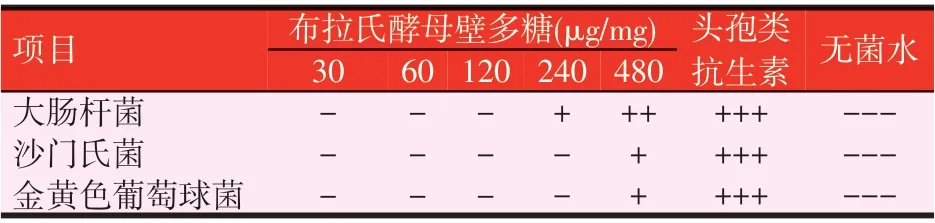
表8 布拉氏酵母壁多糖对3种常见微生物的抑菌效果
由表8所示,布拉氏酵母壁多糖在480 μg/mg时,对大肠杆菌、沙门氏菌和金黄色葡萄球菌均产生了一定的抑菌效果,其中对大肠杆菌的抑菌效果最好,其抑菌圈直径为(14.61±1.69)mm,对沙门氏菌和金黄色葡萄球菌的抑菌效果较弱,分别为(11.20±1.41)mm 和(9.61±0.80)mm;其多糖浓度在240 μg/mg时,只对大肠杆菌表现出抑菌效果,其抑菌圈为(9.92±0.81)mm,对沙门氏菌和金黄色葡萄球菌无抑制作用,阳性对照组头孢类抗生素对大肠杆菌、沙门氏菌和金黄色葡萄球菌的抑菌效果明显,其抑菌圈直径分别达到(24.74±2.36)、(24.67±2.43)mm和(24.43±2.44)mm。布拉氏酵母壁多糖对大肠杆菌、沙门氏菌和金黄色葡萄球菌的最小抑制浓度(MIC)分别为240 μg/mg和480 μg/mg。
2.10 布拉氏酵母壁多糖对早期断奶羔羊盲肠微生物的影响(见表9)
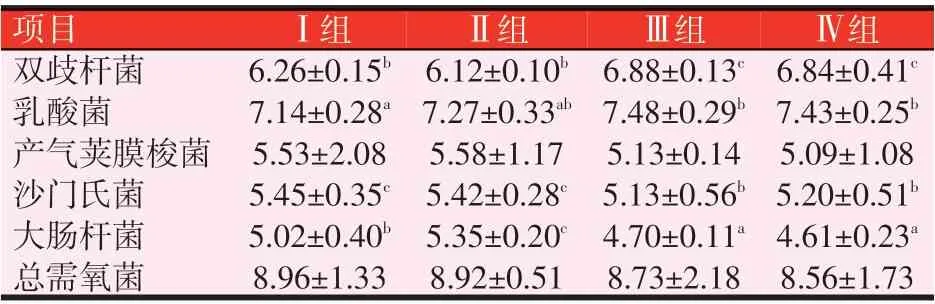
表9 布拉氏酵母壁多糖对羔羊盲肠微生物的影响(lg CFU/g)
由表9可知,各组羔羊盲肠中双歧杆菌、乳酸菌、沙门氏菌和大肠杆菌的数量差异显著(P<0.05)。Ⅲ组的双歧杆菌数量为6.88 lg CFU/g,显著高于Ⅰ组(P<0.05),Ⅲ组和Ⅳ组较Ⅰ组显著提高了9.90%和9.26%(P<0.05);Ⅲ组的乳酸菌数量最高为7.48 lg CFU/g,显著高于Ⅰ组(P<0.05),Ⅲ组和Ⅳ组较Ⅰ组显著提高了4.76%和4.06%(P<0.05);Ⅲ组的沙门氏菌数量最低为5.13 lg CFU/g,其次为Ⅳ组5.20 lg CFU/g,Ⅲ组和Ⅳ组较Ⅰ组显著降低了5.87%和4.59%(P<0.05)。Ⅳ组的大肠杆菌数量最低为4.61 lg CFU/g,显著低于Ⅰ组(P<0.05),Ⅲ组和Ⅳ组较Ⅰ组显著降低了6.37%和8.17%(P<0.05)。各组产气荚膜梭菌和总需氧数量的差异不显著(P>0.05),Ⅲ组和Ⅳ组的产气荚膜梭菌数量和总需氧菌数量较Ⅰ组分别降低7.23%、7.96%和1.79%、4.69%(P>0.05)。
3 讨论
提高发酵目标产物的得率通常需要对多种发酵因素相结合进行试验,同时还要考虑各因素(例如培养基、温度、pH以及溶氧量)之间的相互作用。本试验确定自配2培养基为布拉氏酵母壁多糖的最佳发酵培养基,最适发酵条件为pH 5.93、温度29.71 ℃、转速426.81 r/min,其多糖的实际产量为573.70 mg/100 mL,为优化前产量的1.6 倍。据报道,裴芳艺等[24]通过单因素、Plackett-Burman(PB)和中心组合设计(CCD)试验发现,近粉红锁掷孢酵母(Sporidiobolus pararoseus)产胞外多糖的最佳发酵条件为:自配培养基、28 ℃、转速210 r/min、pH 5.1、6 h,其胞外多糖产量为(4.60±0.13)g/L,是优化前的1.40倍。王宏涛[25]发现,锁掷酵母在pH 6.0、28 ℃、接种量10%、72 h 的发酵条件下,其胞外多糖产量可达到(8.9±0.3)g/L。后续研究可以通过对高产多糖布拉氏酵母菌株进行筛选或通过生物分子技术对菌种进行工程改造以达到更高产量。一般情况下分子量小于50 ku的多糖基本无生物学活性,而具有生物活性的酵母壁多糖分子量一般介于100~500 ku之间[26]。在本研究发现,布拉氏酵母壁多糖两个主要的多糖组分分子量分别为22.76 ku 和9.09 ku,分别占总量的63.12%和28.70%,其中葡聚糖和甘露糖分别占其中一种多糖组分中的43.20%和29.55%。张鑫等[27]在枸杞多糖分子量分布测定与抗炎活性关联研究的研究中发现,枸杞多糖分子质量分布2~106 ku 之间,其中分子质量为34.6 ku 的多糖与抗炎活性关联较强。有些酵母壁多糖具有一定的抗氧化作用。在本试验的抗氧化试验中发现,布拉氏酵母壁多糖的抗氧化能力有限,对DPPH·、·OH和·O2-的清除效率分别为36.38%、28.55%和18.60%。据报道,在质量浓度为8 mg/mL时,多糖组分为7.125×106u的胶红酵母多糖组分对DPPH·清除率为49.1%,ABTS 自由基清除率为51.2%,还原力为0.352[28]。一些酵母壁多糖能改变肠道微生物菌群的结构并影响微生物在小肠黏膜上皮细胞的黏附能力,从而有效地改善动物肠道内菌群的平衡。在本研究中发现,布拉氏酵母壁多糖的体外抑菌能力较强,特别是对于大肠杆菌,其浓度达到240 μg/mg 就能抑制其生长;在体内试验中发现,添加了0.3%~0.5%的布拉氏酵母壁多糖能显著提高早期断奶羔羊盲肠中双歧杆菌和乳酸菌等益生菌的数量,并显著降低沙门氏菌和大肠杆菌的数量,贺琴等[29]在酵母壁多糖对断奶仔猪肠道挥发性脂肪酸和微生物菌群的影响的研究中发现,添加0.3%的酵母壁多糖能显著降低仔猪肠道中大肠杆菌和沙门氏菌的数量,显著提高双歧杆菌、乳酸杆菌的数量。
4 结论
本试验通过单因素试验确定了自配2 培养基作为布拉氏酵母壁多糖的最佳发酵培养基,发酵因素对酵母壁多糖产量影响由大到小的顺序为转速>pH>温度,其最佳发酵条件为pH 5.93、温度29.71 ℃、转速426.81 r/min,其多糖理论产量为590.48 mg/100 mL、实际产量为573.70 mg/100 mL,相对误差为2.84%,优化后壁多糖产量是优化前1.6倍。
布拉氏酵母壁多糖的主要组分为BLC1和BLC2,分别占总量的63.12%和28.70%、其分子量分别为22.76 ku 和9.09 ku,其中葡聚糖和甘露糖分别占BLC1多糖组分中的43.20%和29.55%。
布拉氏酵母壁多糖对DPPH·、·OH和·O2-的清除效率分别为36.38%、28.55%和18.60%;布拉氏酵母壁多糖对大肠杆菌的抑制能力较强,当质量浓度为240 μg/mg可抑制大肠杆菌的生长,当质量浓度为480 μg/mg可抑制金黄色葡萄球菌和沙门氏菌的生长。
以布拉氏酵母壁多糖的添加比例0.3%~0.5%饲喂早期断奶羔羊,能显著提高早期断奶羔羊盲肠中双歧杆菌和乳酸菌的数量,同时显著降低沙门氏菌和大肠杆菌的数量。

