商品化复合型与自配LG培养基对保障生产线无菌验证效果的对比分析
杨宁,卢勉飞,李艳嫦,蔡芷荷,3,吴清平,余锦銮
(1.广东环凯微生物科技有限公司,广东广州 510663)(2.广东省微生物研究所,广东广州 510070)(3.广东环凯生物科技有限公司,广东肇庆 526238)
随着无菌冷灌装生产线逐渐成为中国饮料行业的主流生产工艺[1-9],如何确保冷灌装生产线无菌,对于饮料生产是一个非常重要的环节。不单是饮料还有药品,为确保无菌生产工艺系统中无菌的可靠性和适应性,国内法规及指导文件均要求通过一定的验证方法对其进行验证[10-12]。多数企业采用培养基灌装试验来证明其无菌工艺的可靠性[13-16]。培养基灌装又称无菌培养基模拟灌装试验,是采用微生物培养基替代产品对无菌工艺进行评估的验证[15,16]。GB/T 24571-2009规定了PET瓶无菌冷灌装生产线验证的培养基为LG培养基[11,16-19]。
目前,饮料企业大多数是自行购买LG培养基配方中的各个原材料配制LG培养基,用于冷灌装生产线的无菌验证。由于培养基原材料一般是化学和生物试剂,不同厂家的试剂质量优劣不齐,饮料企业对培养基所用的原料控制比较粗放,导致饮料企业采用自行配制的LG培养基验证时,经常会出现培养基混浊,颜色不一的现象,以致不能使用;或者出现LG培养基检测微生物的灵敏度低,不能如实地反映生产线的微生物污染情况,导致造成很大的生产风险以及由于微生物污染造成的损失。
针对这一行业共性问题,我们通过优选LG培养基配方所用的原料,以及研究及优选出合适的生产工艺,生产出商品化复合型LG干粉培养基,解决饮料企业自行配制培养基存在批间差的问题。相关文献也表明,复合型的LG培养基无论对细菌还是真菌,均具有较高的检测灵敏度及较优的促生长能力[20]。
本研究采用中国饮料罐装生产线上常见的污染菌株作为试验菌株[20,21],以半定量的方法,以符合标准的工厂化生产的3批复合型LG培养基作为参照,比较由同一集团3个饮料分厂分别提供的各个原料在本实验室配制的LG培养基,对比其在外观、理化指标及微生物指标(灵敏度)方面的差异,得出一定的研究结论,旨在为PET瓶饮料无菌灌装生产线的无菌验证进行培养基选择时提供参考。
1 材料与方法
1.1 培养基
3批商品化复合型LG培养基(复合型LG:1069401、1069361、1069421)、血平板和改良马丁琼脂均由广东环凯微生物科技有限公司提供;3批自配LG培养基分别由国内某食品集团公司的3个分厂提供,分别命名为自配G、自配T和自配H。
1.2 仪器与设备
BSC-1360-LⅡB2生物安全柜,北京东联哈尔仪器;PB-10 pH计,赛多利斯;HVE50灭菌锅,日本HIRAYAMA;DNP-9162电热恒温培养箱,广东环凯微生物科技有限公司。
1.3 培养基的制备
取复合型LG培养基3批(批号:1069401,1069361,1069421)与3个自行配制的LG培养基分别按LG培养基配方配制量称取于不同的2 L三角瓶中,各加1000 mL的纯化水,充分溶解后,煮沸,冷却至45 ℃,测定各瓶培养基的初始pH值,然后用碱调节至相同的pH,分装试管,每管10 mL。上述培养基121 ℃高压灭菌15 min后备用。
LG配方[17]:葡萄糖20 g/L,蛋白胨2 g/L,酵母提取物3.5 g/L,硫酸铵2 g/L,硫酸镁1 g/L,磷酸二氢钾1 g/L,pH值6.5±0.2。
1.4 试验菌株
金黄色葡萄球菌(Staphylococcus aureus)ATCC 6538、肺炎克雷伯氏菌(Klebsiella. peneumoniae)CMCC(B) 46117、枯草芽孢杆菌黑色变种(Bacillus subtilis var. niger)ATCC 9372、铜绿假单胞菌(Pseudomonas. aeruginosa)ATCC 27853、洋葱假单胞菌(Pseudomonas cepacia)ATCC 25416、蜡样芽孢杆菌(Bacillus cereus)CMCC(B)63303、黑 曲 霉(Aspergillus niger)ATCC 16404、白色念珠菌(canidia albicans)ATCC 10231,由广东环凯微生物科技有限公司提供。
1.5 试验用菌悬液的制备
1.5.1 细菌试验用菌悬液的制备
将试验菌株接种于血平板上,置36 ℃±1 ℃培养18 h~24 h,以无菌生理盐水悬浮培养物,制备成约含活菌数100~1000 CFU/mL的菌悬液,再以无菌生理盐水10倍稀释成分别制成约含活菌数10~100 CFU/mL和1~10 CFU/mL的菌悬液,备用。
1.5.2 霉菌试验用菌悬液的制备
将试验菌株接种于改良马丁琼脂斜面上,置25 ℃±1 ℃培养7 d,加入3~5 mL含0.05%(V/V)聚山梨酯80的无菌生理盐水,轻轻洗脱孢子。并以无菌生理盐水稀释制备成约含活菌数100~1000 CFU/mL、10~100 CFU/mL和1~10 CFU/mL的菌悬液,备用。
上述试验菌株的培养物均使用新鲜培养物,传代次数不超过5代。
1.6 试验方法
分别取上述2个不同剂量(10~100 CFU/mL、1~10 CFU/mL)的试验菌株的菌悬液1 mL种接于LG 6个检样的培养基管中。于30 ℃±1 ℃中培养18 h~24 h后,轻轻振摇试管,同时与无生长管(阴性对照管)比较,当出现肉眼可见的混浊时计为生长管(阳性管)。逐日观察结果,直到各个菌在各自配培养基上均出现相同的生长速度。分别记录不同接种量的受试培养基的混浊程度。每种受试培养基每稀释度分别接种3管培养基。
2 结果与讨论
2.1 感观及理化试验
不同LG培养基感观及理化结果如表1所示。

表1 LG培养基3批及3个自配的感观及理化结果Table 1 The results of sensory and physicochemical of LG media form four manufactor
在感观方面,复合型LG 3批与自配G的相当,均为澄清无沉淀,浅黄色,符合LG培养基的标准;优于自配T和自配H,其培养基底部有黑色杂质,其中自配T轻微混浊,有白色絮状沉淀,且为黄色,色泽最深,这两个自配LG培养基感官均不合格。由此可见,饮料企业自行采用不同原料配制的培养基其外观存在较大差异,黑色杂质、白色絮状沉淀及色泽过深均会影响结果的观察及判断。而3批复合型LG培养基的感官一致,没有批间差异。
在理化方面,自配G、自配T和自配H,初始pH值均较低,灭菌前需调节pH值到合适的范围,灭菌后才能达到要求的pH值;而复合型LG灭菌前无需调整pH,灭菌后3批均在标准要求范围(6.5±0.2)内,可以直接使用。
复合型LG培养基的准确性和稳定性均优于其它三个自配的LG培养基。
2.2 金黄色葡萄球菌的生物学结果
生长速度结果如图1所示。第1 d时,金黄色葡萄球菌在3批复合型LG上均生长有轻微混浊,而在自配G、自配H和自配T3个自配的培养基上均未见生长;第2 d时,金黄色葡萄球菌在复合型LG 3批和自配T上均达到生长良好的状态,而在自配H上可见轻微混浊,自配G仍未见生长;第3 d时,金黄色葡萄球菌在复合型LG 3批、自配H和自配T上均达到生长极好的状态,而在自配G上才可见轻微混浊。直到第5 d,自配G才达到生长极好的状态。5 d后金黄色葡萄球菌在6个样品上的生长无明显差别。
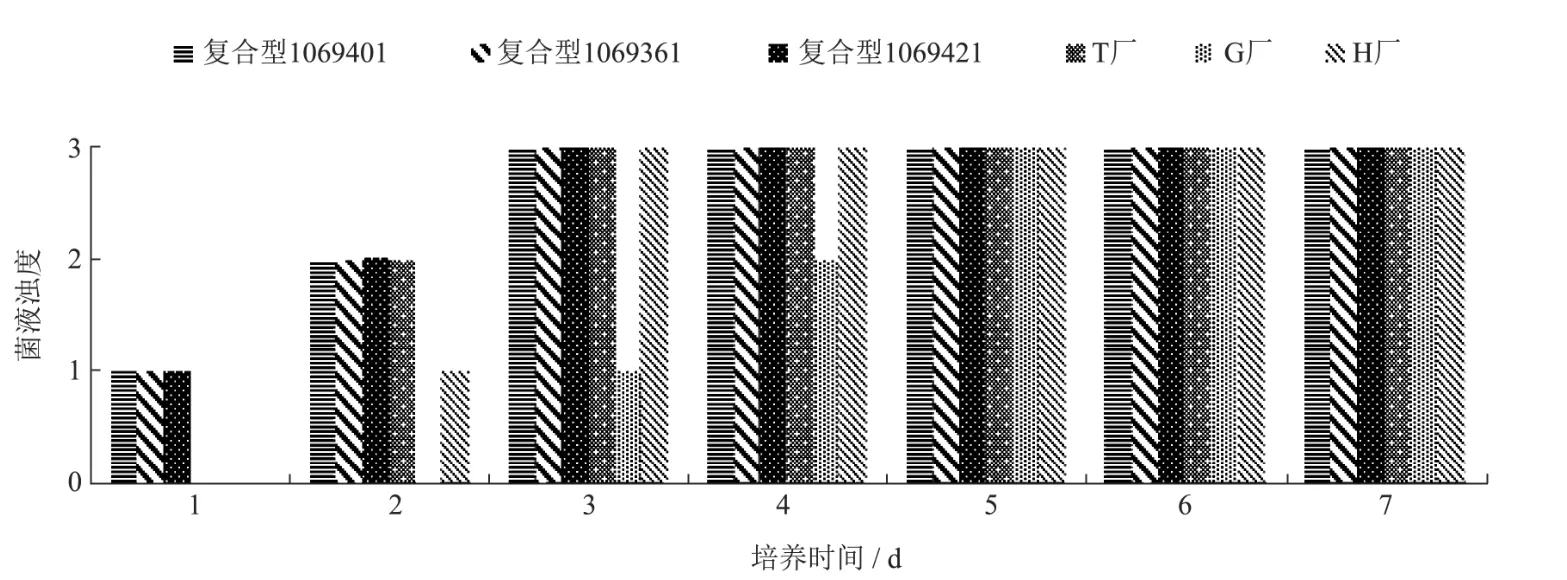
图1 金黄色葡萄球菌(6 CFU)在不同厂家LG培养基上的生长情况Fig.1 Growth of Staphylococcus aureus (6 CFU) on LG medium from different manufacturers
2.3 肺炎克雷伯氏菌的生物学结果
生长速度结果如图2所示。第1 d时,肺炎克雷伯氏菌在复合型LG 3批上均生长有轻微混浊,而在自配G、自配H和自配T3个自配的培养基上均未见生长;第2 d时,肺炎克雷伯氏菌在复合型LG 3批上均达到生长良好的状态,而在自配G、自配H和自配T上可见轻微混浊;第3 d时,肺炎克雷伯氏菌在复合型LG 3批及自配T上均达到生长极好的状态,而在自配G和自配H上分别为生长良好和轻微混浊。直到第4 d,自配G和自配H才达到生长极好的状态。4 d后肺炎克雷伯氏菌在6个样品上的生长无明显差别。
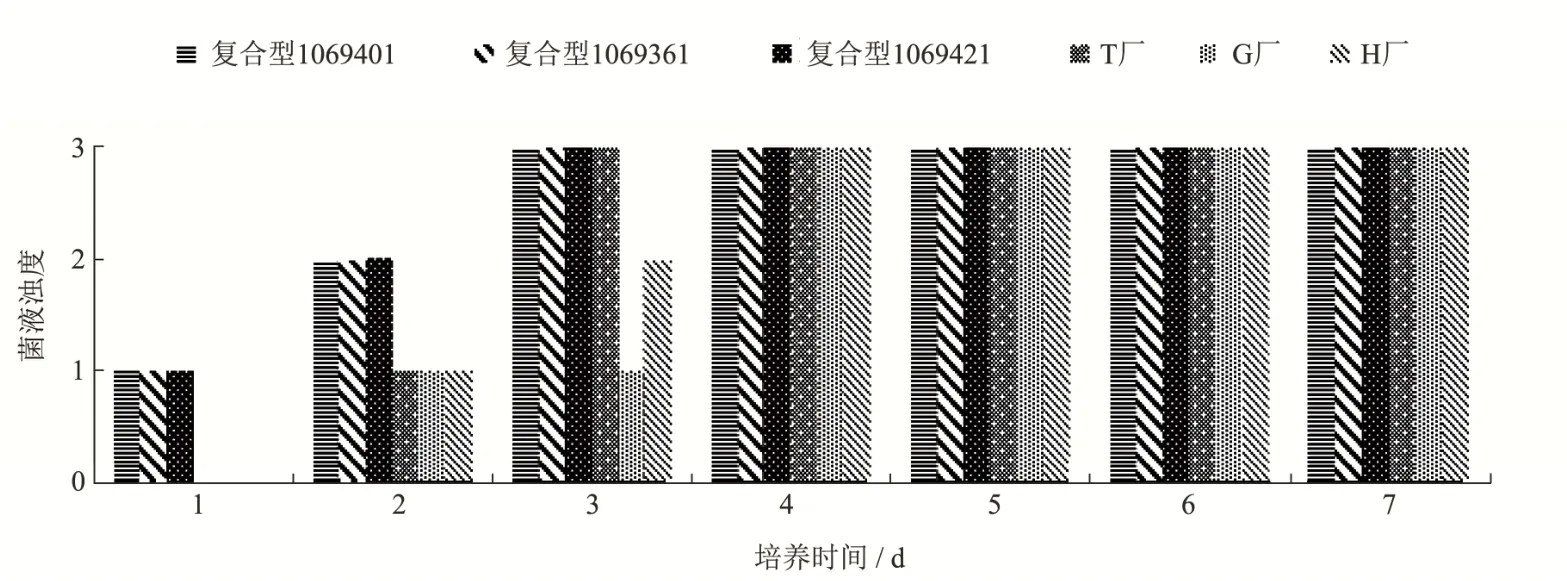
图2 肺炎克雷伯氏菌(7 CFU)在不同厂家LG培养基上的生长情况Fig.2 Growth of Klebsiella pneumoniae (7 CFU) on LG medium from different manufacturers
2.4 枯草芽孢杆菌黑色变种的生物学结果
生长速度结果如图3所示。第1 d时,枯草芽孢杆菌黑色变种在复合型LG 3批上均生长有轻微混浊,而在自配G、自配H和自配T3个自配的培养基上均未见生长;第2 d时,枯草芽孢杆菌黑色变种在复合型LG 3批上均达到生长极好的状态,而在自配T上生长良好,在自配G和自配H可见轻微混浊;第3 d时,除在自配H上为生长良好外,枯草芽孢杆菌黑色变种在其余样品上均达到生长极好的状态;而在自配G和自配H上分别为生长良好和轻微混浊。直到第4 d,自配H才达到生长极好的状态。4 d后枯草芽孢杆菌黑色变种在6个样品上的生长无明显差别。

图3 枯草芽孢杆菌黑色变种(8 CFU)在不同厂家LG培养基上的生长情况Fig.3 Growth of Bacillus subtilis var. Niger (8 CFU) on LG medium from different manufacturer
2.5 铜绿假单胞菌的生物学结果
生长速度结果如图4所示。第1 d时,铜绿假单胞菌在复合型LG 3批和自配G上均生长有轻微混浊,而在自配T和自配H2个自配的培养基上均未见生长;第2 d时,铜绿假单胞菌在复合型LG 3批上均达到生长良好的状态,而在自配G、自配H和自配T上仍为可见轻微混浊;第3 d时,铜绿假单胞菌在复合型LG 3批上均达到生长极好的状态,而在自配G、自配H和自配T上均为生长良好。直到第4 d,自配G、自配H和自配T才达到生长极好的状态。4 d后铜绿假单胞菌在6个样品上的生长无明显差别。
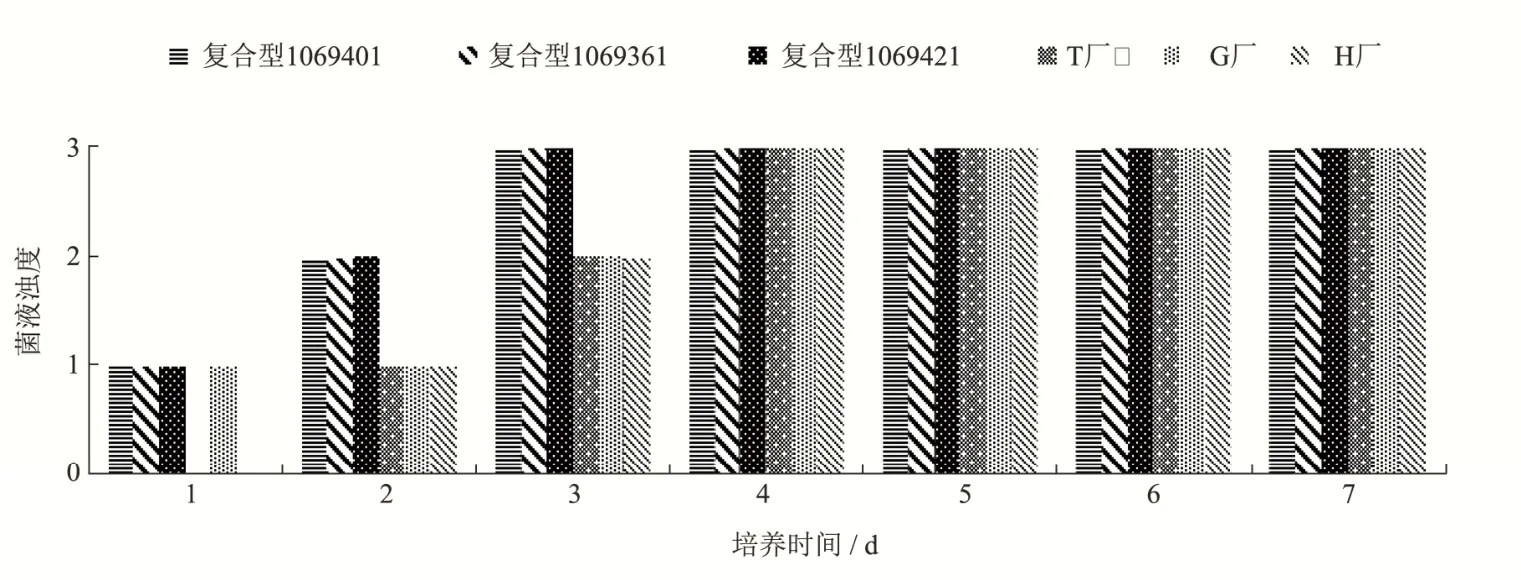
图4 铜绿假单胞菌(8 CFU)在不同厂家LG培养基上的生长情况Fig.4 Growth of Pseudomonas aeruginosa (8 CFU) on different LG media from different manufacturer
2.6 洋葱假单胞菌的生物学结果
生长速度结果如图5所示。第1 d时,洋葱假单胞菌在6个样品上均未见生长;第2 d时,洋葱假单胞菌在复合型LG 3批和自配G上均有轻微混浊,而在自配H和自配T2个自配的培养基上均未见生长;第3 d时,洋葱假单胞菌在复合型LG 3批上均达到生长极好的状态,而在自配G和自配T上分别为生长良好和轻微混浊,在自配H上仍为未见生长。直到第4 d,自配G和自配T才达到生长极好的状态,而自配H一直未见生长。4 d后,除自配H外,洋葱假单胞菌在其余5个样品上的生长无明显差别,7 d内均未观察到自配H有生长。

图5 洋葱假单胞菌(8 CFU)在不同厂家LG培养基上的生长情况Fig.5 Growth of Pseudomonas cepacia (8 CFU) on LG medium from different manufacturers
2.7 蜡样芽孢杆菌的生物学结果
生长速度结果如图6所示。第1 d时,蜡样芽孢杆菌在6个LG培养基样品上均生长有轻微混浊;第2 d时,蜡样芽孢杆菌在复合型LG 3批上均达到生长良好的状态,而在自配G、自配H和自配T厂上仍为可见轻微混浊;第3 d时,蜡样芽孢杆菌在复合型LG 3批和自配H厂上均达到生长极好的状态,而在自配G和自配T上均为生长良好。直到第4 d,自配G和自配T才达到生长极好的状态。4 d后蜡样芽孢杆菌在6个样品上的生长无明显差别。

图6 蜡样芽孢杆菌(4 CFU)在不同厂家LG培养基上的生长情况Fig.6 Growth of Bacillus cereus (4 CFU) on LG medium from different manufacturers
2.8 黑曲霉的生物学结果
生长速度结果如图7所示。第1、2 d时,黑曲霉在6个样品上均未见生长;第3 d时,黑曲霉在复合型LG 3批上均有轻微混浊,而在自配G、自配H和自配T3个自配的培养基上均未见生长;第4 d时,黑曲霉在复合型LG 3批上均达到生长良好的状态,而在自配H和自配T上均为轻微混浊,在自配G上仍为未见生长。第5 d时,黑曲霉在复合型LG 3批上均达到生长极好的状态,自配H才达到生长良好的状态,自配T未见有进一步的生长,自配G仍为未见生长;第6 d时,自配H也达到了生长极好的状态,而自配T为生长良好,自配G仍为未见生长;第7 d时,除自配G仍为未见生长外,黑曲霉在其余5个样品上的生长无明显差别,均达到生长极好的状态。

图7 黑曲霉(8 CFU)在不同厂家LG培养基上的生长情况Fig.7 Growth of Aspergillus niger (8 CFU) on LG medium from different manufacturers
2.9 白色念珠菌的生物学结果
生长速度结果如图8所示。第1 d时,白色念珠菌在6个样品上均未见生长;第2 d时,白色念珠菌在复合型LG 3批上均有轻微混浊,而在自配G、自配H和自配T3个自配的培养基上均未见生长;第3 d时,白色念珠菌在复合型LG 3批上均达到生长良好的状态,而在自配G和自配T上均为轻微混浊,在自配H上仍为未见生长。第4 d时,白色念珠菌在复合型LG 3批上均达到生长极好的状态,自配G和自配T上均为生长良好的状态,而自配H为轻微混浊;第5 d时,白色念珠菌在复合型LG 3批和自配G上均达到生长极好的状态,自配H和自配T上均为生长良好;第6 d时,自配H和自配T才达到生长极好的状态。6 d后白色念珠菌在6个样品上的生长无明显差别。

图8 白色念珠菌(6 CFU)在不同厂家LG培养基上的生长情况Fig.8 Growth of Candida albicans (6 CFU) on LG medium from different manufacturers
3 讨论
3.1 无菌培养基模拟灌装试验,无论采用TSB或LG培养基,在上线验证前均需对培养基进行性能测试[10,12,17],如果培养基灵敏度不够,会导致试验结果无法真实的反映灌装工艺的无菌保证水平,所以在试验前对培养基进行灵敏度试验,确保培养基的灵敏度及促生长实验符合要求[20,22]。
3.2 在本研究中,微生物促生长方面,3批次复合型LG效果相当,微生物促生长效果均优于3个自配LG,而且3个自行配制的LG培养基的促生长能力差异较大,稳定性不好。第7 d时,8个测试菌在3批次复合型LG上生长均已达最大值,而自配G和自配H分别接种黑曲霉和洋葱假单胞菌的3个平行管依然未见生长。可见,自配G和自配H LG培养基的促生长能力不稳定,存在漏检的风险。促生长能力越强、越稳定,微生物生长速度越快,越能准确、快速地发现生产线的染菌情况,从而可以及早作出处理,避免了在时间上的浪费以及出现微生物漏检的风险。
3.3 出现上述差异的原因,主要是饮料企业自行配置的LG培养基,是自行购买培养基原材料配制的,由于培养基原材料中的酵母浸粉、蛋白胨是生物试剂,质量批间差较大,受专业程度和保存菌株多样性的限制,饮料企业很难对培养基原材料像专业培养基生产厂家那样进行全面的微生物生长指标测试,所以不同的企业配置出来的培养基质量有很大的差异;加上LG培养基配方中含盐较多,在自行配制过程中需按一定的投料顺序一项一项进行,须等前一组完全溶解后才能加入下一组成分,否则容易出现混浊或沉淀,其实是LG培养基组分在配制过程中的性能已发生了改变,不同程度上也会影响检测微生物的灵敏度;另外,配制过程中pH的调试也容易出现不稳定性,这些因素导致即使是同一个饮料企业配制出来的培养基批间差也较大。而商品化复合型LG培养基是由专业培养基生产商研发生产的,所用的每批原材料均进行严格筛选,确保原材料批间质量的稳定性,同时通过专业的、标准化的生产工艺控制,确保每批复合型LG培养基批间的感官、理化及灵敏度的稳定性。
4 结论
PET瓶饮料无菌灌装生产线的无菌验证所用的LG培养基建议选用商品化复合型LG,尽量避免自行购买原材料配制LG培养基,以降低由于原料的质量不稳定以及配制的复杂过程导致培养基质量无法控制的风险。

