达氟沙星残留生物条形码检测技术的建立
穆文静,刘培,尹会敏,栗慧,孙丰梅,郭芬芳,白升,魏东*
(1.河北北方学院农林科技学院,河北省农产品食品质量安全分析检测重点实验室,河北张家口 075000)(2.张家口市宣化区农业农村局,河北张家口 075000)
随着人们生活水平的不断提高,对动物性食品的需求量也随之增大,养殖户在利益的驱动下,抗生素滥用的情况越来越严重,常常在动物体内造成大量残留,人类食用了含有抗生素残留的动物源性食品后,身体健康受到严重危害,因此建立一种超灵敏检测抗生素残留的生物条形码技术十分必要。达氟沙星(Danofloxacin,DFLX)又名单诺沙星,是氟喹诺酮药物中的一种[1,2]。常常被用于治疗畜禽动物的疾病,导致动物体内药物残留量超标。因此DFLX不仅存在被滥用的风险,而且它的滥用也会导致一系列严重的后果,如增加细菌的耐药性、危害动物源食品安全和人类药物资源,并且有可能对人体安全造成直接危害[3-5]。ENLX、DFLX、SALX、盐酸二氟沙星均属于兽类专用药[6]。目前,兽药残留量的检测方法主要有:微生物法和仪器分析法[7]。微生物法检测周期长、灵敏度低,该方法只适合用做初步筛选使用;仪器分析法检测灵敏度虽高,但需要昂贵的仪器设备和专业的操作人员,因此很难被广泛应用。近几年,随着动物源性食品中兽药残留超标事件的频频发生,甚至在动物体内存在含量较小的抗生素,传统的技术手段很难检测出来,因而建立一种快速、高效的药物残留检测方法是十分必要的。
2003年Mirkin课题组首次提出了生物条形码检测技术,该技术的突出特点是具有极高的敏感度,在微量物质的检测中有着广泛的应用前景[8,9]。在生物条形码检测体系中,一般应用到两种功能化的纳米粒子分别是磁性微珠(magnetic microparticles,MMP)和金纳米颗粒(GNPs)[10]。本研究将单克隆抗体修饰在激活的磁珠表面制成磁性探针,多克隆抗体和双链DNA修饰在金纳米颗粒表面制成金纳米探针,当待测物中含有DFLX时,三者杂交形成MMP-DFLX-NP“三明治”结构,经过磁性分离释放出生物条形码DNA链,对释放的DNA建立基于微孔板银染的生物条形码检测技术方法进行定量分析检测。生物条形码检测技术检测灵敏度高、特异性强且不需要昂贵的仪器设备、也不需要专业的技术人员等优点,是目前应用最为广泛的一种检测技术手段,因此该技术未来具有良好的应用价值和广泛的发展空间。
1 材料与方法
1.1 材料
1.1.1 试剂
达氟沙星标准品(Danofloxacin,DFLX)、牛血清白蛋白(BSA)、鸡卵清蛋白(OVA)、N,N’-二甲基甲酰胺、TMB显色液,购自美国Sigma公司;氯金酸(HAuCl4)、柠檬酸三钠,国药集团化学试剂有限公司;羧基磁珠,购自海狸生物科技有限公司;DNA链,均由上海生工生物有限公司合成;达氟沙星单克隆抗体,购自MCE公司;DFLX多克隆抗体,本实验室自制。
1.1.2 仪器
酶标仪、紫外分光光度计、透射电子显微镜、恒温振荡培养箱、高速离心机、磁力架等。
1.2 方法
1.2.1 纳米金的制备及鉴定
纳米金有多种制备方法,但目前应用最广泛的就是柠檬酸钠还原法制备纳米金。在开始制备纳米金前需要将实验用到的所有玻璃器皿放入酸缸中浸泡一天一宿,取出后用自来水冲洗至少3遍,再用蒸馏水冲洗1遍,放置烘箱中烘干备用。取1 mL 1%氯金酸水溶液放入99 mL的超纯水中充分混匀,将上述混合置于磁力搅拌器上边搅拌边加热至沸腾,沸腾后迅速加入1.5 mL现配的1%柠檬酸三钠溶液观察其颜色变化,待颜色逐渐由黑灰色变为紫色最后变成透明的酒红色时,停止加热,将溶液冷却至室温重新定容于100 mL的容量瓶中恢复原体积,放置4 ℃冰箱中保存备用。
1.2.2 金纳米探针(NP)制备
A液:取1 mL纳米金溶液,分别加入不同浓度的多抗,筛选出添加抗体的最适量,用0.1 mol/L K2CO3调节pH至9.0,旋涡混匀15 min,而后加入5%的BSA作为稳定剂,以防止胶体金和抗体发生团聚。
B液:将巯基DNA链加到上述A液中,室温静置40 h,再用PBS调整pH至7.0,10000 r/min,离心15 min。
C液:将条形码DNA链加到上述B液中,室温杂交6 h,13000 r/min,离心20 min,得到NP探针。
1.2.3 磁性探针(MMP)制备
取1 mL磁珠在磁性条件下除去活化液,再加1 mL的15 mmol/L MES溶液清洗4次,磁分离后,迅速加入100 μL MES溶液和100 μL的EDC溶液均匀,25 ℃活化30 min;称量200 μg单抗溶入20 mL的PBST缓冲液中,然后将其加入到激活的磁珠中,剧烈振荡,静置24 h,磁性分离,弃掉上清液。在40 mL的PBS中重悬磁珠,加入20 mL甘氨酸溶液,剧烈振荡,反应30 min,磁性分离,扔掉上清;用PBS清洗3次,磁性分离;加50 mL PBST重悬磁珠,4 ℃保存备用。
1.2.4 检测探针制备
首先用TE缓冲液将检测探针DNA链溶解,按照1:200的比例和TCEP溶液混合,震荡过夜。然后将上述检测探针溶液加入到制备好的纳米金溶液中混合均匀,室温放置16 h。24 h内分6次加入一定量的NaCl,静置40 h。而后在4 ℃条件下10000 r/m,离心25 min,除去未结合的DNA链,最后加入1 mL的10 mmol/L的磷酸盐缓冲液混匀,4 ℃保存备用。
1.2.5 制备MMP-DFLX-NP “三明治”结构
取DFLX标准品10 μg加入到磁性探针溶液中使二者充分杂交,37 ℃剧烈振荡1 h;磁场固定磁性探针(MMP),用PBS溶液清洗3~4次,除去未结合的DFLX抗原;加入纳米金探针,形成三明治结构,剧烈振荡45 min;磁场固定MMP,用PBS多次清洗3~4次,以除去未结合的NP。在上述三明治结构中加入无菌水,使DNA条形码在60 ℃的条件下充分振荡1 h,用磁场固定MMP,收集上清液,该上清液中含有生物条形码。具体的生物条形码制备过程如图一所示。
1.2.6 建立微孔板银染的生物条形码检测方法
在含有25 μL的生物条形码溶液中加入20 μL杂交缓冲液,充分混匀,接着加入1 μL的生物素探针溶液,25 ℃反应15 min;再吸取5 μL的检测探针溶液加到上述混合液中充分反应15 min,三者形成“三明治”复合物,将复合物转移到提前包被了链霉亲和素的酶标板中,于25 ℃孵育30 min,孵育完用PBS清洗1遍,每次3 min,拍干;再用PBN清洗2遍,每次3 min,拍干;随后每孔内加入TMB显色液,避光显色反应10~15 min,拍干,在酶标仪上读取630 nm处的吸光值。
2 结果与讨论
2.1 纳米金的制备与鉴定
紫外分光光度计扫描纳米金在400~700 nm波长范围内的最大吸收峰值,扫描结果显示其最大吸收峰值波长在520 nm处,吸光度值A=0.6523,呈现圆滑的曲线,初步证明纳米金制备成功。
透射电镜观察纳米金的形貌特征,扫描结果显示其形状大小均一且颗粒与颗粒之间分散均匀,没有出现重叠现象,再次证明纳米金制备成功。

图2 纳米金透射电镜图Fig.2 Transmission electron microscopy of gold nanoparticles
2.2 金纳米探针(NP)的制备
2.2.1 优化纳米金标记DFLX多克隆抗体的pH
通过添加0.1 mol/L K2CO3来调节纳米金标记DFLX多抗的最佳pH值,由图3可以看出当0.1 mol/L K2CO3添加量达到9 μL时其pH变化幅度逐渐减小,因此,确定每毫升纳米金标记DFLX多抗的K2CO3添加量为9 μL。
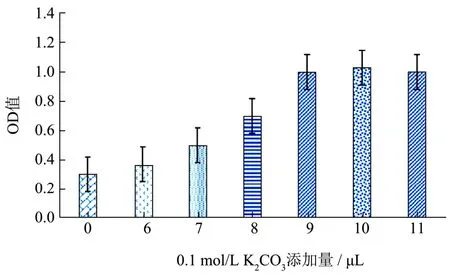
图3 纳米金标记多克隆抗体的最佳pH确定Fig.3 Determination of optimal pH of gold-labeled polyclonal antibodies
2.2.2 优化纳米金修饰DFLX多抗添加量
确定了纳米金修饰DFLX多克隆抗体的最适pH值后,加入不同量的DFLX多克隆抗体,混匀后各管中分别加入10% NaCl溶液100 μL,静置15 min,首先通过肉眼观察发现当抗体添加量达到20 μg/mL时,胶体金的颜色保持红色不变,当抗体添加量小于20 μg/mL时候,从4号管开始纳米金开始发生由红变蓝的现象,因此,确定DFLX抗体的最少添加量为20 μg/mL,终于抗体添加量按照最少抗体添加量的20%来计算,所以,抗体的最优添加量为24 μg/mL,并通过紫外扫描光谱来鉴定纳米金标记多抗前后其最大吸收波长由520 nm处平移到527 nm处,证明纳米金成功标记上了DFLX多克隆抗体。

图4 纳米金标记抗体蛋白最适添加量Fig.4 Optimal amount of gold-labeled antibody protein
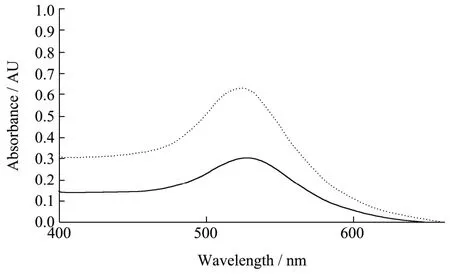
图5 纳米金标记DFLX多抗的紫外扫描图Fig.5 Ultraviolet scanning of gold labeled DFLX polyclonal antibody
2.2.3 双链DNA标记DFLX多抗修饰的纳米金颗粒
透射电镜观察发现纳米金复合探针标记上DFLX多抗和双链DNA以后其周围有一层模糊的晕圈,说明在其表面连接上了一层低电子密度的物质,证明制备成功。
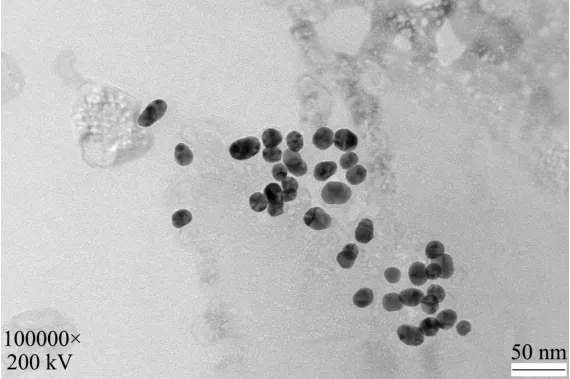
图6 双链DNA标记DFLX多抗修饰的纳米金Fig.6 Double-stranded DNA labeled DFLX multi-resistant modified gold nanoparticles
2.3 MMP探针的鉴定
磁性颗粒经过透射电镜鉴定观察其表面有一层清晰可见的晕圈,说明磁性颗粒表面成功标记了单克隆抗体,即磁性探针制备成功。
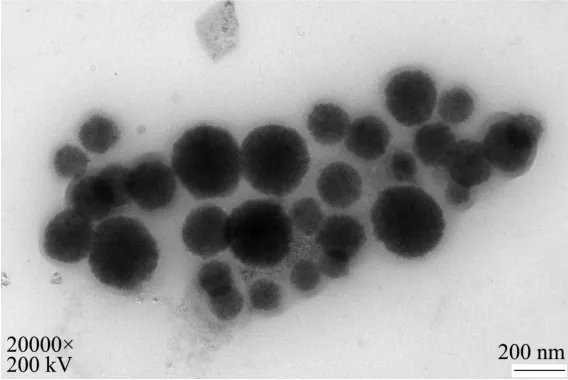
图7 磁性颗粒标记后Fig.7 After labeling with magnetic particles
2.4 检测探针的鉴定
图8 检测探针经紫外分光光度计扫描鉴定其最大吸收峰值发生在524 nm处,与纳米金最大吸收峰相比,标记后发生了4 nm的位移,表明纳米金颗粒成功标记了巯基修饰的DNA链,即检测探针制备成功。
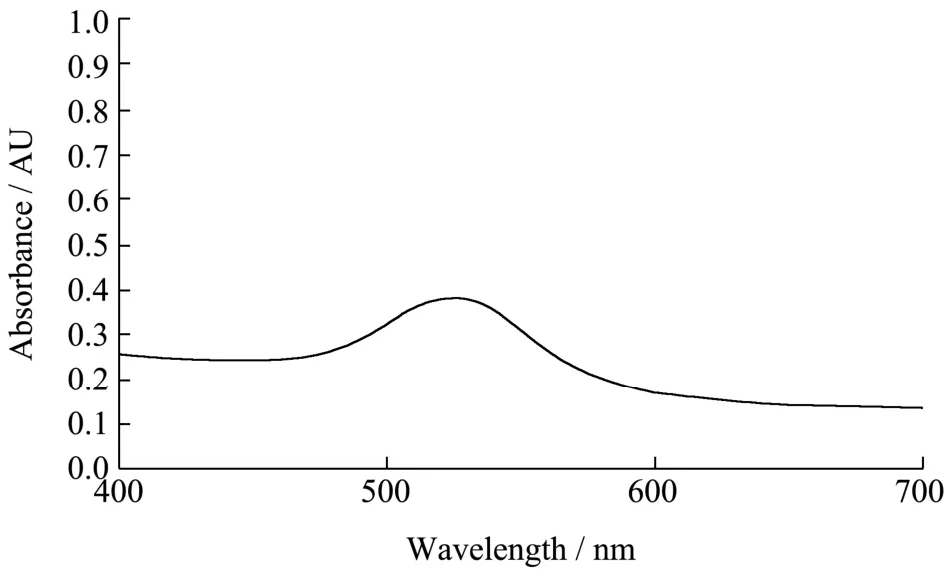
图8 检测探针UV-vis扫描图Fig.8 UV-vis scan of detection probe

图9 检测探针透射电镜图Fig.9 Transmission electron micrograph of probe
2.5 微孔板银染杂交体系的优化
2.5.1 链霉亲和素包被浓度的优化
在包被了链霉亲和素的微孔板表面组装生物素探针-生物条形码-检测探针复合物,因此其包被浓度是关键的影响因素。本实验将链霉亲和素包被浓度稀释成0.01、0.06、0.1、0.15、0.2 mg/kg五个浓度,检测其浓度与吸光度值之间的关系,由图10可以看出,链霉亲和素的包被浓度达到0.1 mg/kg时,其吸光度值趋于稳定,因此,本实验选择浓度为0.1 mg/kg为最佳包被浓度。
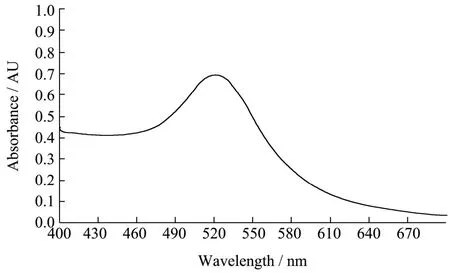
图1 纳米金紫外光谱图Fig.1 Ultraviolet spectra of gold nanoparticles
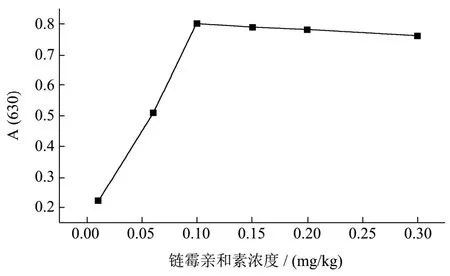
图10 链霉亲和素浓度的优化Fig.10 Optimization of Streptavidin concentration
2.5.2 生物素探针的优化
优化生物素探针本实验分别设定了0、10、20、50、100、150、200 nmol/L不同的浓度值,从图11可以看出,当生物素探针浓度达到100 nmol/L时,其吸光度值的变化逐渐变小,因此,选定生物素探针的最佳浓度为100 nmol/L。
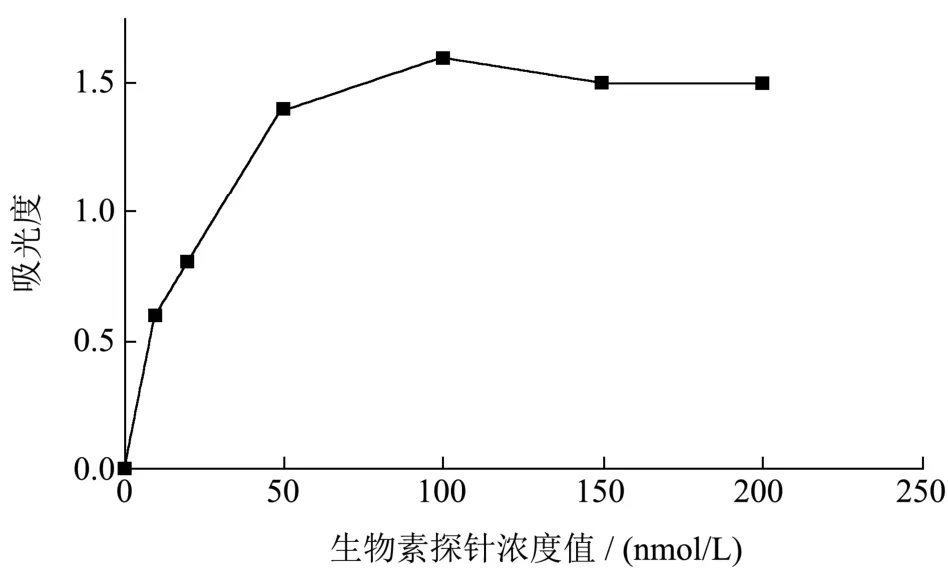
图11 生物素探针的优化Fig.11 Optimization of biotin probe
2.5.3 检测探针浓度的优化
对检测探针进行不同浓度的稀释0、10、20、50、80、100、150、200 nmol/L,结果见图12,可以看出当检测探针浓度达到80 nmol/L的时候,其吸光度值最大,然后继续增大检测探针的浓度观察发现吸光度值逐渐减小,因此,确定检测探针的最优浓度为80nmol/L。
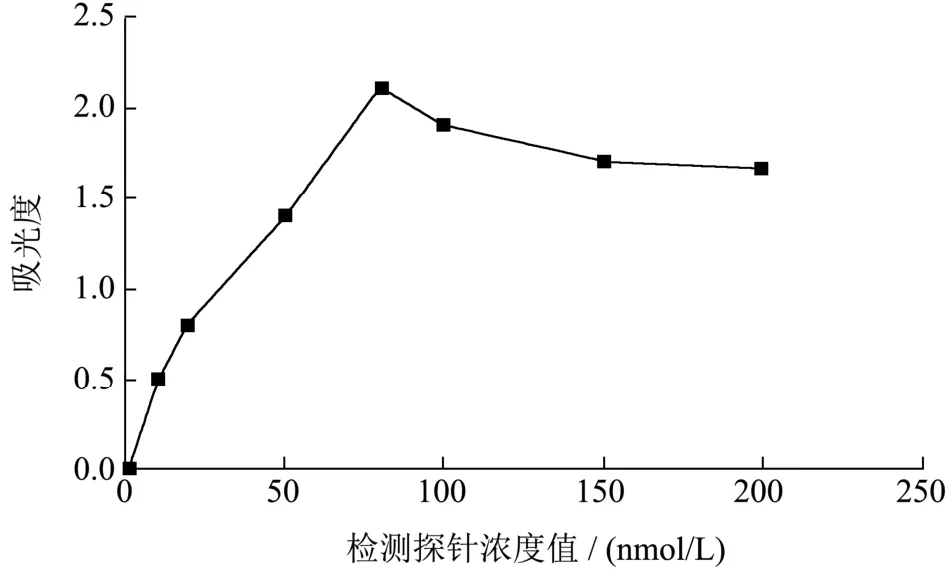
图12 检测探针的优化Fig.12 Optimization of detection probe
2.5.4 银染时间的优化
分别设定了0、2、5、7、9、10、11、12 min不同的银染时间,扫描选出最佳银染时间,结果见图13,可以看出银染时间在0~9 min之间检测点灰度值上升速度很快,当银染时间达到9 min时其灰度值上升速度缓慢,因此,本实验最终确定最佳的银染时间为9 min时。

图13 银染时间的优化Fig.13 Optimization of silver staining time
2.5.5 该免疫方法检测DFLX的标准曲线的建立
建立基于微孔板银染的生物条形码检测方法来测定达氟沙星的线性检测范围和检出限,设定达氟沙星的浓度在0.05~50 ng/mL范围内,以达氟沙星浓度的对数值和抑制率为横纵坐标建立标准曲线,用下列公式计算抗生素IC15值,以IC15作为该方法的最低检出限。
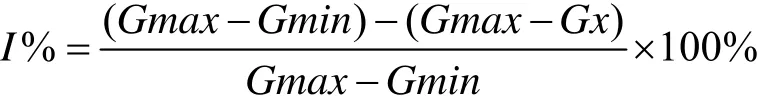
式中:
I——抑制率;
G max——加抗生素的浓度值;
Gmin——空白对照孔的值;
G x——抗生素浓度为x时的值。
在上述设定的范围内,达氟沙星浓度的log值与抑制率呈现良好的线性关系,拟合其回归方程为y=0.2432x+0.4834,R²=0.9898,根据公式计算得出IC15为3.62 ng/mL,结果显示上述检测方法能够实现对达氟沙星抗生素残留的定量检测,并且该检测方法灵敏度较高。
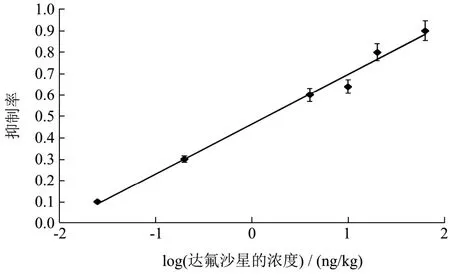
图14 该免疫分析方法的达氟沙星标准曲线Fig.14 The standard curve of the immunoassay for fluoxetine
3 讨论
在包被了链霉亲和素的微孔板内添加纳米金,而后加入银染增强液,利用银染作用放出信号,最后利用酶标仪检测生物条形码的含量。该技术不需要购买昂贵的仪器设备,普通实验室利用酶标仪即可实现对生物条形码含量的检测,这种方法的建立给一些资源有限的实验室提供了极大的方便,并节省了一大部分花销。
但是该检测方法也存在缺点在进行信号放大作用时主要依赖银染增强液,由于银染增强液具有不稳定性,可能会导致最终检测结果出现假阳性,使最终测得的结果不够准确。因此,该方法在大批量使用前是需要将银染增强液这一不确定因素进行充分完善后方可大量推广应用。
生物条形码检测技术可以检测到浓度超低的物质,具有其他检测方法不具备的超灵敏特点,该技术操作起来十分简便,对操作人员的操作能力要求不高;检测范围面较为广泛,只需要具备被检物的单克隆抗体和多克隆抗体即可进行检测;但是该检测技术也存在着一定的缺陷,该检测技术跟一些核酸检测方法相比,其检测灵敏度是远远达不到的;另外,所需要的反应时间过长,试验成本较高;若今后把重心放在缩短整个反应时间以及降低试验成本上,该检测技术将得到更大的发展空间。
4 结论
4.1 当抗生素含量较少时传统的检测方法通常不能够准确的检测到其含量,而生物条形码技术检测就可以检测到浓度超低的物质,其检测灵敏度是ELISA检测灵敏度的106倍,该技术具备操作简单、不需要昂贵的仪器设备,特异性强等特点。
4.2 本实验建立的基于微孔板银染的生物条形码检测技术能够实现对DFLX残留量的快速检测,其最低检测限为3.62 ng/mL,其检测灵敏度是传统的免疫技术的100万倍,该方法的建立为以后检测其他FQNs小分子物质的残留提供了新的技术,也为以后能制备高灵敏度的DFLX生物条形码检测试剂盒奠定了基础。

