苯并咪唑类杀菌剂分子印迹预聚体系的筛选及其吸附性能
苏君梅,池建伟,张瑞芬,张名位,贾栩超*
(1.华南农业大学食品学院,广东广州 510640)(2.广东省农业科学院蚕业与农产品加工研究所,农业农村部功能食品重点实验室,广东省农产品加工重点实验室,广东广州 510610)
植物提取物因具有抗氧化,抗炎、提高免疫力、调节糖脂代谢、抗肿瘤等多种良好的生理活性[1-3],已成为保健食品和功能食品的重要原料。然而,农药残留超标严重阻碍了植物提取物行业的优质高效发展[4,5]。苯并咪唑类杀菌剂是一类广谱性杀菌剂,主要包括多菌灵、噻菌灵、阿苯达唑和苯菌灵等,被广泛应用于农业病原菌的防治。但该类杀菌剂具有致畸、致突变以及胚胎毒性,残留超标会严重危害人体健康[6]。近年来,已有多起因该类农药残留超标引起的安全问题和贸易受阻[7]。因此,建立一种高效的苯并咪唑类杀菌剂农药残留脱除技术,对于提升植物提取物行业质量安全水平和促进产业快速良性发展具有重要意义。
近年来,MIPs作为一类性质稳定、成本低且对目标物具有特异识别性能的新型吸附材料[8],被广泛应用于色谱分离[9]、固相萃取[10]和传感器[11]等领域。FAROOQ等[12]以CBZ为模板分子,β-环糊精为功能单体,采用沉淀聚合法制备的MIPs,对CBZ的最大吸附容量为3.65 mg/g。Raif等[13]同样以CBZ为模板分子,制备了具有磁性的MIPs,对CBZ的吸附能力为2.31±0.63 mg/g,可应用于苹果和橙中CBZ残留的检测。MIPs的制备通常采用试错法,该法试错周期长且试错成本高[14]。随着计算化学和波谱技术的发展,基于计算机分子模拟以及波谱分析的预聚体筛选手段显著提高了分子印迹材料的合成效率及吸附性能[15]。李璐等[16]借助Materials Studio软件分子模拟和紫外光谱分析手段筛选功能单体和致孔剂,制备的溴氰菊酯MIPs静态吸附量达到68.61 mg/g。Farrington等[17]通过核磁共振分析手段结合计算机分子模拟筛选功能单体及致孔剂,合成的MIPs对咖啡因表现出良好的富集效果。
目前,以苯并咪唑类农药为模板合成MIPs的研究已有报道,但合成的分子印迹材料主要以分析型的固相萃取填料为主,吸附量较低,且对同类型农药的吸附广谱性较差。此外,目前选择合成分子印迹材料功能单体和致孔溶剂的方法主要以试错法为主,效率较低且盲目性高。基于计算机分子模拟合成苯并咪唑类杀菌剂MIPs的研究尚未见报导。因此急需科学高效的合成一种对苯并咪唑类杀菌剂具有广谱吸附性的分子印迹材料。本研究以苯并咪唑类杀菌剂的共有母核结构AMB为模板分子,通过高斯化学计算软件结合核磁波谱分析手段筛选功能单体种类、模板分子与功能单体比例以及致孔溶剂种类,通过正交试验优化合成MIPs的最优条件,解决现有分子印迹材料合成周期长、广谱性差的问题,为植物提取物中苯并咪唑类杀菌剂的脱除提供一种高性能吸附填料。
1 材料与方法
1.1 仪器与试剂
Avance III HD 400 M超导核磁共振波谱仪,德国Bruker公司;S-7300N钨灯丝扫描电子显微镜,日本Hitachi公司;Gemini VII 2390全自动比表面积及孔隙分析仪,美国麦克公司;Vertex 70傅里叶变换红外光谱仪,德国Bruker公司;Netzsch TG 209 F1 Libra热重分析仪,德国Netzsch公司。
多菌灵(carbendazim,CBZ)、2-氨基苯并咪唑(2-aminobenzimidazole,AMB)、噻菌灵、阿苯达唑、苯菌灵购于上海阿拉丁生化科技有限公司;甲基丙烯酸(methacrylic acid,MAA)、丙烯酸(acrylic acid,AA)、丙烯酰胺(acrylamide,AAM)、甲基丙烯酸甲酯(methyl methacrylate,MMA)、N,N-亚甲基双丙烯酰胺(N,N'-Methylenebisacrylamide,MBA)、衣康酸(itaconic acid,IA)、乙二醇二甲基丙烯酸酯、偶氮二异丁腈购于上海麦克林生化科技有限公司;色谱级甲醇购于美国Fisher公司;其他试剂均为分析纯。
1.2 分子印迹预聚体模拟筛选
1.2.1 功能单体种类及比例的筛选
以AMB为模板分子,选择常见制备MIPs的功能单体甲基丙烯酸(MAA)、丙烯酸(AA)、丙烯酰胺(AAM)、甲基丙烯酸甲酯(MMA)、N,N-亚甲基双丙烯酰胺(MBA)以及衣康酸(IA),参考杨文明[18]的方法,用Gaussian 09W中的Restricted Hartree-Fock(RHF)自洽场理论和NBO理论,在真空中,运用6-31G基组优化模板分子、功能单体分子及两者不同比例混合物的几何结构,得到最低稳定能量,以式(1)计算模板分子与各功能单体的结合能ΔE。
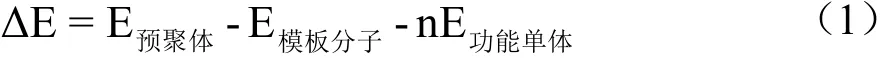
式中:
E——各组分的单点能,kJ/mol;
n——功能单体的数量。
1.2.2 致孔溶剂的筛选
选择氯仿、N,N-二甲基甲酰胺、乙腈和正己烷4种具有代表性的致孔溶剂。参考陈晓龙等[19]的方法,采用RHF方法,6-31G基组,极化连续溶剂模型(Polarizable continuum model,PCM),按式(2)计算溶剂化能。
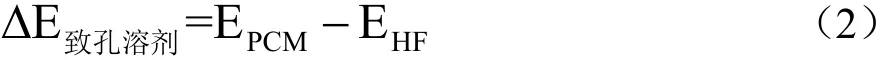
式中:
ΔE致孔溶剂——体系的溶剂化能,kJ/mol;
EPCM——溶剂状态下体系的单点能,kJ/mol;
EHF——真空状况下体系的单点能,kJ/mol。
1.3 AMB与功能单体预聚体的核磁氢谱分析
参考Farrington等[17]的方法,将AMB、不同功能单体及AMB与不同功能单体形成的预聚体均用氘代氯仿溶解(浓度均为0.04 mol/L),经Avance III HD 400 M核磁共振波谱仪测定核磁氢谱。
1.4 MIPs的制备
采用沉淀聚合法制备分子印迹聚合物[20],称取一定量AMB和功能单体分散于致孔溶剂中,搅拌1 h。加入一定量乙二醇二甲基丙烯酸酯和144.5 mg(0.88 mmol)偶氮二异丁腈,搅拌均匀后超声10 min,充氮气10 min,在60 ℃的磁力搅拌水浴锅中密闭反应24 h。所得聚合物用甲醇-乙酸溶液(体积比9:1)洗脱,每30 min更换一次洗脱液直到检测不到模板分子,用甲醇和蒸馏水除去乙酸,60 ℃真空干燥,得到的白色粉末状聚合物即为MIPs。非印迹聚合物(non-imprinted polymers,NIPs)的制备与MIPs相同,但不加入模板分子。
1.5 正交试验
根据对计算机模拟与波谱分析的研究结果以及单因素试验结果,进一步采用L9(34)设计正交试验,其因素和水平设计如表1所示。
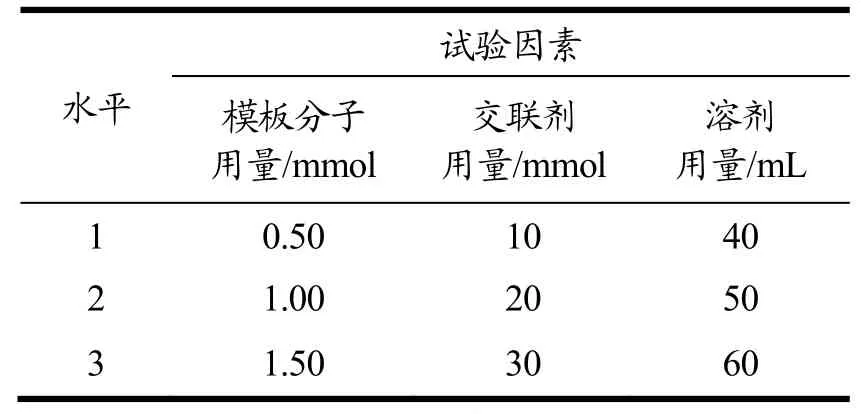
表1 正交试验因素水平Table 1 Factors and levels of orthogonal design test
1.6 MIPs的结构表征
1.6.1 扫描电镜检测
用扫描电镜对最优条件下合成的MIPs以及NIPs进行形貌表征。将待测样品均匀涂覆在导电胶上,采用离子溅射仪对MIPs喷金,然后在室温下进行扫描电镜测试。
1.6.2 比表面积与孔容孔径参数测定
MIPs和NIPs的比表面积和孔容孔径采用Gemini VII 2390分析仪测量。样品在110 ℃下脱气24 h后,采用氮吸附法进行参数测定[21]。
1.6.3 红外光谱检测
采用Vertex 70傅里叶变换红外光谱仪对CBZ标准品、MIPs和吸附CBZ后MIPs的化学结构进行表征,采用溴化钾压片法,将样品和KBr以1:100的质量比混合后研磨均匀,20 MPa压力下压片得到薄片进行波谱扫描,扫描波数范围为4000~400 cm-1[22]。
1.6.4 热重分析
采用Netzsch TG 209 F1 Libra热重分析仪对MIPs和NIPs进行热重分析。在氮气保护下,将样品以10 ℃/min的升温速率和30 mL/min的氮气流量从30加热至600 ℃进行测试[23]。
1.7 MIPs吸附性能的测定
1.7.1 动态吸附曲线测定与吸附动力学分析
参考颜朦朦[24]的方法,分别称取10 mg MIPs和NIPs,加入100 mg/L的CBZ标准品溶液10 mL,在室温下,震荡不同时间间隔(10~240 min)。离心(6000 r/min,10 min),测定上清液中CBZ的浓度。根据公式(3),计算其不同时间对应的吸附量。采用一级动力学反应模型公式(4)和二级动力学反应模型公式(5)对MIPs的动态识别机制进行深入探讨。

式中:
Q——平衡时MIPs对分析物的吸附量,mg/g;
C0——分析物的初始浓度,mg/L;
Ce——分析物的上清液终浓度,mg/L;
V——加入吸附溶液的体积,L;
m——加入MIPs的质量,g。
一级动力学反应模型公式:
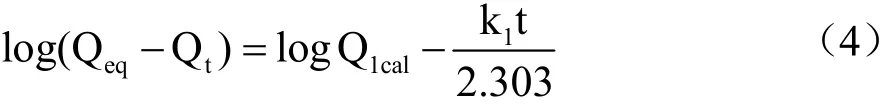
式中:
Qeq——MIPs的平衡吸附量,mg/g;
Qt——MIPs在不同时间下的吸附量,mg/g;
Q1cal——一级动力学模型理论吸附量,mg/g;
k1——一级动力学模型吸附速率常数;
t——吸附时间,min。
二级动力学反应模型公式:

式中:
Q2cal——二级动力学模型理论吸附量,mg/g;
k2——二级动力学模型吸附速率常数。
1.7.2 静态吸附曲线测定与Scatchard分析
具体过程参照动态吸附实验,根据1.7.1部分实验结果固定吸附时间,CBZ的浓度设定为0.1~100 mg/L。根据公式(3)计算不同浓度对应的吸附量。通过公式(6)进行Scatchard方程分析[24]。
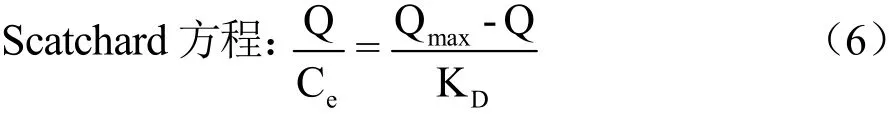
式中:
Qmax——最大表观吸附量,mg/g;
KD——平衡常数。
1.7.3 苯并咪唑类杀菌剂广谱吸附实验
参考周刘梅[25]的方法,并稍作修改。称取4份MIPs 10 mg,分别加入100 mg/L CBZ、噻菌灵、阿苯达唑和苯菌灵的标准溶液。于室温下震荡2 h后离心(6000 r/min)10 min,根据式(3)、(7)和(8)计算MIPs对各底物的静态吸附量Q(mg/g)、静态分配系数K和印迹因子IF。

式中:
Cp——底物结合在MIPs上的浓度,mg/L;
Cs——上清液中底物的浓度;mg/L。

式中:
KMIPs——MIPs的静态分配系数;
KNIPs——NIPs的静态分配系数。
1.8 MIPs固相萃取实验
MIPs固相萃取柱的制备:参考陈晓龙[26]的方法,并稍作修改。称取100 mg MIPs作为固相萃取填料置于柱体积为5 mL、底部有聚乙烯筛板的聚丙烯空柱中,作为MIPs固相萃取小柱。
加标石斛多糖提取液的制备:称取3.0 g新鲜石斛,加入80 mL蒸馏水匀浆后沸水浴提取30 min,抽滤除去滤渣得到石斛多糖提取液。提取液中分别加入2.0 mg CBZ、噻菌灵、阿苯达唑和苯菌灵,加蒸馏水定容至200 mL。
MIPs固相萃取柱对农药的脱除:控制抽气泵的压力为15 MPa,用10 mL乙腈活化分子印迹填料,10 mL加标石斛多糖提取液上样,再用10 mL正己烷淋洗,最后用10 mL甲醇-乙酸溶液(9:1,V/V)进行洗脱,分别收集上样流出液、淋洗流出液和洗脱液,检测上样液与流出液中四种农药以及总糖的含量[27],计算农药脱除率以及总糖损失率。
1.9 数据统计分析
采用SPSS 25.0软件对数据进行方差分析,并用Origin 9.1对数据进行制图。显著性水平p<0.05。
2 结果与分析
2.1 分子印迹预聚体的模拟筛选
2.1.1 功能单体种类及比例的筛选
分子印迹聚合过程中,模板分子与功能单体形成预聚体的结合能ΔE越低,表明它们的相互作用越大,形成的MIPs越稳定[28]。AMB与各功能单体预聚体的最低能量构象见图1,不同聚合体的结合能见表2。由表2可知,AMB与AA之间相互作用最强,MAA、IA次之。进一步选择AA、MAA和IA,筛选它们与AMB的最适比例。结果如图2所示,AMB-IA预聚体的结合能较AMB-MAA和AMB-AA而言最低,且在摩尔比为1:2时下降趋势最为明显,说明AMB-IA预聚体摩尔比为1:2时合成的MIPs较稳定。
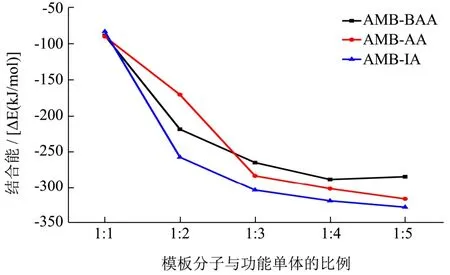
图2 AMB与不同功能单体在不同比例下的结合能Fig.2 ΔE of AMB and different functional monomers at different ratios
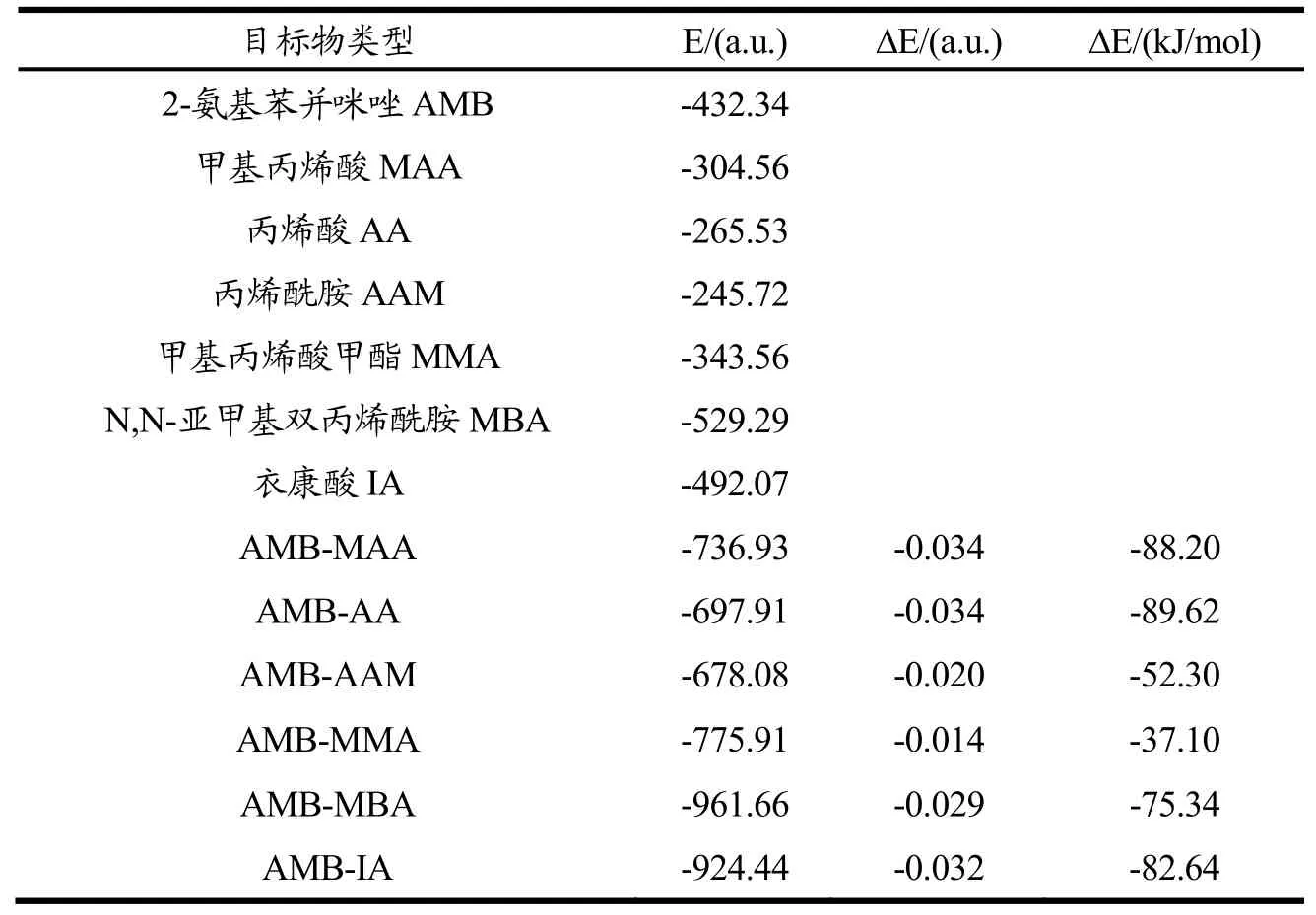
表2 AMB、功能单体以及预聚体的结合能Table 2 ΔE of AMB, functional monomer and prepolymers
图1 AMB与功能单体的最低能量构象Fig.1 Lowest energy conformation of AMB and functional monomer
2.1.2 致孔溶剂的筛选
AMB与MAA、AA和IA形成的预聚体在氯仿、N,N-二甲基甲酰胺、乙腈和正己烷这4种常用致孔溶剂中的溶剂化能如表3所示。其中,ΔE乙腈最高,表明乙腈与各预聚体的相互作用最小,有利于提供较好的聚合环境。
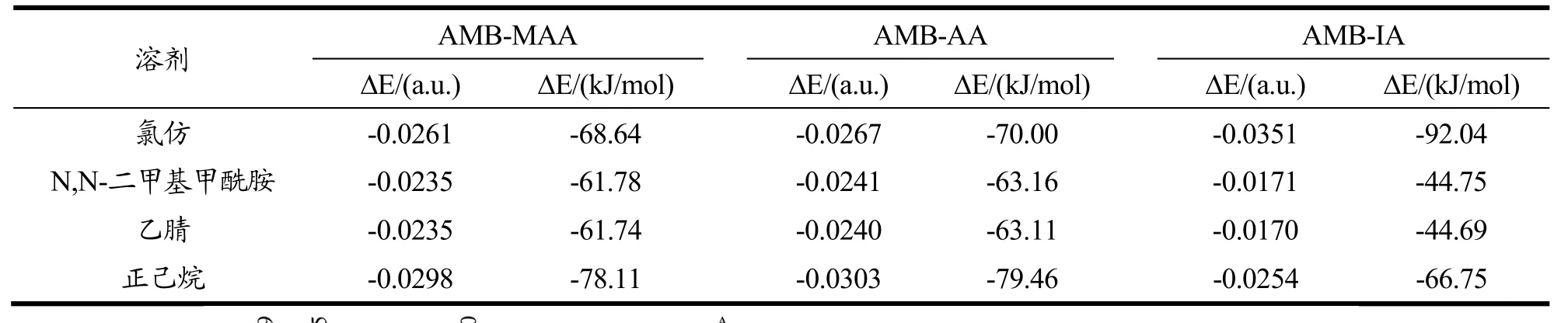
表3 AMB与功能单体复合物在不同溶剂中的溶剂化能Table 3 ΔE between AMB and functional monomer complex in different solvents
2.2 预聚体核磁氢谱分析
核磁共振谱图中分子间相互作用的强弱反映在质子的化学位移变化上[29]。由图3可知,AMB中3个质子(A、B和C)的峰位移大小为δAMB-IA>δAMB-AA>δAMB-MAA>δAMB-AAM>δAMB-MBA>δAMB-MMA。表明AMB与IA的相互作用最强,形成的预聚体最稳定。这与计算机模拟结果相一致。FARRINGTON等[17]通过核磁共振分析法结合计算机分子模拟,筛选制备咖啡因MIPs的最适致孔溶剂、功能单体及比例。两种预聚体筛选方法的结合有助于提高制备MIPs的效率,降低盲目性。
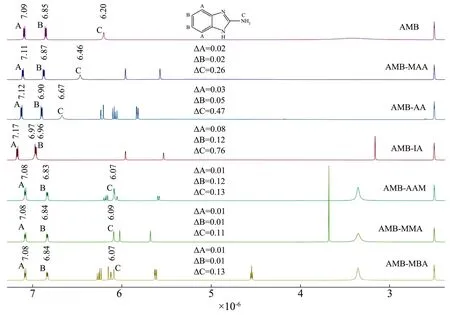
图3 AMB与AMB-功能单体预聚体的核磁氢谱Fig.3 NMR spectra of AMB and AMB-functional monomer prepolymers
2.3 正交试验结果
根据AMB与不同功能单体预聚体系的研究结果,选择IA作为功能单体,乙腈作为致孔溶剂,固定AMB与IA的摩尔比为1:2。根据前人研究表明[18],乙二醇二甲基丙烯酸甲酯(EGDMA)为常用交联剂,由它制备出MIPs具有良好选择性。此外,偶氮二异丁腈(AIBN)为常用引发剂,故将EGDMA作为交联剂,AIBN作为引发剂,采用沉淀聚合法制备MIPs。
以MIPs对代表性的苯并咪唑类杀菌剂CBZ的吸附量为评价指标,对制备条件进行优化。由单因素试验结果可知,固定EGDMA用量为20 mmol,乙腈用量为50 mL时,AMB用量为1 mmol的条件下,MIPs的吸附量最大,为7.58 mg/g;固定AMB用量为1 mmol,乙腈用量为50 mL时,EGDMA用量为20 mmol的条件下,MIPs的吸附量最大,为8.47 mg/g;固定AMB用量为1 mmol,EGDMA用量为20 mmol时,乙腈用量为50 mL的条件下,MIPs的吸附量最大,为7.53 mg/g。
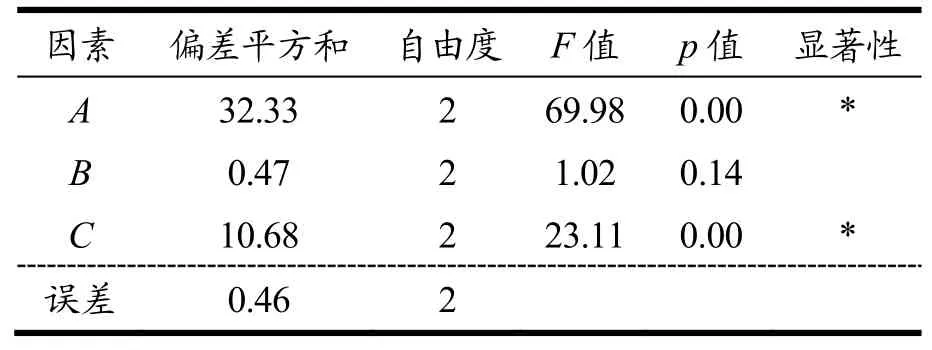
表5 正交试验方差分析Table 5 Variance analysis of orthogonal design results
在单因素试验基础上,进一步通过正交试验优化MIPs的制备条件,结果如表4、5所示。由极差分析可知,最佳试验组合是A2B2C2,各因素对MIPs吸附性能的影响由大到小为模板分子用量>致孔溶剂用量>交联剂用量。方差分析也表明,模板分子和致孔溶剂的用量对MIPs的吸附性能具有显著影响。李璐等[16]的研究表明,适量的模板分子有助于形成选择性识别位点;但模板分子过量则易产生自身结缔作用,增加非特异性识别位点。Cormack等[30]的研究表明致孔溶剂的用量不仅影响印迹效果,还影响MIPs的物理形态(如形貌状态、机械强度等)。也有学者研究表明,交联剂用量不足,会使印迹孔穴稳定性下降,特异性吸附效率降低;交联剂使用过量,会使模板分子难以洗脱,造成聚合物吸附量低[19],而本试验结果表明,交联剂用量对MIPs的吸附性能没有显著影响。这可能是由于单因素试验已把交联剂用量缩小至合适范围内,弱化了正交试验中交联剂用量对MIPs吸附性能的影响。
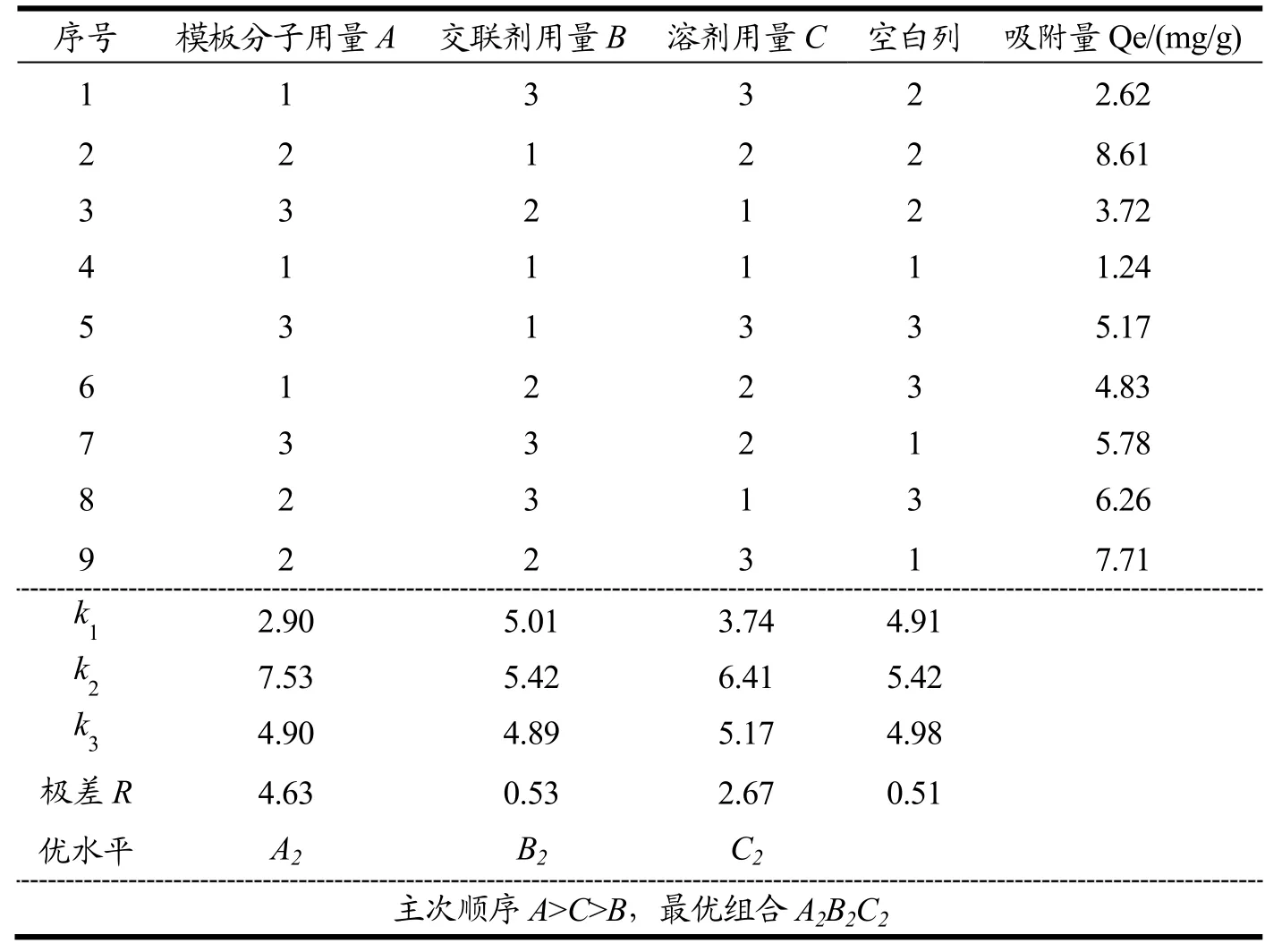
表4 正交试验方案及结果Table 4 Results of orthogonal design
2.4 MIPs的表征
2.4.1 MIPs的微观结构
MIPs和NIPs的扫描电镜如图4a和图4b所示。MIPs表面疏松多孔,而NIPs团聚现象严重。MIPs的比表面积为203.40 m2/g,孔容为0.47 cm3/g,孔径为23.11 nm;NIPs的比表面积为134.62 m2/g,孔容为0.37 cm3/g,孔径为26.59 nm。MIPs的孔径小于NIPs,但具有更大的比表面积和孔容,这使MIPs比NIPs具有更好的特异性吸附能力[31]。
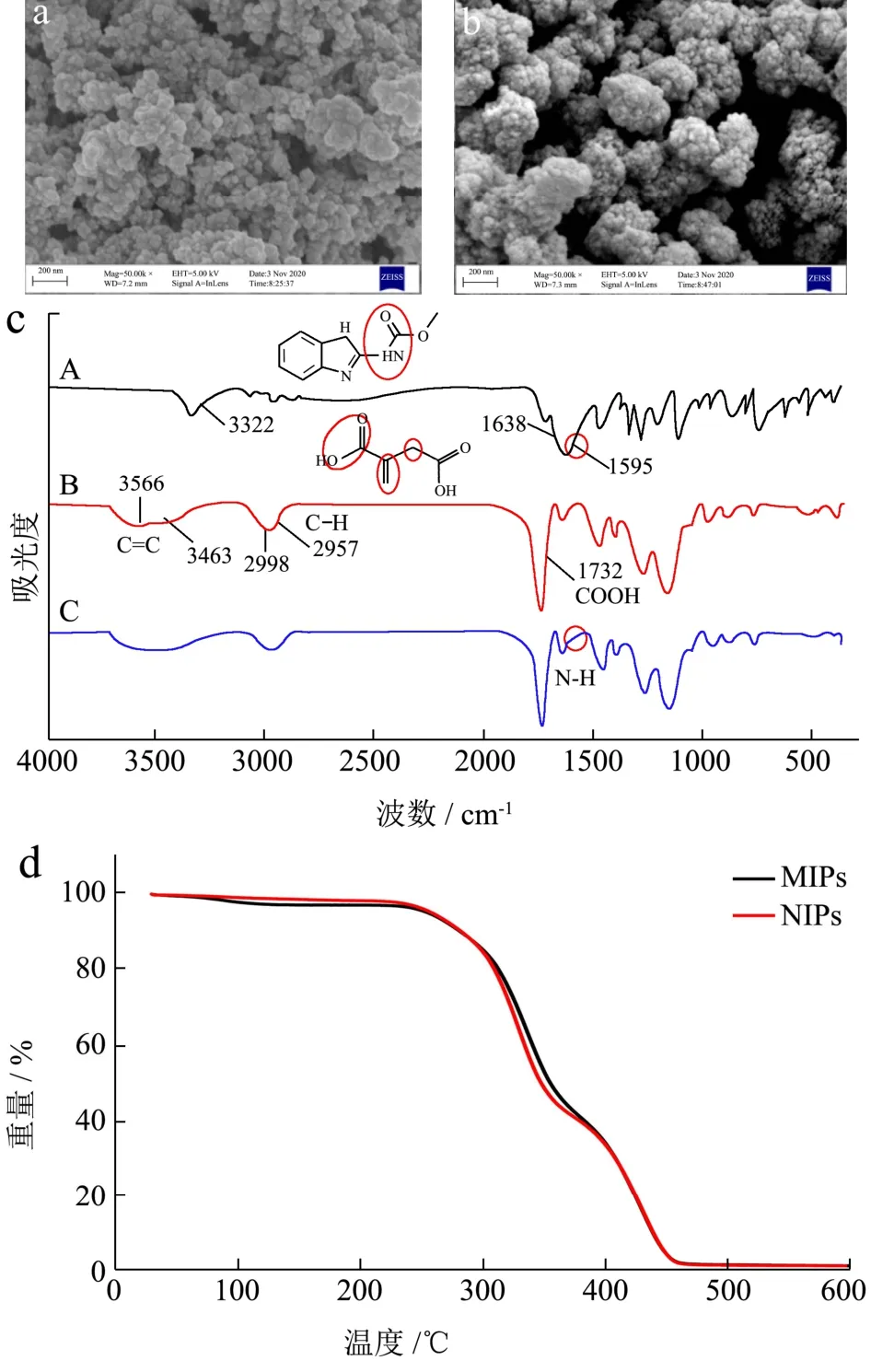
图4 聚合物的形貌表征Fig.4 Characterization of the polymers
2.4.2 傅里叶红外光谱分析
由图4c可知。CBZ中仲酰胺的特征吸收峰分别在3322、1630和1595 cm-1处。吸附CBZ后的MIPs在1595 cm-1处有仲胺-NH的伸缩振动,表明CBZ被成功吸附在MIPs上。MIPs和吸附CBZ后的MIPs的谱图上均有IA结构中3564和3453 cm-1处C=C的特征吸收峰,2990和2957 cm-1处C-H的特征吸收峰以及1730 cm-1处C=O的特征吸收峰,表明功能单体IA成功接枝在了MIPs上。
2.4.3 热重分析
由图4d可知,当温度低于240 ℃时,MIPs与NIPs没有明显的质量损失。表明MIPs有良好的热稳定性,对应用环境具有较好的耐受性。
2.5 MIPs的吸附性能
2.5.1 动态吸附实验及动力学分析
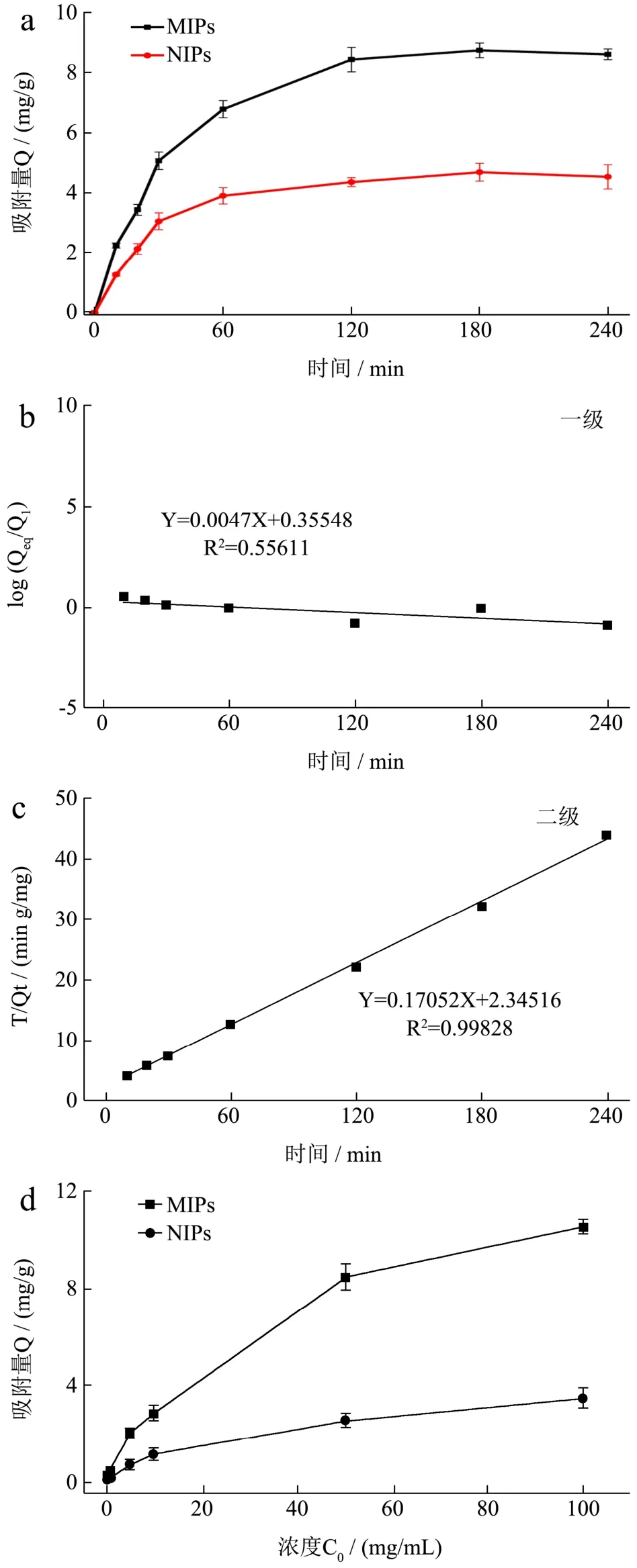
由图5a可知,MIPs对CBZ的吸附量在120 min内达到平衡。因此,后续实验中MIPs的吸附时间为120 min。静态平衡吸附量Q为8.87 mg/g,明显高于Farooq等[12]以β-环糊精作为功能单体,二甲基亚砜为致孔溶剂合成的MIPs对CBZ的吸附量3.65 mg/g以及Raif等[13]以甲基丙烯酸为功能单体,N,N-二甲基甲酰胺为致孔溶剂合成的MIPs对CBZ的吸附量2.31±0.63 mg/g。其原因可能是合成MIPs所选的功能单体和溶剂的种类及用量不同,合成的MIPs上特异性识别位点和数量上有差异,导致吸附量的明显差异。由图5b和图5c可知,准二级动力学方程的R22远高于准一级动力学方程的R12,理论吸附量分别为Q1cal=2.27 mg/g,Q2cal=8.58 mg/g。二级动力学模型的理论吸附量Q2cal更接近于实验值,说明MIPs对CBZ的吸附过程更符合二级动力学模型。
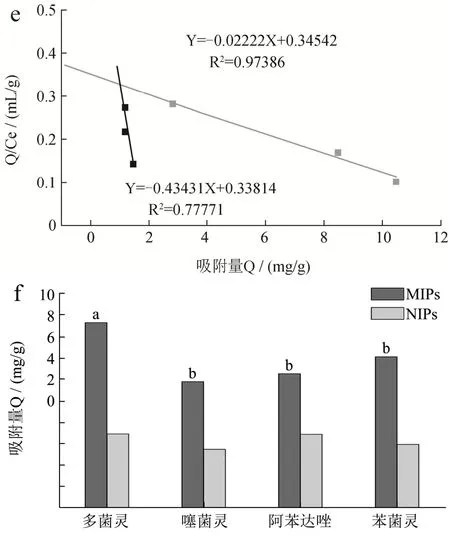
图5 聚合物的吸附性能Fig.5 Adsorption properties of polymers
2.5.2 静态吸附实验及Scatchard分析
由图5d可知,MIPs相对于NIPs对CBZ有更好的吸附性。Scatchard分析如图5e所示,Q/Ce对Q并不存在线性关系,但两端可拟合出较好的线性。有学者推测左端直线可能代表高特异性、高亲和力结合位点,右端直线可能代表低亲和力、低选择性结合位点[24]。对两端线性部分进行拟合,得到的解离常数分别为KD1=3.40 mg/L和KD2=28.60 mg/L,对应的最大表观吸附量分别为Qmax1=4.18 mg/g和Qmax2=14.00 mg/g。
2.5.3 MIPs的选择性吸附
MIPs和NIPs对所选的苯并咪唑类杀菌剂CBZ、噻菌灵、阿苯达唑和苯菌灵的静态吸附量如图5f所示。Q多菌灵=8.87 mg/g、Q噻菌灵=5.89 mg/g、Q阿苯达唑=6.26 mg/g、Q苯菌灵=7.06 mg/g。说明MIPs除了对CBZ有较高的吸附性,对苯并咪唑结构类似物也具有较好的吸附广谱性。此外,MIPs对各底物的印迹因子分别为IF多菌灵=2.89、IF噻菌灵=2.29、IF阿苯达唑=1.93、IF苯菌灵=2.59,表明对苯并咪唑类杀菌剂而言,MIPs相比于NIPs有明显的印迹效果。
2.6 MIPs的固相萃取
石斛是一种药食同源的兰科植物,其多糖含量较高,是石斛药理学活性的主要作用因子[32]。多菌灵是石斛种植过程中使用最多的农药之一[33]。因此,使用加标石斛多糖提取液作为样液,检测MIPs固相萃取柱对加标石斛多糖提取液中四种苯并咪唑类杀菌剂的脱除率以及总糖的脱除率(损失率)。结果如图6所示,MIPs固相萃取柱对四种杀菌剂均有较好的脱除效果,脱除率分别为CBZ 98.46%、噻菌灵95.03%、阿苯达唑92.10%以及苯菌灵96.31%。此外,对加标石斛多糖提取液中总糖的脱除率(损失率)为14.94%。表明MIPs作为固相萃取的吸附填料,可以有效地脱除石斛水提液中苯并咪唑类杀菌剂,而对其总糖的损失较小。
3 结论
3.1 与AMB相互作用最强的功能单体是IA,AMB与IA最适的摩尔比为1:2,对预聚体影响最小的致孔剂为乙腈。通过Gaussian软件模拟和核磁氢谱进行预聚体系筛选为MIPs合成提供科学指导,缩短了试错周期,降低了试错成本。
3.2 模板分子和致孔剂的用量对合成的MIPs的吸附性能有显著影响,合成MIPs的最佳制备条件为AMB用量1 mmol,交联剂用量20 mmol,乙腈用量50 mL。该条件下制备的MIPs吸附能力最强。
3.3 制备的MIPs动态吸附平衡时间为120 min,吸附过程符合二级动力学反应模型。对CBZ的静态平衡吸附量Q为8.87 mg/g,印迹因子IF为2.89。MIPs不仅对CBZ具有良好的特异性吸附能力,对其它苯并咪唑类杀菌剂噻菌灵、阿苯达唑和苯菌灵也具有较好的吸附广谱性。故可进一步将其作为脱除苯并咪唑类农药残留的吸附填料。
3.4 以MIPs作为填料的固相萃取柱,对加标石斛多糖提取液中四种苯并咪唑类杀菌剂具有较好的脱除效果,脱除率均达92%以上,且对多糖类活性物质影响较小(总糖损失为14.94%)。

