微小RNA-506-3p靶向SPOCK1对宫颈癌HeLa细胞增殖、凋亡的研究
代恒苹, 尤克莎, 陈典玲
(陕西省安康市妇幼保健院 产科三病区, 陕西 安康, 725000)
宫颈癌的发病率仅次于乳腺癌,是女性癌症相关死亡的重要原因[1]。近年来,虽已发现治疗宫颈癌的生物靶点,但其死亡率仍居高不下。微小RNA(miRNA)是一类与肿瘤发生发展密切相关的短链小分子非编码RNA。miR-506-3p属于miR-506-514亚群,位于X染色体,参与对细胞增殖、凋亡和迁移等生命活动的调控,影响肿瘤发生发展。研究[2]表明, miR-506在宫颈癌组织中异常低表达,通过靶向作用于hedgehog通路中Gli3转录因子,诱导细胞周期出现G1/S期阻滞,抑制细胞增殖,促进细胞凋亡。SPOCK1又叫细胞外基质蛋白多糖基因,属于钙离子结合蛋白多糖家族成员,位于人类染色体5q31位点。既往研究[3-7]表明, SPOCK1在神经胶质瘤、结肠癌、食管鳞状细胞癌、卵巢癌及肺癌等肿瘤组织中异常表达,下调其表达可抑制肿瘤细胞的增殖和转移。但SPOCK1在宫颈癌发展中的作用还不清楚。生物信息学分析显示, SPOCK1是miR-506-3p的潜在靶点。本研究检测了宫颈癌细胞中miR-506-3p和SPOCK1的表达情况,观察miR-506-3p过表达和SPOCK1抑制表达对宫颈癌细胞HeLa增殖和凋亡的影响,探究miR-506-3p对SPOCK1的靶向作用机制。
1 材料与方法
1.1 实验材料、试剂
宫颈癌细胞HeLa、Siha、Caski及正常宫颈细胞Ect1/E6E7购自中国科学院上海细胞库,聚合酶链反应(PCR)引物、miR-506-3p mimic、miR-NC、si-SPOCK1、si-NC、pcDNA、pcDNA-SPOCK1、WT-SPOCK1及MUT-SPOCK1的构建和测序由北京华大基因公司完成,蛋白质印迹(Western blot)相关试剂购自上海碧云天公司,四甲基偶氮唑蓝(MTT)试剂、Annexin V-FITC/PI凋亡检测试剂盒购于北京索莱宝公司。
1.2 细胞培养、实验分组与细胞转染
采用含有10%胎牛血清的RPMI 1640培养基对正常宫颈细胞Ect1/E6E7和宫颈癌细胞HeLa、Siha及Caski进行培养。定期观察细胞生长情况,及时更换培养液。用胰酶消化融合度约为80%细胞,进行传代培养。
将实验分为miR-506-3p mimic组(转染miR-506-3p mimic)、miR-NC组(转染miR-NC)、si-SPOCK1组(转染si-SPOCK1)、si-NC组(转染si-NC)、miR-506-3p mimic+pcDNA组(转染miR-506-3p mimic和pcDNA)和miR-506-3p mimic+pcDNA-SPOCK1组(转染miR-506-3p mimic和pcDNA-SPOCK1)。
收集对数生长期的HeLa细胞接种于6孔板(以5×105个/孔)上,细胞融合度约为60%时,室温下将各组待转染RNA与LipofectamineTM2000混合,孵育20 min后,将混合物加入HeLa细胞中摇晃混匀,无血清培养基培养6 h, 再用含血清培养基继续培养48 h, 进行后续实验分析。为进一步验证miR-506-3p是通过调控SPOCK1表达参与对宫颈癌细胞增殖和凋亡的调控,进行回补实验,把miR-506-3p mimic和pcDNA-SPOCK1同时转入HeLa细胞,观察过表达SPOCK1能否逆转miR-506-3p对宫颈癌细胞HeLa增殖和凋亡的影响。
1.3 实时荧光定量PCR(qRT-PCR)检测miR-506-3p和SPOCK1的mRNA表达水平
按照Trizol说明书分别提取正常宫颈细胞Ect1/E6E7和宫颈癌细胞HeLa、Siha及Caski总RNA, 分析其浓度、纯度后,逆转录酶合成cDNA, 随后进行qRT-PCR反应。miR-506-3p和SPOCK1mRNA的检测分别以U6和GAPDH为内参。采用2-△△Ct法计算mRNA的相对表达量。所用引物序列如下(5′-3′): miR-506-3p上游引物: ACACTCATAAGGCACCCTTC; miR-506-3p下游引物: TCTACTCAGAAGGGGAGTAC;U6上游引物: CTCGCTTCGGCAGCACA;U6下游引物: ACGCTTCACGAATTTGC;SPOCK1上游引物: CAGCCTGTCCACACAAAAGC;SPOCK1下游引物: CCATCGATT-TGGGGGTTCCA;GAPDH上游引物: GTCAACGGATTTGGTCTGTATT;GAPDH下游引物: CGCUUCACGAAUUUGCGUGUCAU。
1.4 双荧光素酶报告实验
TargetscanHuman 7.1网站(http://www.targetscan.org/vert_71/)在线预测显示miR-506-3p与SPOCK1基因的3′UTR有结合位点。构建含有或未含有miR-506-3p结合位点的野生型或突变型SPOCK1基因3′UTR的荧光素酶表达载体WT-SPOCK1、MUT-SPOCK1。按照1.2 LipofectamineTM2000转染方法将WT-SPOCK1和MUT-SPOCK1质粒分别转染到HeLa细胞,同时分别转染miR-506-3p mimic或miR-NC。用荧光素酶报告基因检测仪进行结果检测。
1.5 MTT法检测细胞增殖活力
分别取miR-506-3p mimic组、miR-NC组、si-SPOCK1组、si-NC组、miR-506-3p mimic+pcDNA组及miR-506-3p mimic+pcDNA-SPOCK1组转染成功的对数期细胞,用胰酶消化后重悬细胞,以3×103个/孔细胞数接种于96孔板中,培养24、48、72 h后按照文献[8-9]方法加入MTT试剂以检测细胞增殖活力,以空白孔调零,用酶标仪在490 nm波长处测定各孔光密度值(OD值)。
1.6 流式细胞仪检测细胞凋亡
采用适量结合缓冲液重悬各组细胞。按照Annexin V/PI试剂盒说明书,暗室内先后加入Annexin V-FITC和PI染色。使用流式细胞仪检测荧光强度。
1.7 Western blot测定蛋白表达水平
用RIPA裂解液提取正常宫颈细胞Ect1/E6E7和宫颈癌细胞HeLa、Siha、Caski以及各转染组HeLa细胞总蛋白,并测定蛋白浓度。取30 μg蛋白样品上样,进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE),并湿法转至聚偏氟乙烯(PVDF)膜。随后用Western封闭液室温封闭60 min, 吸尽封闭液后,用抗SPOCK1、GAPDH、细胞周期调节蛋白(Cyclin D1)、细胞周期蛋白激酶抑制剂(p21)、抗凋亡因子(Bcl-2)、凋亡蛋白(Bax)、活化型半胱氨酸天冬氨酸蛋白酶3(Cleaved-caspase3)和升高剪切型PARP(Cleaved-PARP)一抗4 ℃缓慢摇动孵育过夜; 用相应的二抗(1∶1 000)室温孵育2 h。ECL化学发光试剂显色后进行拍照,并用Image J软件对目的条带进行定量(以GAPDH为内参)。
1.8 数据分析
2 结 果
2.1 miR-506-3p和SPOCK1在宫颈癌细胞和正常宫颈细胞中的表达
qRT-PCR结果显示,宫颈癌细胞HeLa、Siha、Caski中miR-506-3p的表达与正常宫颈细胞Ect1/E6E7相比均降低,SPOCK1mRNA的表达与正常宫颈细胞Ect1/E6E7相比升高,差异有统计学意义(P<0.05)。Western blot结果显示,宫颈癌细胞HeLa、Siha、Caski中SPOCK1蛋白的表达与正常宫颈细胞Ect1/E6E7相比均升高(P<0.05), 差异有统计学意义。见图1、表1。

图1 宫颈癌细胞和正常宫颈细胞中SPOCK1蛋白的表达
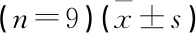
表1 miR-506-3p和SPOCK1在宫颈癌细胞和正常宫颈细胞中的表达
2.2 miR-506-3p靶向调控SPOCK1的表达
生物信息学分析(图2A)显示, miR-506-3p在SPOCK1基因3′UTR有相应结合位点。荧光素酶活性检测结果(见表2)显示,转染WT-SPOCK1后,再转染miR-506-3p mimic组的HeLa细胞的荧光素酶活性低于再转染miR-NC组,差异有统计学意义(P<0.05)。而转染MUT-SPOCK1后,再转染miR-506-3p mimic组的HeLa细胞的荧光素酶活性变化与再转染miR-NC组比较,差异无统计学意义(P>0.05), 表明SPOCK1是miR-506-3p的靶基因。
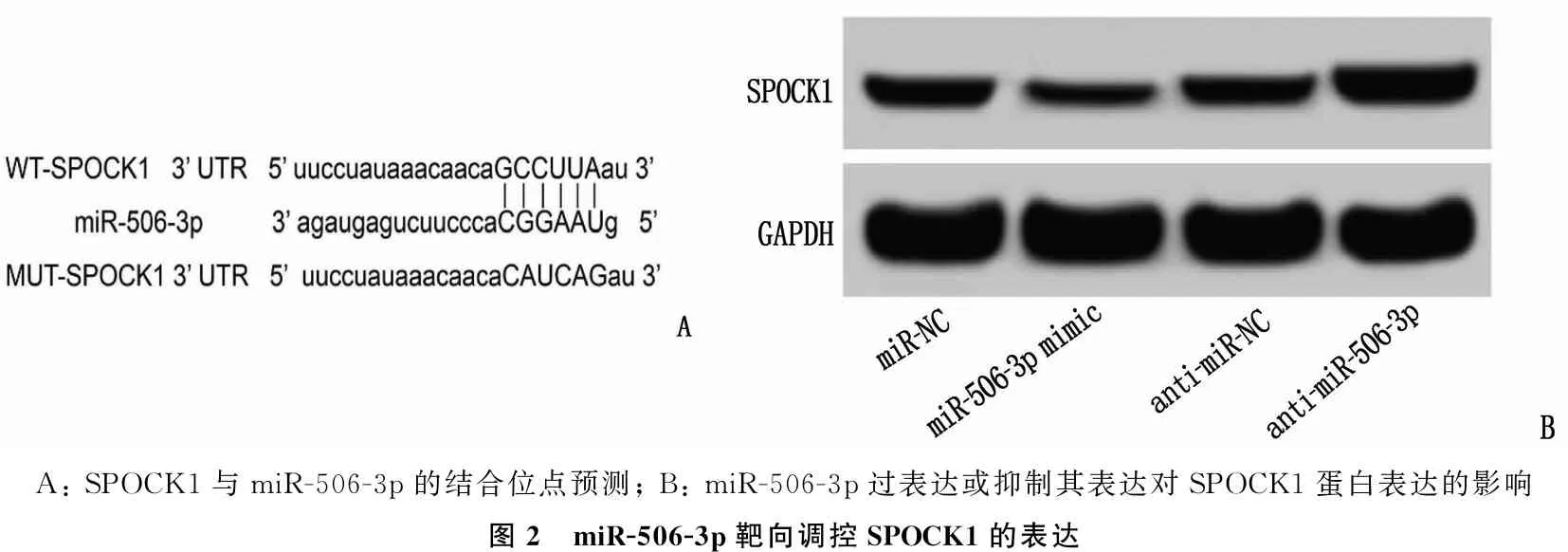
A: SPOCK1与miR-506-3p的结合位点预测; B: miR-506-3p过表达或抑制其表达对SPOCK1蛋白表达的影响图2 miR-506-3p靶向调控SPOCK1的表达
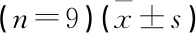
表2 双荧光素酶报告实验
Western blot检测结果(见图2B和表3)显示, miR-506-3p mimic组HeLa细胞SPOCK1蛋白表达水平低于与miR-NC组,差异有统计学意义(P<0.05); anti-miR-506-3p组HeLa细胞SPOCK1蛋白表达水平高于anti-miR-NC组,差异有统计学意义(P<0.05), 说明miR-506-3p可抑制HeLa细胞SPOCK1基因的表达。
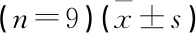
表3 miR-506-3p过表达或抑制其表达对SPOCK1蛋白表达的影响
2.3 miR-506-3p过表达对宫颈癌HeLa细胞增殖和凋亡的影响
qRT-PCR(见表4)显示,与miR-NC组相比, miR-506-3p mimic组HeLa细胞miR-506-3p的表达升高,差异有统计学意义(P<0.05), 表明成功构建了过表达miR-506-3p的HeLa细胞株。
MTT增殖实验(见表4)显示, miR-506-3p mimic组HeLa细胞在48、72 h时细胞活力低于miR-NC组,差异有统计学意义(P<0.05), 表明过表达miR-506-3p可显著抑制宫颈癌HeLa细胞增殖。
流式细胞术检测结果(见图3B和表4)显示, miR-506-3p mimic组细胞凋亡率高于miR-NC组,差异有统计学意义(P<0.05)。结果表明,过表达miR-506-3p可显著促进宫颈癌HeLa细胞的凋亡。
Western blot检测结果(见图3A和表4)显示, miR-506-3p mimic组HeLa细胞Cyclin D1和Bcl-2蛋白的表达低于miR-NC组, p21、Bax、Cleaved-caspase3和Cleaved-PARP蛋白的表达高于miR-NC组,差异有统计学意义(P<0.05)。
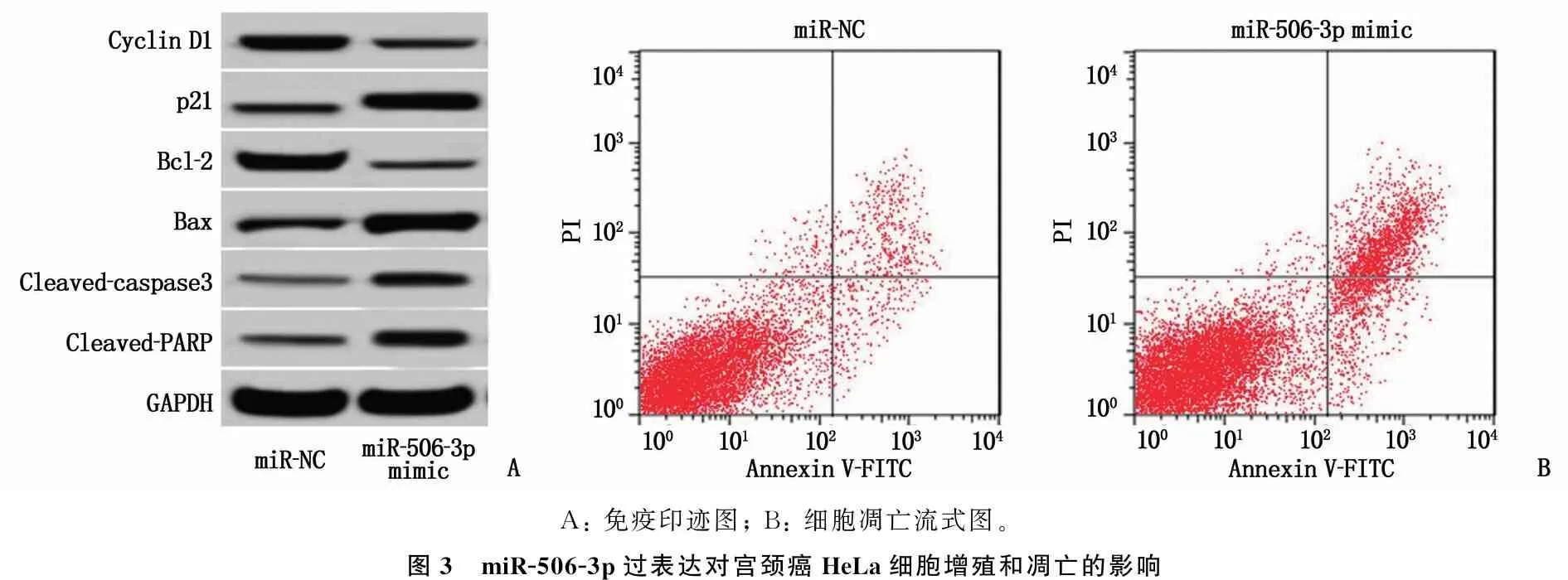
A: 免疫印迹图; B: 细胞凋亡流式图。图3 miR-506-3p过表达对宫颈癌HeLa细胞增殖和凋亡的影响
2.4 抑制SPOCK1表达对宫颈癌HeLa细胞增殖和凋亡的影响
Western blot检测(见图4、表5)显示, si-SPOCK1组HeLa细胞SPOCK1蛋白的表达低于si-NC组,差异有统计学意义(P<0.05), 表明成功构建了抑制SPOCK1表达的HeLa细胞株。si-SPOCK1组HeLa细胞CyclinD1和Bcl-2蛋白的表达低于si-NC组, p21、Bax、Cleaved-caspase3和Cleaved-PARP蛋白的表达高于si-NC组,差异有统计学意义(P<0.05)。
表4 miR-506-3p过表达对宫颈癌HeLa细胞增殖和凋亡的影响
MTT增殖实验(见表5)显示, si-SPOCK1组HeLa细胞在48、72 h时细胞活力低于si-NC组,差异有统计学意义(P<0.05), 表明抑制SPOCK1表达可显著抑制HeLa细胞增殖。
流式细胞术检测(见表5)显示, si-SPOCK1组细胞凋亡率高于si-NC组,差异有统计学意义(P<0.05)。结果表明,抑制SPOCK1表达对宫颈癌HeLa细胞具有显著促凋亡作用。
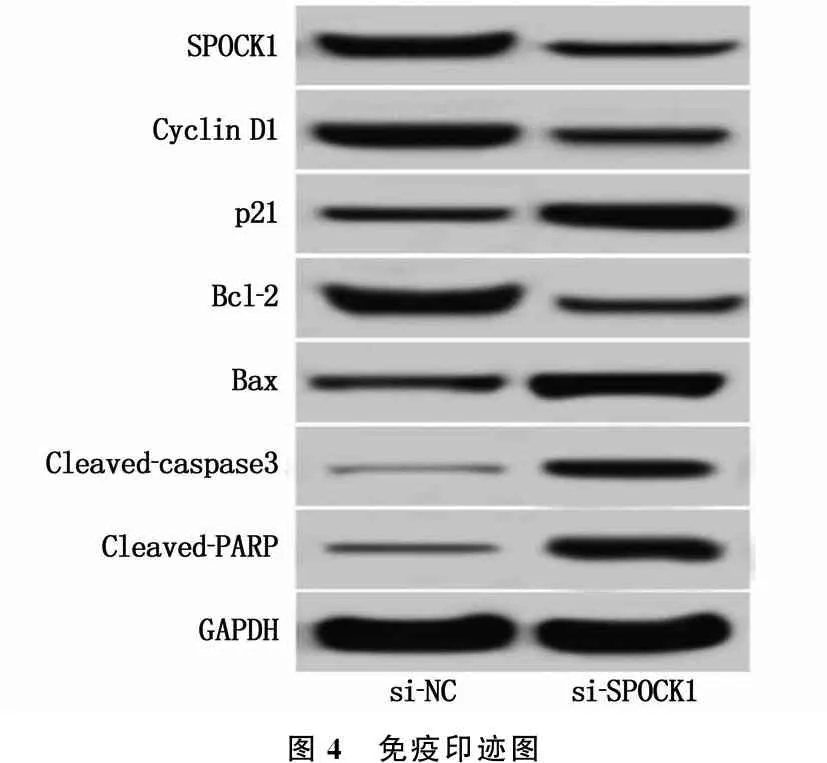
图4 免疫印迹图
表5 抑制SPOCK1表达对宫颈癌HeLa细胞增殖和凋亡的影响
2.5 SPOCK1过表达逆转miR-506-3p过表达对宫颈癌HeLa细胞增殖和凋亡的作用
Western blot检测(见图5和表6)显示,与miR-NC组相比, miR-506-3p mimic组HeLa细胞SPOCK1、Cyclin D1和Bcl-2蛋白的表达降低, p21、Bax、Cleaved-caspase3和Cleaved-PARP蛋白的表达升高,差异有统计学意义(P<0.05); 与miR-506-3p mimic+pcDNA组相比, miR-506-3p mimic+pcDNA-SPOCK1组HeLa细胞SPOCK1、Cyclin D1和Bcl-2蛋白的表达升高, p21、Bax、Cleaved-caspase3和Cleaved-PARP蛋白的表达降低,差异有统计学意义(P<0.05)。
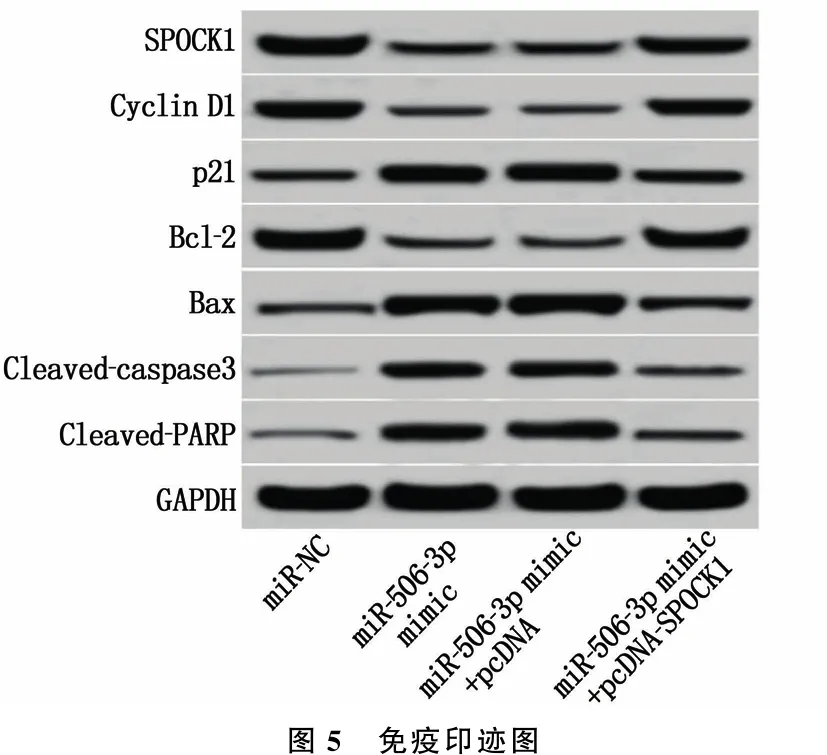
图5 免疫印迹图
MTT法检测(见表6)显示, miR-506-3p mimic组HeLa细胞在48、72 h时细胞活力低于miR-NC组,差异有统计学意义(P<0.05); miR-506-3p mimic+pcDNA-SPOCK1组HeLa细胞在48、72 h时细胞活力高于miR-506-3p mimic+pcDNA组,差异有统计学意义(P<0.05)。
流式细胞术检测(见表6)显示, miR-506-3p mimic组细胞凋亡率高于miR-NC组,差异有统计学意义(P<0.05); 而miR-506-3p mimic+pcDNA-SPOCK1组细胞凋亡率低于miR-506-3p mimic+pcDNA组,差异有统计学意义(P<0.05)。以上结果表明, SPOCK1过表达可以逆转过表达miR-506-3p对宫颈癌HeLa细胞的增殖抑制及凋亡促进作用。
3 讨 论
肿瘤细胞的恶性增殖和凋亡抵抗是肿瘤发生的重要机制。因此探讨宫颈癌细胞增殖和凋亡的内在机制,寻找遏制宫颈癌恶性发展的靶基因具有重要的意义。
miR-506-3p位于人类X染色体长臂27.3位置,细胞中miR-506-3p的异常表达与肿瘤的发生密切相关。研究[10]显示, miR-506-3p在多种肿瘤中异常低表达,通过上调其下游靶基因,可调控肿瘤细胞的增殖和凋亡等生命进程。例如, miR-506-3p可下调RAB3D的表达抑制骨肉瘤细胞MG63的增殖和转移过程。miR-506-3p还可下调LHX2的表达抑制Wnt/β-catenin信号通路,从而抑制鼻咽癌细胞的生长和转移[11]。研究[12]表明, miR-506-3p在宫颈癌中表达下调,但miR-506-3p在宫颈癌中的作用并未完全阐明。
SPOCK1是钙离子结合蛋白多糖家族成员,其参与调控细胞周期、细胞凋亡、DNA修复和转移。随着对肿瘤研究的进一步深入, SPOCK1在多种肿瘤中的重要作用引起了学者的广泛关注。SPOCK1在食管鳞状细胞癌中过表达[13]; SPOCK1与拉帕替尼耐药及胃癌复发有关[14]; 在肝癌细胞中, CHD1L可作用于SPOCK1进而激活Akt信号通路,抑制细胞凋亡,促进肿瘤转移[15]。生物信息学分析显示,SPOCK1是miR-506-3p的潜在靶基因,但SPOCK1在宫颈癌中的表达情况及miR-506-3p能否靶向作用于SPOCK1参与宫颈癌细胞的增殖和凋亡调控还不清楚。
表6 过表达SPOCK1逆转miR-506-3p过表达对宫颈癌HeLa细胞增殖和凋亡的作用
本研究检测到宫颈癌细胞中miR-506-3p表达异常下调, SPOCK1表达异常上调。这与GONG M等[12]宫颈癌中miR-506-3p低表达的结论一致。随后的双荧光素酶报告基因检测和Western blot结果证实SPOCK1表达受到miR-506-3p的靶向负性调控。用脂质体转染法上调miR-506-3p表达或RNA干扰技术抑制SPOCK1表达,均发现HeLa细胞中Cyclin D1和Bcl-2表达下降, p21和Bax表达升高,细胞增殖减弱,凋亡增加。Cyclin D1表达减少,与CDKs形成的细胞周期素蛋白激酶复合物减少,同时p21抑制复合物的活性,进一步阻碍细胞周期从G0/G1期进入S期,从而发挥抗增殖作用。促凋亡蛋白Bax表达增加,抗凋亡因子Bcl-2表达减少,促进细胞凋亡[16]。此外,上调miR-506-3p或抑制SPOCK1表达后细胞凋亡标记物Cleaved-caspase3和Cleaved-PARP表达显著升高。这与敲减SPOCK1后,前列腺癌[17]、胆囊癌[3]及膀胱癌[18]细胞增殖减弱凋亡增加现象相吻合,并可能与PI3K/Akt信号通路有关[19]。以上结果提示,在宫颈癌细胞中, miR-506-3p可通过抑制癌细胞增殖,促进其凋亡,抑制宫颈癌的进一步恶化。而SPOCK1则发挥相反的作用。把miR-506-3p mimic和pcDNA-SPOCK1共转染HeLa细胞后,发现miR-506-3p对HeLa细胞的增殖抑制和促进凋亡作用在一定程度上得到逆转。
综上所述,在宫颈癌细胞中miR-506-3p低表达, SPOCK1高表达,且miR-506-3p通过靶向下调SPOCK1的表达抑制宫颈癌细胞HeLa增殖并诱导其凋亡。这为miR-506-3p作为宫颈癌治疗靶点提供新的理论依据。

