海洋来源羽毛降解菌株的筛选、鉴定及酶学性质研究
张红岩,何 瑾,杨梦莹,张 妮,王 芳,申乃坤
(广西高校微生物与植物资源利用重点实验室、广西多糖材料与改性重点实验室、广西民族大学海洋与生物技术学院,广西 南宁 530006)
近年来,我国家禽养殖产业得到迅猛发展,2019年我国禽肉产量达2 239万t,位居世界第二[1]。羽毛为家禽屠宰副产物,可占家禽活体质量的5%~7%,我国羽毛年产量超过100万t[2]。羽毛中粗蛋白(β-角蛋白为主)的含量可达干重的85%以上,而且组成蛋白质的氨基酸种类丰富,是潜在蛋白质及氨基酸原料来源[3-4]。但β-角蛋白结构中存在大量半胱氨酸,半胱氨酸可形成二硫键,再加上所含大量疏水侧链,导致角蛋白结构比较稳定,且不溶于水,很难被动物源的蛋白酶(胃蛋白酶、胰蛋白酶)降解,需要经过进一步处理后才能被应用。因此,目前羽毛通常被填埋或焚烧[5],不仅造成蛋白资源的巨大浪费,而且环境污染严重,甚至传播疾病[6-7]。通常采用高温、高压或强酸、强碱对羽毛进行处理,不仅能耗高、环境污染严重,且降解出的氨基酸会遭到破坏,造成营养流失[8]。而利用微生物或者所分泌的角蛋白酶进行处理,不仅羽毛降解效果好、反应条件温和,且对氨基酸破坏较小,羽毛降解产物可应用于氨基酸肥料、动物饲料、生物医药等行业[9-11]。这不仅利用了废弃蛋白资源,缓解目前蛋白资源紧张问题,而且对治理羽毛类固体废弃物污染、保护环境具有积极意义。
已报道可降解羽毛的微生物有30多种,包括细菌、真菌、放线菌等[3,12]。但能够分泌角蛋白酶的真菌常常具有致病性[13],放线菌类生长缓慢[14],而可降解羽毛的细菌尤其芽孢杆菌类菌株,具有产酶活性较高、羽毛降解效果好、工业应用安全等优点,成为目前研究的热点之一[15-17]。尽管目前已筛选获得了大量可降解羽毛的菌株,但存在分泌角蛋白酶活性较低、羽毛降解效果差、菌株稳定性较差等一系列问题,通常无法满足工业化生产的要求。因此,迫切需要筛选降解羽毛效果好、角蛋白酶产量高的优良菌株。
目前挖掘新的陆生环境微生物资源越来越难,而海洋环境分布着大量待发掘的微生物资源;且海洋微生物的抗逆性更强、酶活性更高[18]。本研究从广西钦州港海鸭养殖地土壤中分离得到1株可高效降解羽毛菌株,并对其进行分类鉴定、产酶条件优化和所产酶学性质研究,以期为废弃羽毛资源的微生物降解提供海洋来源菌株和酶资源。
1 材料与方法
1.1 材料
1.1.1 土壤样品 采样自广西钦州港海鸭养殖基地淤泥,低温(4 ℃)保存至实验室进行菌株分离。
1.1.2 羽毛 收集自附近家禽市场。自来水洗净,蒸馏水冲洗后烘干至衡重。较长羽毛剪成2 cm左右小段,备用。
在数码时代的实际生活中,因为以马赛克形式的超文本存在,加上赛博格化赋予其生命,照片能够轻易地与其他媒介交互融合,社会性使用爆炸式拓宽了。里奇详细列举说:
1.1.3 试剂 酵母抽提物、蛋白胨购自Oxoid公司;PCR扩增、基因组提取及胶回收等试剂盒购自天根(北京)生物技术有限公司;酪蛋白、氯化钠等药品或试剂均为国产分析纯。
轰轰烈烈的课改一直到现在都没有停下脚步,而信息技术学科正因为本身内容的陈旧而逐渐地被整合,但无论是与其他课程的整合,还是重新确定新的内容从而焕发新的生命力,我们都需要一个正确的方向。国务院印发的《关于新一代人工智能发展规划》正如一盏指明灯,指明了信息技术学科的发展方向,更明确了推广程序教育作为新时代下的学生信息素养培养的核心内容。相信小学信息技术学科一定能在《规划》的指引下重新焕发生命力,而在新时代、新目标培养下的新一代学生更能为我们国家的可持续发展提供持久的动力。
2.3.1 产角蛋白酶最适培养温度及初始pH 由图4(a)可知,培养温度对Gxun-20产酶影响较大,酶活性随培养温度升高先增加后降低;34 ℃时,酶活性达到最大值238.47 U/mL;36 ℃时酶活性与34 ℃无显著差异(p>0.05);但进一步提高培养温度(38 ℃)时,酶活性下降明显(p<0.05)。故Gxun-20最适产酶温度为34~36 ℃。由图4(b)可知,发酵初始pH为5.5~6.5时,酶活性随着pH增加而迅速上升;pH为6.5时,酶活性达到最大值258.33 U/mL;当pH大于6.5时,酶活性迅速下降。
②已知点A(m,-2),点B(3,m-1),且直线AB∥y轴,则 A( ____ ,____)B(____ ,____ ),AB=____
1.2 方法
1.2.1 产角蛋白酶菌株筛选 ①富集:向90 mL的无菌水中加入土壤样品10 g,充分混匀后取1 mL接入50 mL富集培养基中,30 ℃摇床振荡培养2 d。②初筛:样品富集培养液用无菌水进行10倍梯度稀释,选取1×10-3、1×10-4、1×10-5稀释浓度涂布于初筛培养基平板,30 ℃恒温倒置培养48 h,挑选平板上透明圈较大的单菌落进一步纯化后保存斜面备用。③复筛:将初筛获得菌株接入种子培养基,转速200 r/min,温度30 ℃培养15 h,按照1% (体积分数)接种量加入发酵培养基,200 r/min、30 ℃发酵48 h后,测定角蛋白酶活性[4],根据酶活性大小进行菌株复筛。
2.4.2 反应pH对酶活性的影响 由图8(a)可知,酶活性随反应pH增加先升高后降低,pH为7.5时,酶活性最大为278.67 U/mL。由图8(b)可知,该酶在pH 6.0~9.0保温1 h,酶活性维持在60%以上,表明该酶pH稳定性好。
1.2.3 角蛋白粗酶液制备及酶活性测定 ①粗酶液制备:发酵结束后离心取上清,添加(NH4)2SO4盐析(饱和度至80%),12 000 r/min离心10 min,收集沉淀,用蒸馏水溶解,透析后获得粗酶液,置于4 ℃保存备用。②酶活性测定:参照文献[17]的方法进行,取上述适当稀释后粗酶液200 μL,加入300 μL质量浓度为20 g/L的酪蛋白溶液(pH 7.5)混匀,50 ℃水浴反应10 min,立即加入4 mol/L 三氯乙酸(TCA)溶液500 μL 终止反应,离心取上清液200 μL,依次加入1 mL 0.5 mol/L Na2CO3溶液和200 μL福林酚,50 ℃反应10 min。对照为先用TCA对酶灭活的酶液。反应结束后于波长660 nm 处检测吸光值。酶活性单位(U)定义为:反应温度为50 ℃条件下,每分钟水解酪蛋白产生1 μg酪氨酸所需的酶量[21]。
1.2.4 产角蛋白酶培养基及培养条件优化 ①培养温度:接种后置于温度分别为30、32、34、36、38 ℃的摇床,转速150 r/min,培养48 h后测定酶活性,确定产酶最适温度。②发酵初始pH:分别调整培养基初始pH为5.5、6.0、6.5、7.0、7.5,根据酶活性确定菌株产酶最适pH。③羽毛含量:分别添加0.5%、1.0%、1.5%、2.0%、2.5%、3.0%(质量分数)羽毛,根据酶活性高低确定菌株产酶最适羽毛含量。
初步检出文献672篇,Note-Express软件剔重后浏览文题和摘要获得与本研究相关文献49篇,阅读全文,按照纳入及排除标准严格筛查,最终获得27篇文献[1-27],经质量评价,27篇文献虽均未阐明研究的哲学基础及研究者对研究的影响,但考虑其他方面评价较好,故将其全部纳入研究。文献筛选流程及结果见图1,纳入研究的基本特征见表1。纳入研究的质量评价见表2。
1.2.5 角蛋白酶粗酶液的酶学性质 ①最适反应温度。反应温度设置为:20、30、40、50、60、70、80、90 ℃,测定反应温度对酶活性影响,确定酶反应的最适反应温度。②热稳定性[22]:将粗酶液分别置于不同的温度(30、40、50、60、70、80 ℃)下保温30 min后,测定残余酶活性。对照组未进行温度处理,活性设为100%。不同温度处理后酶活与对照酶活性的百分比为相对酶活性,考察温度对酶活性的影响。③最适pH值。在最适反应温度下,配制不同pH缓冲液(6.0~9.0)、磷酸盐缓冲液pH 6.0~7.5、Tris-HCl缓冲液pH 7.5~9.0。测定粗酶液在不同pH缓冲液中的酶活性,确定酶反应的最适pH。④酶的pH稳定性。将酶在最适反应温度下,不同pH缓冲体系中保温1 h,测定残留酶活性,分析酶的pH稳定性。⑤金属离子对酶活性影响。在酶反应体系中添加终浓度为5.0 mmol/L的金属离子(Na+、Ca2+、K+、Mg2+、Cu2+、Mn2+、Co2+),放置60 min(室温)后测定残余酶活性。以等体积无菌水处理的酶液为对照(酶活性定为100%),不同金属离子处理后酶活性与对照酶活性的百分比为相对酶活性,考察金属离子对酶活性的影响。⑥化学试剂对酶活性影响[23]。粗酶液中分别加入终浓度为5 mmol/L的蛋白酶抑制剂苯甲基磺酰氟(pheny methyl sulfonyl fluoride,PMSF)、金属螯合剂乙二胺四乙酸(ethylene diaminetetra acetic acid,EDTA)、还原剂β-巯基乙醇、1%(体积分数)的表面活性剂十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、吐温40 (Tween 40)、有机溶剂二甲基亚砜(dimethyl sulfoxide,DMSO),常温下处理60 min,测定残余酶活性。以等体积无菌水的处理酶液为对照(酶活性大小定为100%),考察化学试剂对酶活性的影响。⑦酶底物特异性。添加相同含量的羽毛、可溶性角蛋白、I型胶原蛋白、酪蛋白、人发、牛血清蛋白,根据酶活性高低确定酶的底物特异性。
2 结果与讨论
2.1 羽毛降解菌株的分离筛选
根据初筛平板上菌落水解圈直径及菌落直径的比值(R1/R2)大小,发酵复筛后排重,筛选获得降解羽毛较好的菌株3株,菌株在初筛平板透明圈效果见图1,羽毛降解效果及酶活性结果见表1。编号20的菌株生长速度快、降解羽毛效果好,角蛋白酶酶活性最高,达152.37 U/mL。因此,选用此菌株进行下一步研究,命名为Gxun-20。

图1 3株菌的酪蛋白水解圈Fig.1 Hydrolysate circles produced by 3 strains against casein
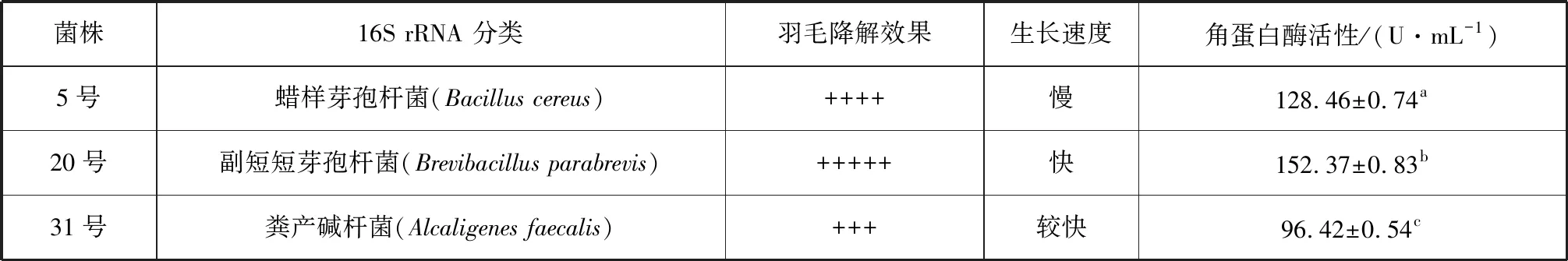
表1 3株菌的复筛结果Tab.1 Rescreening result of 3 strains
2.2 菌种鉴定
2.2.1 形态学、生理生化特征 Gxun-20菌株在酪蛋白平板菌落颜色呈白色,表面干燥,不易挑取,边缘锯齿状[图2(a)]。菌体呈短杆状,革兰氏染色阳性(G+),可产芽孢[图2(b)]。生理生化性状为:好氧;硝酸盐还原、接触酶、酪蛋白和明胶水解均呈阳性;而V-P(Voges-Proskauer)、淀粉水解呈阴性;可利用常见糖类如蔗糖、麦芽糖、葡萄糖、甘露醇产酸,但无法利用木糖和阿拉伯糖为唯一碳源生长;生长pH范围为5.5~9.0。
2.4.1 反应温度对酶活性的影响 酶的反应温度-酶活性关系如图7(a)所示,温度为20 ℃时,酶活性仅为45.64 U/mL;随着反应温度升高,酶活性逐渐增加,50 ℃时酶活性为254.49 U/mL,达到最大值;但当高于50 ℃时,酶活性迅速降低。这表明该酶最适反应温度为50 ℃。热稳定结果[图7(b)]表明,当温度为60 ℃时,处理30 min后,酶活性保持在70%以上;但80 ℃处理后酶活性仅存不到10%。因此,该角蛋白酶在温度低于60 ℃时,具较好的热稳定性。
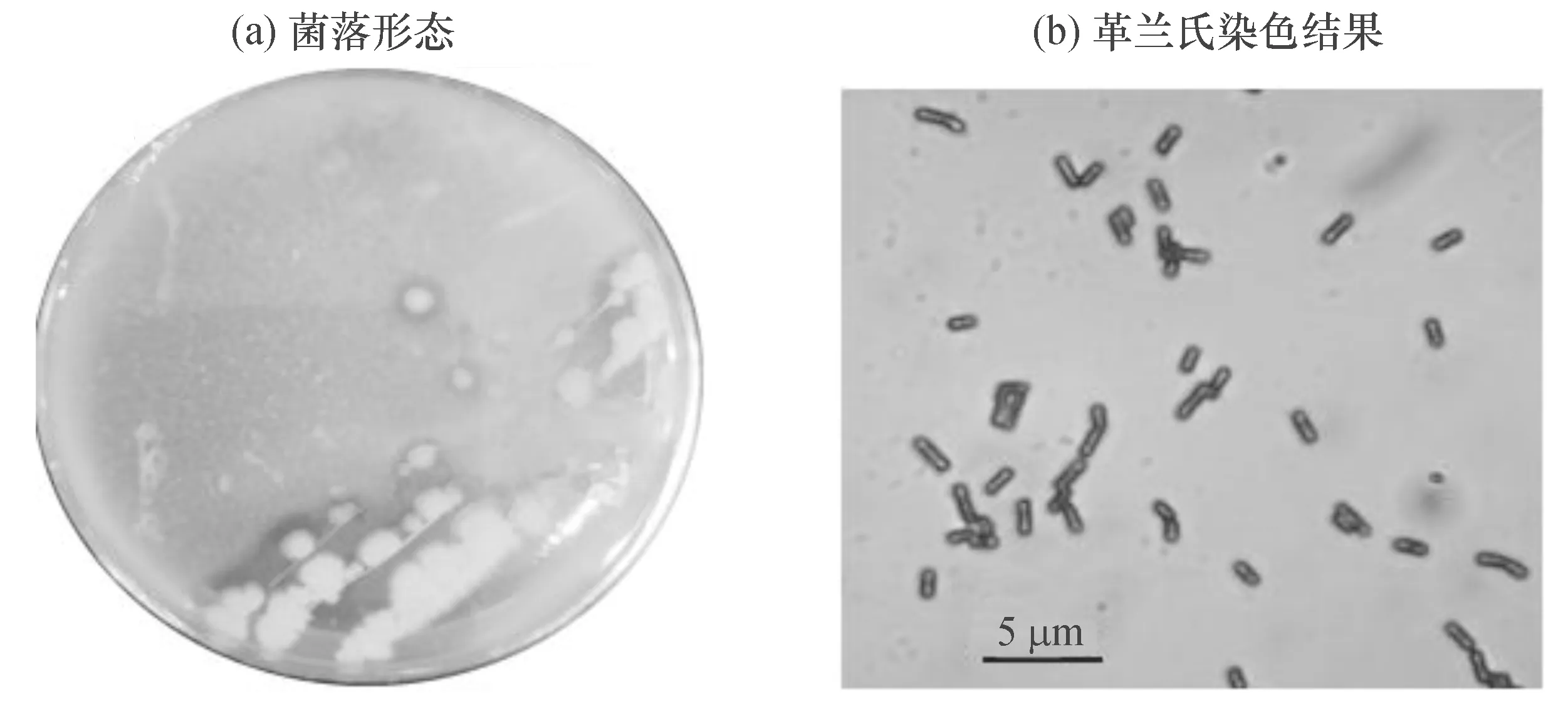
图2 Gxun-20菌株的菌落形态及革兰氏染色结果Fig.2 Colony morphology and Gram stain of strain Gxun-20
2.2.2 16S rRNA基因序列及系统发育分析 菌株的16S rRNA基因序列测序后,提交至EzBioCloud数据库进行相似性比对。结果显示:Gxun-20与副短短芽孢杆菌BrevibacillusparabrevisNRRL NRS 605T亲缘关系最近(99.82%),在构建的系统发育树中自然聚类(图3)。根据菌株形态、生理生化及16S rRNA系统发育树比对结果,命名其为(Brevibacillusparabrevis)Gxun-20,现保藏于广东省微生物菌种保藏中心(GDMCC 60686)。
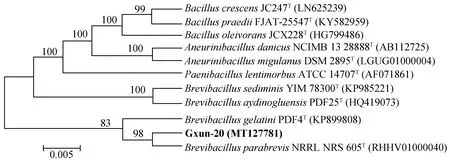
图3 菌株Gxun-20 16S rRNA基因序列系统发育树Fig.3 Phylogenetic tree of strain Gxun-20 based on 16S rRNA gene sequence注:“T”表示模式菌株;各分支点显示的数字代表通过1 000次重复运算得到的bootstrap值;标尺表示核苷酸替换率。
2.3 菌株产角蛋白酶培养条件优化
1.1.5 仪器与设备 包括普通光学显微镜(奥林巴斯公司)、紫外可见光分光光度计(上海精密科学仪器有限公司)、高速冷冻离心机[赛默飞世尔科技(中国)有限公司]、振荡培养箱(上海旻泉仪器有限公司)、PCR扩增仪(ABI公司)等。
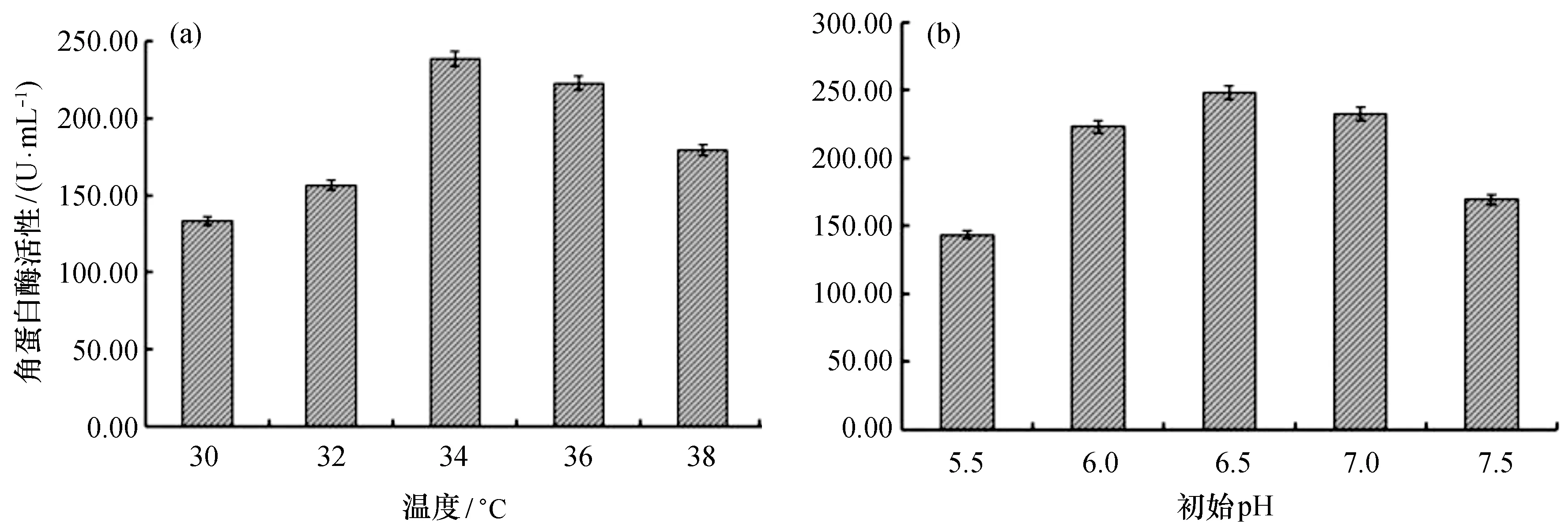
图4 发酵温度及初始pH对菌株Gxun-20产角蛋白酶的影响Fig.4 Effects of fermentation temperature and initial pH on keratinase production of strain Gxun-20
2.3.2 羽毛含量对产角蛋白酶活性的影响 从图5可知,当羽毛含量小于15 g/L时,酶活性随含量增加而增加,15 g/L时酶活性最大为277.45 U/mL;当羽毛含量高于15 g/L时,酶活性随羽毛含量的增加反而降低。
列车通过桥梁时,对桥梁产生的动力效应往往会大于其静止作用在桥上所产生的静力效应。这种增大效应通常以动力系数来表示,动力系数[11] 。
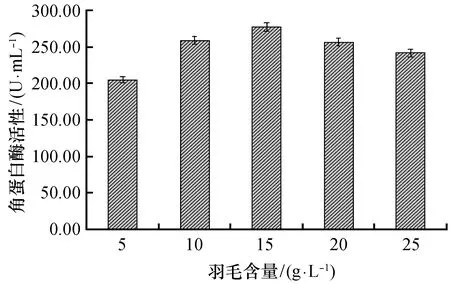
图5 羽毛含量对菌株Gxun-20产角蛋白酶活性的影响Fig.5 Effect of feather content on keratinase production of strain Gxun-20
因此,菌株Gxun-20产酶的最适条件为:发酵温度34 ℃,初始pH 6.5,羽毛含量15 g/L,接种发酵48 h可将羽毛几乎完全降解(图6),羽毛降解率达90.13%。
1.1.4 培养基 富集培养基(g/L):羽毛5.0,酵母粉5.0,K2HPO41.0,NaCl 2.0,MgSO40.1。初筛培养基(g/L):酪蛋白30.0,MgSO40.1,NaCl 5.0,KH2PO40.7,K2HPO41.4,琼脂20.0。种子培养基:LB培养基[3]。发酵培养基(g/L):羽毛15.0,MgSO40.1,NaCl 5.0,KH2PO40.7,K2HPO41.4。培养基配制均用去离子水,初始pH为7.2。
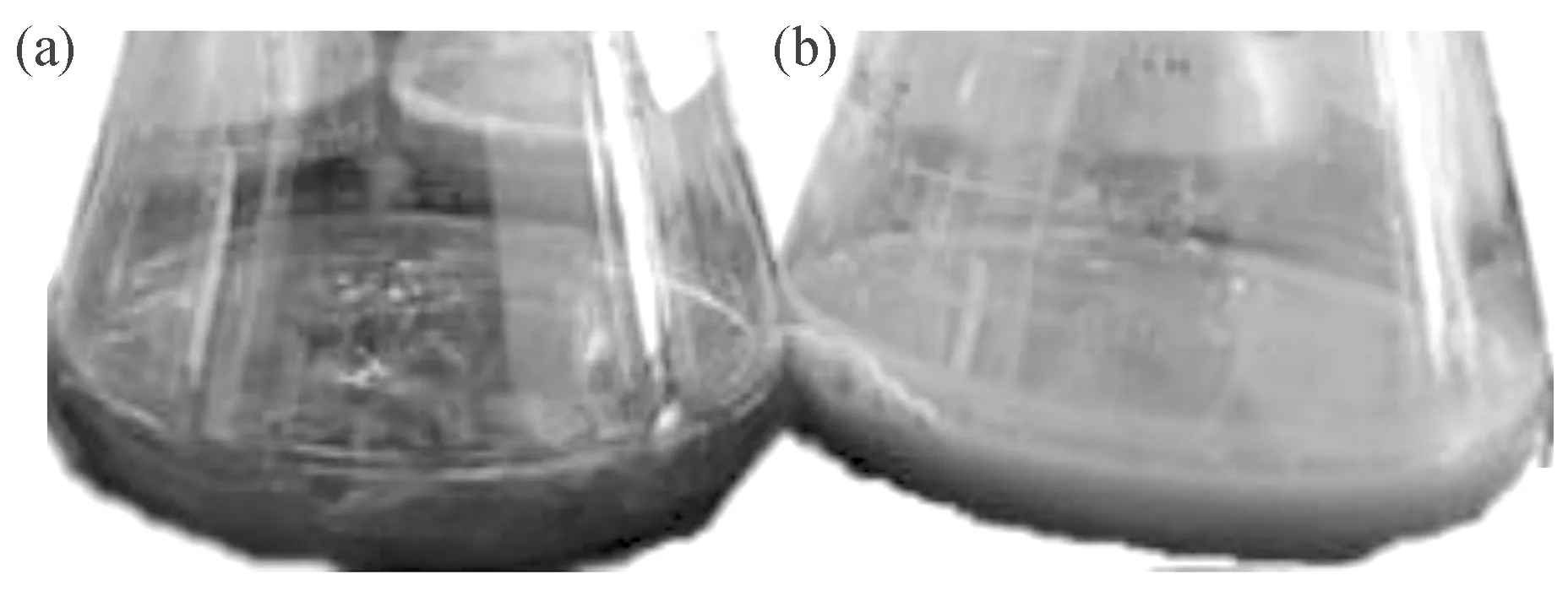
图6 菌株Gxun-20于34 ℃摇瓶发酵48 h对羽毛的降解效果Fig.6 Degradation of feathers by strain Gxun-20 in flask culture at 34℃ for 48 h(a)为降解前,(b)为降解后。
2.4 菌株Gxun-20产角蛋白酶粗酶液的酶学性质
通过压力曲线(见表4)可以看出,前面挤注时,立压与套压压差较大,通过间歇挤注承压,压差逐渐变小,地层承压能力逐渐提升,最后承压到立压2.5MPa,套压2.5MPa,稳压1.5h不降,折合垂深2070m当量密度达 1.92g·cm-3,在全井密度 1.52g·cm-3的基础上提高了当量密度0.4g·cm-3。
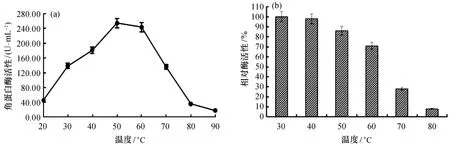
图7 温度对酶活性及热稳定性的影响Fig.7 Effects of temperature on activity and thermostablity of keratinase
1.2.2 菌株鉴定方法 ①形态学及生理生化鉴定:参考《常见细菌系统鉴定手册》[19]。②分子鉴定:用通用引物27F和1492R对菌株16S rRNA基因进行PCR扩增、测序[20],测序结果提交至GenBank进行比对,再采用Neighbor-Joining法构建系统进化树[11]。
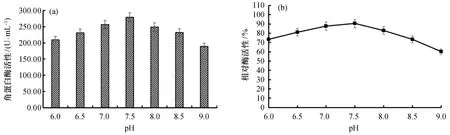
图8 反应pH对角蛋白酶活性及稳定性的影响Fig.8 Effects of pH on activity and stability of keratinase
2.4.3 金属离子对酶活性的影响 由表2可知:K+、Sr2+和Mg2+对酶活性影响较小;Na+和Ca2+对酶活性有明显促进作用,相对酶活性分别达135.99%和118.20%;Fe3+、Cu2+、Co2+、Fe2+和Mn2+对酶活性有显著抑制作用。
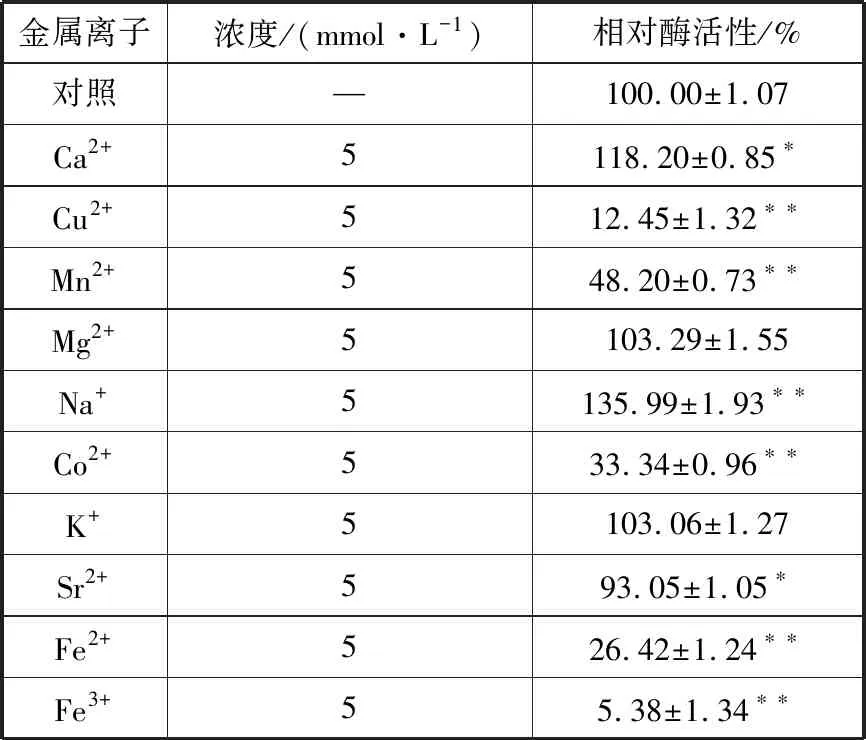
表2 金属离子对角蛋白酶活性的影响Tab.2 Effects of metal ions on keratinase activity
2.4.4 化学试剂及底物对酶活性的影响 从图9(a)可知:化学试剂对酶活性影响较大,PMSF可完全抑制酶活性,说明酶的活性中心含有丝氨酸;EDTA对酶活性抑制作用同样明显,说明酶的活性中心可能含有某些金属离子;酶在DMSO、SDS、吐温40溶液中保持稳定。底物特异性结果[图9(b)]表明,该酶的底物特异性较强,对羽毛、角蛋白和酪蛋白的降解作用最为明显;对人发和I型胶原蛋白的降解能力较差。
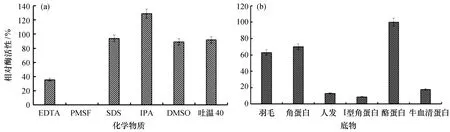
图9 化学试剂及底物对角蛋白酶活性的影响Fig.9 Effects of different chemicals and substrates on keratinase activityEDTA为乙二胺四乙酸,PMSF为苯甲基磺酰氟,SDS为十二烷基硫酸钠,IPA为异丙醇,DMSO为二甲基亚砜。
2.5 讨论
与陆生环境微生物相比,海洋微生物由于适应了高盐、高压、低温、缺氧等环境,往往具有更高的生物学活性、更强的抗逆性[17]。本研究从广西北部湾海洋环境筛选出的1株可高效降解羽毛的副短短芽孢杆菌,其生理生化特性基本符合《常见细菌系统鉴定手册》[19]对于该种菌株的描述,但与模式菌株不同的是该菌株可以在2%NaCl溶液中正常生长,可能是该菌株筛选自海洋环境,进化过程中适应了高盐度海洋环境所致。目前,已报道的降解羽毛的菌株多数筛选自陆源环境,源自海洋的羽毛降解菌株较少。
目前,根据文献报道,多数芽孢杆菌类菌株最适产酶温度为30~37 ℃,最适初始pH为5.5~7.0[6-7]。这与本研究结果类似,说明中性偏酸的环境对菌株产酶有利,可能与弱酸性条件有利于羽毛空间结构的破坏以及微生物的生长和酶的诱导[15]有关。但多数文献报道菌株产酶的最适羽毛含量为1.0%,而菌株Gxun-20产酶最适羽毛含量为1.5%,说明菌株Gxun-20更能适应较高底物含量,具有更强的降解能力,但当底物含量进一步升高时,酶活性反而下降,原因可能是羽毛含量过高会影响料液比,使发酵液变得粘稠影响了溶氧,从而不利于菌体生长和产酶[22]。条件优化后,菌株Gxun-20经过48 h发酵,可将整根羽毛几乎完全降解,降解率可达90.13%,酶活性可达277.45 U/mL。远高于Streptomycessp.DJ(发酵10 d,降解率为50%)[5]、BacillussubtilisBS8(发酵48 h,酶活性为23.6 U/mL)[11]、BacilluslicheniformisRPk(酶活性为50 U/mL)[24]等菌株的降解能力,说明该菌株在降解羽毛类角蛋白资源方面具有良好的应用潜力。
调整因素作用影响监控能力的关键因素之一主要建立在反思因素基础之上,只有学生进行了相应的反思,从而对学习策略学习方法进行及时的调整.
菌株Gxun-20所产角蛋白酶的最适反应温度为55 ℃,与B.amyloliquefaciens[24]和B.subtilis[25]所产角蛋白酶最适温度相同,但低于文献报道Bacilluscereus所产角蛋白酶的最适温度60 ℃[26]。酶的热稳定性较好,60 ℃处理30 min,相对酶活性保持在70%以上,优于文献报道的60 ℃处理30 min后角蛋白相对酶活性低于50%[3,15];但当处理温度为80 ℃时,酶活性基本丧失,可能是由于高温破坏了维持蛋白质空间结构的化学键,进而破坏了酶的活性中心[27]。该酶在pH 6.0~9.0时稳定性好,最适反应pH为7.5,与B.amyloliquefaciens(pH 8.0)[24]、B.subtilus(pH 7.5)[25]和B.cereus(pH 8.0)[26]所产的酶类似。pH过高或过低时,酶活性迅速下降,可能是过高或过低的pH会破坏酶的结构和稳定性,或者影响了酶与底物结合,进而影响了酶的活性[9],pH的具体影响机制有待进一步研究。金属离子对酶活性影响较大,其中Ca2+或Na+对酶活性有激活作用,原因可能是由于酶分子中氨基酸侧链的O2-与Ca2+或Na+可形成稳定的共价键,增强了酶活性中心的的稳定性;或“底物-角蛋白酶”形成的复合体由于Ca2+或Na+存在稳定性得到进一步加强,从而使酶的活性升高[17,28];而Fe3+、Cu2+、Co2+、Fe2+和Mn2+对酶活性有显著抑制作用,可能是因为此类金属离子可与酶蛋白氨基酸分子中的-SH基结合,从而影响酶分子二硫键的形成,使酶的结构发生改变,进而导致酶分子失活或变性[29]。化学试剂中EDTA对酶活性有强烈抑制作用,说明酶的活性中心可能含有某些金属离子[30],与之前Ca2+、Na+可显著促进酶活性结果一致;PMSF可完全抑制酶的活性,可说明该酶可能为含有金属离子的丝氨酸蛋白酶类,与文献报道常见角蛋白酶的活性结构类似[9]。但异丙醇对该酶活有激活作用,这与文献报道异丙醇对角蛋白酶有强烈抑制作用[16-17]不同,具体机制有待进一步研究。该酶无法降解人发和I型胶原蛋白,这与B.licheniformis、B.subtilus所产角蛋白酶可降解胶原蛋白的结果不同[31],说明该酶在研发不伤皮肤的洗涤及化妆品等方面具有良好的应用前景。
3 结论
本研究从广西北部湾海鸭养殖淤泥筛选获得1株高效降解废弃羽毛的菌株,鉴定为副短短芽孢杆菌(Brevibacillusparabrevis)Gxun-20。菌株最适产酶条件为:发酵温度34 ℃,初始pH 6.5,羽毛含量1.5%,在此条件下发酵48 h,角蛋白酶活性可达277.45 U/mL。所产角蛋白酶粗酶性质为:最适反应温度50 ℃,最适pH 7.5;低于60 ℃酶活性保持稳定,Ca2+、Na+对酶活性有激活作用,而Fe3+、Cu2+、Co2+、Fe2+和Mn2+对酶活性有显著抑制作用;金属螯合剂EDTA和蛋白酶抑制剂PMSF可显著抑制酶活性;有机溶剂异丙醇对酶活性有激活作用,相对酶活性达129.34%;酶的底物特异性较强,对羽毛类β-角蛋白及酪蛋白降解能力较强,而对牛血清蛋白、I型胶原及人发类α-角蛋白降解能力较弱。因此,海洋来源的副短短芽孢杆菌Gxun-20及其所产角蛋白酶在废弃羽毛降解方面具有良好的应用前景。

