深海来源芳烃类降解菌筛选与盐单胞菌芘降解能力测定
李振宇,尹华群,邵宗泽,王万鹏*
(1.中南大学资源加工与生物工程学院,湖南 长沙410012;2.自然资源部第三海洋研究所,海洋生物遗传资源重点实验室,福建 厦门361005)
石油是工业的血脉,但泄漏的石油对特定环境而言往往意味着极大的危害[1]。当石油烃侵入海洋环境时,海面上会形成一层不均匀的薄膜,该膜会扰乱正常的海洋大气、能量和水交换,抑制光合作用[2],进入食物链的烃更对海洋生物造成持续的毒性影响[3-5],并进一步危害人类健康。尽管海洋表层的一部分石油烃可以通过蒸发、光化学效应、微生物分解等一系列物理、化学和生物过程进入大气,但大部分仍以溶解组分或相应降解组分的形式存在于海洋环境中,它们中的一些组分还通过吸附、絮凝、沉淀等作用进入沉积物,在深海形成石油烃的聚集体[6-7]。PAHs是石油烃的主要有害成分,不仅具有极强的致癌、致畸和致突变作用,对人类健康存在巨大威胁[8],它们复杂而稳定的芳香结构、高共振能量和有限的生物利用度使它们具有化学稳定性和抗微生物降解的能力[9]。在海平面2 000 m以下的海洋环境中,黑暗、高压、高盐、低氧和低温营造了独特的生态环境,与陆地和淡水环境相比,从深海环境中能够发现并获得更多的新型石油烃降解功能菌株,有力推动烃降解基础理论研究和微生物环境修复应用前行。
近年来嗜盐菌大量应用于污水类生物修复,嗜盐菌降解烃的研究也引起广泛关注。盐单胞菌属(Halomonas)是嗜盐菌的重要组成部分,属于革兰氏阴性菌,迄今发现有一百多个种,种群庞大,功能多样。其中一部分种类被认为在生物修复技术中具有潜在应用价值,因为它们具有产生水溶性的细胞外多糖、乳化剂或氧化酶的能力,它们是自然界降解污染物(芳香族化合物)的重要组成,如变异盐单胞菌HalomonasvariabilisW10[10]、盐单胞菌HalomonasanticariensisFP35[11]、沙漠盐单胞菌HalomonasdesertisG11[12]、盐单胞菌Halomonassp.KHS3[13]和Halomonassp.TG39a[14]等,但鲜有关于盐单胞菌株厌氧烃降解功能的报道。厌氧烃降解菌在环境污染生物修复中有重要的应用前景,因为很多油污染土壤与废水是厌氧环境。虽然其在油污治理过程中有特殊的应用价值,但对厌氧烃降解菌的研究相对较少。深海沉积物往往是厌氧的寡营养环境,但多环芳烃等难降解有机物随“海雪”及颗粒沉积进入深海沉积物,也为微生物生长提供了难得的碳源与能源[15]。因此,本研究从太平洋沉积物中选取深层沉积物,进行厌氧烃富集:以混合PAHs为唯一碳源,在避光、高盐、20 ℃,常压下静置培养;通过传代培养,分析其中烃代谢群落的变化,以期分离出高效新型的烃降解功能菌株。
本研究主要采用厌氧培养方法,结合高通量测序技术,以期揭示深海沉积物经厌氧PAHs富集后的主要细菌群落组成,并对深海来源的厌氧烃降解菌群进一步了解。通过分离纯化获得群落中的烃降解菌株PA16-9,基于16S rRNA的系统发育分析表明该菌归属于泰坦尼克盐单胞菌(Halomonastitanicae)。已知该菌属具有好氧降解单环芳烃和萘的能力,但没有相关报道其厌氧降解高分子量多环芳烃(HMW-PAHs)能力。
1 材料和方法
1.1 沉积物样品来源
本实验采用由“向阳红03”号科考船2017年执行环球科考任务期间,在多个太平洋站点(表1)经电视抓斗采样器采集的深海沉积物,沉积物为黄褐色,无味,弱黏性,表层呈半流动状,手搓略有粉砂感,向下稠度增加,10 cm以下富含黄白色团块混杂。沉积物样品经无菌收集后,于低温保存运送至实验室进行下一阶段研究。
1.2 厌氧富集
采用基础盐培养基(MSM)进行富集,通过盐度调整模拟海水环境,成分组成包括:氯化铵0.33 g/L,硝酸钠0.88 g/L,氯化钾0.5 g/L,无水氯化钙0.5 g/L,氯化镁(7H2O)3.0 g/L,氯化钠22.0 g/L,无水硫酸钠3.0 g/L,PIPEs(哌嗪-1,4-二乙磺酸)缓冲液5.0 g/L,培养基中加入1 mL/L的刃天青溶液(1.0 g/L)作为氧气指示剂,pH调至6.8,培养基清澈不浑浊;另配置常用的微量元素溶液、维生素溶液和5%的磷酸盐溶液,过滤除菌备用。选用二甲基亚砜(DSMO)溶解PAHs配置成碳源母液,过滤除菌备用。
取150 mL规格厌氧瓶,洗净后加入100 mL基础盐培养基,通纯氮气除去残余空间的氧气。胶塞封口加铝盖,121 ℃高温灭菌20 min,待体系冷却至室温后,在超净工作台通过注射器补加微量元素溶液、维生素溶液、磷酸盐溶液和碳源(混合芳烃及烷烃)等(表1)。取出前述沉积物样品,按比例(1∶100)使无菌MSM溶液与沉积物样品形成浊液,通过注射器注入密封的厌氧培养基中。室温下避光静置培养4周后,进行稀释,抽取富集物添加到新的培养基中(1∶10)。
除氧:将培养基配置完毕,添加氧气指示剂刃天青,原无色培养基显蓝色。加热培养基至沸腾,导气管伸入液面下,通纯氮气除去瓶中氧气,同时添加半胱氨酸盐酸盐或硫化钠,除去液体中残余的氧气。通气约10 min左右,另取一导气管置于空培育瓶中通氮气(约1 min),目的是排尽瓶中氧气。采用移液器深入培养基深层移取培养基至空培养瓶中,随后加盖橡胶塞的过程中抽出导气管,最后加盖铝盖。移液分装的过程中应保持培养基处于通气除氧的状态。全部分装完毕后,121 ℃下灭菌20 min,培养基呈现无色状态,表示培养瓶中为无氧环境。若实验中厌氧瓶重新进氧,则培养基呈现粉红色,可通过添加少量半胱氨酸盐酸盐溶液进行除氧。
1.3 富集菌群的DNA提取、高通量测序和细菌多样性分析
对深海沉积物样品采用合理的厌氧富集策略,获得厌氧富集物,用0.22 μm的滤膜过滤收集菌体,采用美国MO BIO公司的水样基因组提取试剂盒(14900-100-NF,PowerWater® DNA 分离试剂盒)提取样品总DNA,在1%浓度的琼脂糖凝胶电泳下检测到明亮DNA条带,并通过Nanodrop 2000超微量分光光度计检测DNA浓度,-80 ℃保存。采用细菌引物338F:5’-ACTCCTACGGGAGGCAGCAG-3’;806R:5’-GGACTACHVGGGTWTCTAAT-3’,PCR扩增16S rRNA的V3~V4区。
使用NEXTFLEX® Rapid DNA-Seq试剂盒建库,然后接头连接,使用磁珠筛选去除接头自连片段,利用PCR扩增进行文库模板的富集,磁珠回收PCR产物得到最终的文库,采用Illumina公司的Miseq PE300平台测序(上海美吉生物医药科技有限公司)。将原始数据拼接、过滤,对其作标准均一化处理和多样性分析[16]:基于有效数据将相似性达97%的序列进行操作分类单元(operational taxonomic unit,OTU)聚类。采用RDP classifier贝叶斯算法[17]对97%相似水平的OTU代表序列作分类学分析。
1.4 厌氧平板分离
将低温琼脂添加至MSM培养基中,高温灭菌后温度下降至50 ℃左右时,添加微量元素溶液、维生素溶液、磷酸盐溶液和碳源(混合PAHs及烷烃)等,在厌氧操作箱中倒平板,待厌氧平板凝固后备用。通过注射器抽取10~20 μL厌氧富集物,在厌氧操作箱中均匀涂布在厌氧平板上,通过厌氧罐或一次性厌氧袋取出,置于28 ℃培养箱培养2~3周后,观察厌氧平板上菌株生长状况。通过厌氧平板划线纯化,获得平板上的生长菌株。
1.5 16S rRNA遗传分析
培养目标菌株生长至对数期,采用细菌基因组DNA提取试剂盒(硅胶柱型)提取目标菌株的基因组DNA,置于-20 ℃存放备用。通过引物27F、1492R扩增16S rRNA基因,将送测获得的序列,提交至EzBioCloud进行目标序列与数据库的比对[18],鉴定分离菌株的种属。通过IMNGS (https://www.imngs.org/)对该菌序列来源进行比对分析,整理并分析来源区域特性。
1.6 PAHs降解率测定
以芘为唯一碳源(初始质量浓度50 mg/L),硝酸盐为唯一电子受体(初始浓度10 mmol/L),测定菌株PA16-9对芘的厌氧降解率。芘含量的测定方法如下:每个时间段设置3个平行,取样时间为1、7、14、30、46 d。通过正己烷萃取培养液中的芘,旋蒸后收集浓缩液,氮吹定容至1 mL。取1 mL样品稀释500倍,取2 mL稀释液经0.45 μm孔径聚酰胺微孔滤膜过滤,转移至2 mL色谱瓶上机进行GC-MS检测,进样量为1 μL。
色谱条件包括:载气为高纯氦气;柱温60 ℃,以10 ℃/min的速度升到280 ℃,维持5 min;分流比3∶1;进样口温度250 ℃;柱流速1.3 mL/min;检测器温度250 ℃;扫描范围40~400 amv;电子能量70 ev;载气流速1 mL/min;离子源温度200 ℃;传输线温度250 ℃;选择定量分析SIM扫描模式,分别扫描相应PAH的特征离子碎片。
1.7 亚硝酸盐浓度测定
本研究使用重氮-偶氮法[19]测定菌体及培养液中的亚硝酸盐浓度。
2 结果与讨论
2.1 厌氧富集物细菌多样性
实验采用混合PAHs碳源作为厌氧富集的唯一碳源,深海沉积物样品经过富集和传代4、6、12周。在培养结束时提取各个阶段厌氧烃富集物DNA,送测微生物群落多样性后获得各个阶段的微生物相对丰度和群落结构组成。基于OTU聚类结果,我们对样本的α-多样性进行分析。α-多样性是指一个特定区域或者生态系统内的多样性,常用的度量标准有Sobs、Shannon、Ace、Simpson和Chao等,我们通过比较各种指数值进而得到物种的多样性丰度等信息。不同样品中厌氧烃降解群落的种类丰度具有较大差异,T6分组的X6样品呈现出最高的Shannon指数,该样品的群落组成的均一度也最为复杂(图1)。稀释性曲线分析表明,随着测序读取序列数量的增加,样品α-多样性没有显著变化,表明该测序量已经能够较为精确的反映样品中的群落相对丰度。将各样品Reads数均一化处理,在相同水平进行多样性比较。
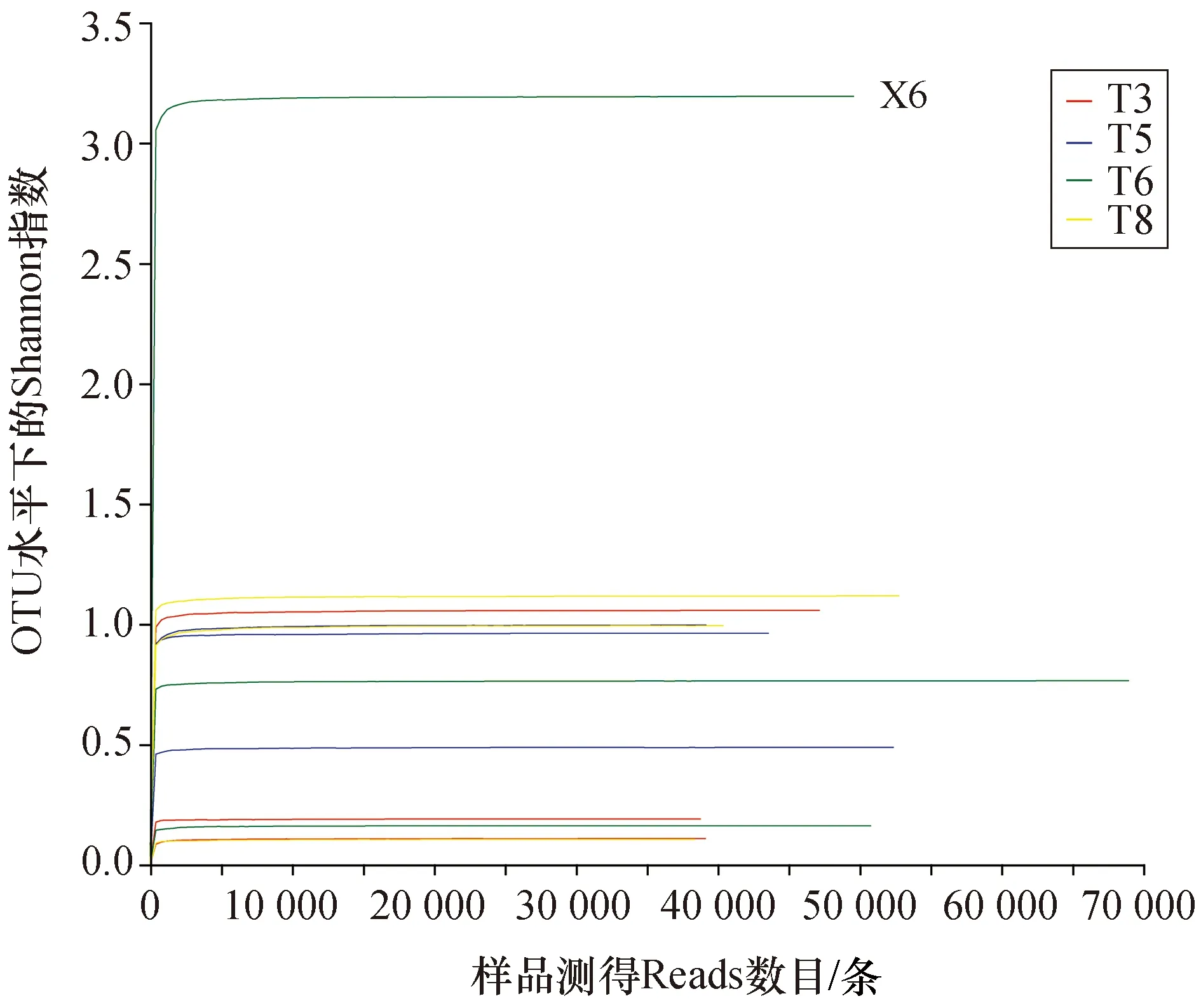
图1 厌氧烃富集物细菌序列稀释性曲线Fig.1 Sequential dilution curve of anaerobic hydrocarbon enrichment bacteria
在属水平上观察不同样品在经厌氧烃富集获得的厌氧烃代谢菌落组成差异。在4个沉积物样品的厌氧烃富集群落中,共有320个属被发现,T3系列富集物样品测得111个属,T5系列样品测得160个属,T6系列样品测得220个属,T8系列样品测得203个属,其中59个菌属是4组富集物中所共有的,这类共有菌属均在样品中占较高丰富度(图2)。通过分析我们发现,这些主要类群的菌属包括盐单胞菌属(Halomonas)、海旋菌属(Thalassospira)、海杆菌属(Marinobacter)、海洋杆菌属(Oceanobacter)和食烷菌属(Alcanivorax)等。已有研究表明这些占主要类群的菌株在好氧条件下具有烃降解能力,在厌氧条件下没有相关报道。其中盐单胞菌属是海洋中常见的兼性厌氧细菌,在大多数样品中的占比最高。
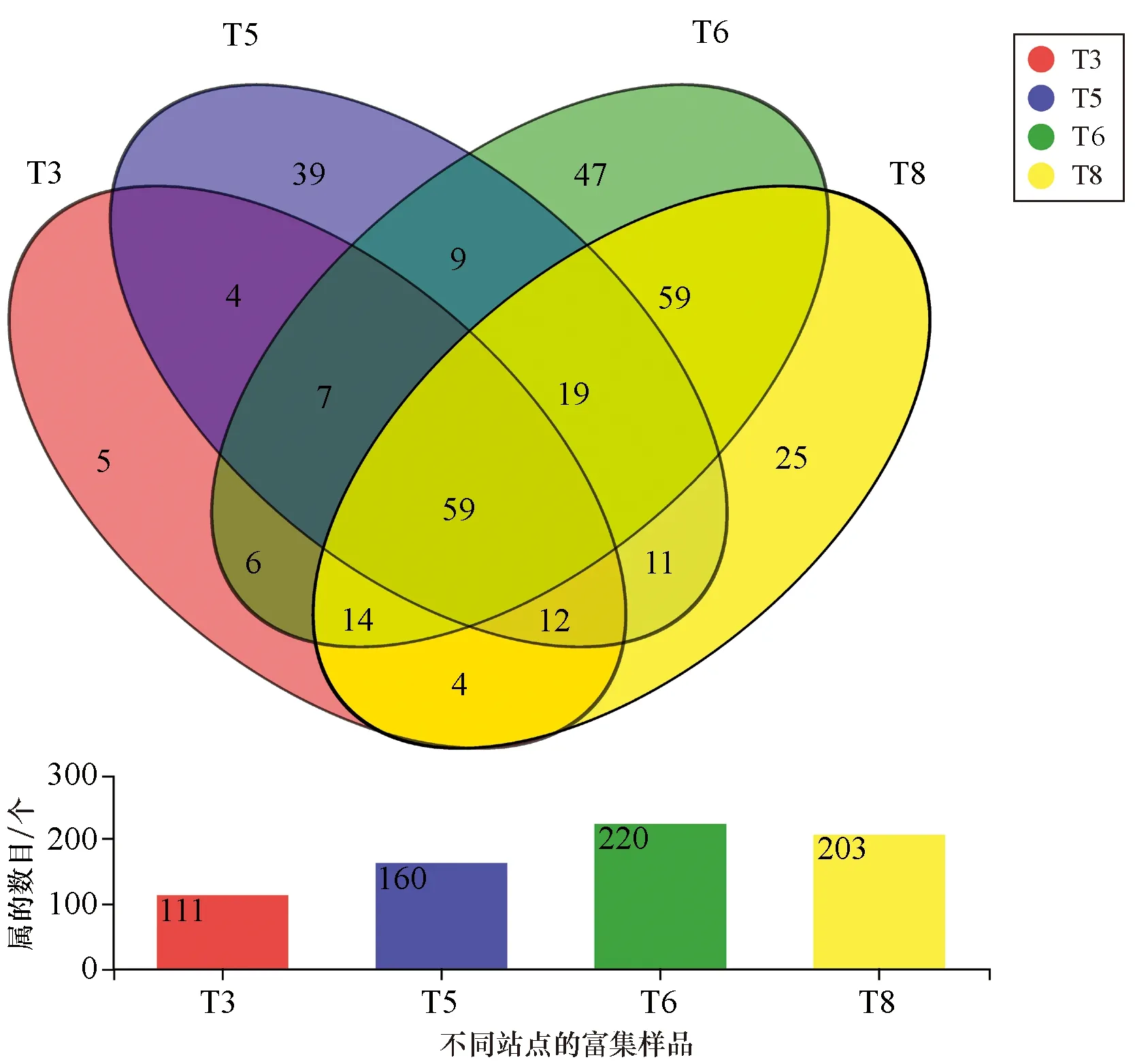
图2 属水平上不同样品富集的细菌类群差异Fig.2 Differences in bacterial groups enriched in different samples at the genus level
在厌氧条件下,初代富集物和传代富集物的高通量测序结果表明(图3),盐单胞菌属在绝大多数培养物中占主要丰度。而海旋菌属在M8、N8、X8富集物中占主要的丰度。富集之间的传递表明微生物群落具有显著的遗传。M3、N3、X3富集物中,盐单胞菌属的相对丰度呈梯度增加,分别为90.04%、98.52%、99.15%。在经过4周厌氧富集培养的初代培养物M3、M5、M8中,食烷菌属的相对丰度分别为1.90%,16.88%、1.58%。但是在随后的传代培养物中,食烷菌属的丰度逐渐下降并消失了。T8系列多样性从第一代(M8)到第二代(N8)下降了,但到了第三代(X8)则增加了。在M5、N5、X5和M6、N6、X6的组中也发生了此现象。尽管在M6和N6培养物中,盐单胞菌属的相对丰度高于97%,但在随后的第三代传代培养物X6中观察到了相对均匀分布的群落丰度和较高的群落多样性,主要类群有Ruminococcaceae (19.28%)、Subdoligranulum(15.67%)、Collinsella(11.11%)、Blautia(8.69%)、Halomonas(6.58%)、Erysipelatoclostridium(6.43%)、Streptococcus(5.52%)等。一个合理的猜想就是第三代富集的时间相对较长,微生物群落经过相互竞争新的生态位,演化形成新格局。由于高盐和低氧富集条件,大多数微生物极可能属于具有烃胁迫的机会主义者。生命的目的在于延续,当微生物在竞争中处于不利位置时,将进行类似休眠的生命活动。当进入新环境时(传代),它们将开始新一轮的生态位竞争。因此,第三代培养物X6呈现出较高的的微生物群落多样性。

图3 厌氧烃富集物中的细菌群落组成(属)Fig.3 Bacterial community composition (genus)in anaerobic hydrocarbon enrichment
2.2 系统发育分析
对深海沉积物进行厌氧混合烃富集后,取适量富集物涂布至厌氧平板上,厌氧(微氧)平板也以混合烃为唯一碳源,生长4周左右形成大小不一的褐色菌落(长时间后菌落外形成水膜),挑取菌落接种至厌氧液体培养基避光培养。
从富集的沉积物中分离出的PA16-9菌株,能够降解多种烃类物质。提取菌株的基因组DNA后,使用引物27F和1492R扩增其16S rRNA基因。在EzBioCloud和NCBI网站上选择与其16S rRNA高度相似的序列,使用MEGA-X计算序列的系统发生距离,构建系统发育树(Neighbor-Joining)。该菌株的16S rRNA序列在分类上归属于Gammaproteobacteria、Oceanospirillales、Halomonadaceae,与模式菌株泰坦尼克盐单胞菌HalomonastitanicaeBH1T高度相似,具有99.52%的相似性(图4),并在系统发育树上形成了一个共同分支,因此命名为HalomonastitanicaePA16-9。

图4 菌株PA16-9系统发育树Fig.4 Phylogenetic analysis of strain PA16-9
基于HalomonastitanicaeBH1T的16S rRNA基因序列,通过在NCBI数据库中进行序列检索的不完全统计结果,发现该类群的菌株广泛存在于自然界的水圈和土壤,以及相关的工业发酵场所,涉及的主要生境包括海滩、废水、活性污泥、油田、湿地等,在较为极端的环境如极地、热泉、高盐湖等地均有发现,说明该菌在复杂环境的生物修复应用中具有很大潜力。
2.3 烃降解能力
将PA16-9单菌落划线接种至高盐LB固体平板,倒置于恒温培养箱内,32 ℃培养48 h,菌落呈圆形,米黄色半透明,表面光滑湿润,边缘规则,无晕环,中央微凸起,直径2~4 mm。PA16-9为革兰氏阴性菌,兼性好氧。取初生菌体制片,进行透射电镜观察,呈杆状,长度为1.6~2.0 μm,外围有菌毛,主要依赖鞭毛进行运动[图5(a)]。
以芘为唯一碳源,在好氧和厌氧条件下分别培养菌株PA16-9至对数生长期。收集菌体与芘颗粒,做扫描电镜观察,可见芘颗粒的光滑表面与菌株粗糙的菌落表面形成反差。在厌氧条件下,5 μm尺度下可以清晰地观察到菌株PA16-9呈长杆状整齐排列[图5(b)];在好氧条件下,菌株含量相对较高,产生的胞外物质呈现黏稠状,只能观察到粗糙的菌落表面[图5(c)]。芘颗粒在扫描电镜下呈现晶体状,不过在菌株作用前后并未见明显的表面裂缝,仅表面有菌株分泌物附着。在好氧摇瓶中能明显观察到芘颗粒经菌株作用后呈稠状。

图5 菌株PA16-9的形态Fig.5 Morphology of strain PA16-9(a)透射电镜,(b)扫描电镜(厌氧,芘为唯一碳源),(c)扫描电镜(好氧,芘为唯一碳源)。
通过厌氧瓶的封闭式培养营造厌氧环境,以芘、苯并芘和正十六烷分别为唯一碳源,设一组无碳源对照组,28 ℃避光条件下,置于摇床培养以促进菌株与底物间的接触。接菌后培养半天,摇匀取样镜检、血球计数板计数,计得初始菌株含量约为5×107个/mL,培养期间为避免多次取样引起进氧,仅取少量样品用以判定菌株生长状况,18 d后通过显微镜计数,观察到芘和正十六烷为碳源的样品中菌株生长不太明显,菌株含量略有升高;在以苯并芘为唯一碳源的样品中,菌株大量生长,菌株含量达到2×108个/mL,相比于接种时显著增高;无碳源培养基菌株含量变化不大[图6(a)],鉴于盐单胞菌属适应于海洋这类营养物质匮乏的环境,可能具有一些特殊的代谢途径在无碳环境中存活一段时间。
以芘为唯一碳源(初始含量50 mg/L),硝酸盐为唯一电子受体(初始浓度10 mmol/L),在厌氧条件下测定芘的降解率和亚硝酸盐积累量,设3组平行实验。培养45 d后芘的降解率达到61.9%,期间亚硝酸盐逐渐积累,浓度约为0.24 mmol/L[图6(b)]。在厌氧培养过程中,硝酸盐作为电子受体,烃作为电子供体,硝酸盐经反硝化过程被还原到亚硝酸盐,研究普遍认为过高的亚硝酸盐浓度会抑制菌株生长。在以苯并芘为唯一碳源时,培养50 d后亚硝酸盐积累量达到近1 mmol/L,菌株依旧保持较高活性。但是以非烃的碱性木质素作为唯一碳源时,培养后期测得亚硝酸盐积累量高达8 mmol/L,菌株活性处于很低的状态,显然是过高的亚硝酸盐抑制了菌株活性(数据未展示)。当以亚硝酸盐作为唯一电子受体时,控制初始浓度在1 mmol/L以下,菌株生长缓慢,猜想是由于亚硝酸盐作为电子受体的浓度相对较低,从而影响菌株PA16-9厌氧条件利用烃(芘)的效率。
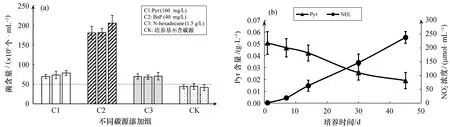
图6 菌株PA16-9厌氧生长与芘的降解率Fig.6 Anaerobic growth of strain PA16-9 and degradation rate of pyrene(a)菌株PA16-9在不同条件下厌氧生长18 d后的情况,(b)厌氧条件下菌株PA16-9对芘的降解率和亚硝酸盐积累量。
2.4 讨论
厌氧烃降解菌在环境污染生物修复中有重要的应用前景,因为很多油污染土壤与废水是厌氧环境。该类菌在石油污染治理过程中有特殊的应用价值,然而对厌氧烃降解菌的研究相对较少。盐单胞菌广泛分布在海洋、高盐湖、盐碱地等环境中,关于盐单胞菌的好氧烃降解能力已有大量研究。从受烃污染区域分离得到的盐单胞菌包括从墨西哥湾“深水地平线”溢油地点获得的盐单胞菌Halomonassp.19A、从法国南部地区一个污染的港口分离得到的Halomonassp.A3H3[20],以及从马德普拉塔港分离获得的烃降解菌Halomonassp.KHS3[13,21]。后续实验证明,它们都具有良好的好氧烃降解能力。
菌株PA16-9分离自太平洋深海沉积物的PAHs厌氧富集菌群,菌群结构分析表明盐单胞菌属为富集菌群的最优势菌属。分离得到的海旋菌和食烷菌属的菌株,在厌氧条件下生长均受到明显抑制。仅盐单胞菌能够在以萘、菲、芘、苯并(a)芘等PAHs和正十六烷为唯一碳源的条件下厌氧生长,其中以苯并(a)芘做碳源时菌株生长尤为显著,具有广谱的烃厌氧降解能力。因此推测菌株PA16-9的烃降解功能实际是一种群体功能,单个菌株对烃类外源物质具有感应、耐受等能力,仅当形成庞大数量构成的菌群时,才具有高效的烃降解能力。以往研究表明,在PAHs与简单碳源一同添加时,微生物对PAHs的降解效率得到提高[22]。研究认为纯菌降解PAHs的效率低于它们在群落中的效率,共培养中更高的降解率可能是由于联合体的协同作用[23]。

3 结论
本研究以PAHs为主要碳源进行定向厌氧富集,发现深海沉积物富集群落中主要类群为盐单胞菌,从中分离获得的菌株HalomonastitanicaePA16-9能够高效厌氧降解苯并(a)芘和芘。此前报道该类群降解烃类物质均发生在好氧条件下,这是首次对盐单胞菌展开厌氧烃代谢研究和报道。这种盐单胞菌不仅在厌氧烃降解菌群中占有主要丰度,并且具有广泛的生态位,在盐度、氧气限制等生物修复工程中具有潜在应用价值。

