低盐胁迫对大黄鱼非特异性免疫酶活力的影响
何亮银,史晓丽,周逢芳,陈美霞,韩坤煌
(宁德师范学院,福建 宁德 352100)
与高等脊椎动物相比,鱼类的特异性免疫发育不完全,比较依赖非特异性免疫防御系统抵御病害、维持机体健康,抗氧化酶、磷酸酶及溶菌酶(lysozyme,LZM)等属于非特异性免疫指标,其活力变化可一定程度上反映鱼体对外界环境胁迫的适应能力[1-2]。作为水生生物重要的环境因子,盐度能显著影响鱼类的存活、生长、代谢及非特异性免疫[3-7]。研究发现,养殖水体盐度变化会诱发鱼体应激反应,导致鱼体耗氧增加、代谢加速、能量消耗增多[8]。此外,盐度变化还会造成鱼体氧化损伤,降低鱼体的免疫能力[9],长期处于低盐度或高盐度胁迫下的养殖鱼类,更容易受到病原侵袭,引起鱼体疾病,甚至死亡[10-11]。
抗氧化系统能有效防止活性氧损伤,而由超氧化物歧化酶(superoxide dismutase,SOD)和过氧化氢酶(catalase,CAT)等组成酶促系统在其中发挥了重要作用[10]。SOD主要通过歧化作用分解超氧阴离子自由基(·O-2),在清除活性氧过程中最早发挥作用,清除·O-2的过程中会产生H2O2。CAT通过将H2O2分解为H2O,使细胞免于H2O2的毒害,保障机体的各项生理机能[12]。因此,许多研究将SOD和CAT作为研究鱼类受盐度胁迫下抗氧化的重要指标[10-11,13-15]。磷酸酶是生物体内解毒系统的重要组成部分,根据其催化时的最适pH值可分为碱性磷酸酶(alkaline phosphatase,ALP)和酸性磷酸酶(acid phosphatase,ACP)[16]。ALP是溶酶体的标志酶,主要通过催化磷酸单酯的水解参与磷酸酯的代谢,能在宿主通过溶酶体降解入侵病原过程中发挥作用。ACP是吞噬溶酶体的重要组分,在酸性环境下,ACP可水解含磷酸酯的异物,在免疫反应中发挥作用[17]。LZM能水解革兰氏阳性细菌的细胞壁肽聚糖,并与防御素、抗菌肽及乳铁蛋白等协同作用溶解革兰氏阴性细菌的细胞壁脂多糖,还能破坏真菌、寄生虫以及病毒等[18],是研究鱼类受盐度胁迫后免疫反应的重要指标[19]。
大黄鱼(Larimichthyscrocea)是我国重要的海水经济鱼类,据统计,2019年大黄鱼养殖的产量为225 549 t,已连续多年位居我国海水养殖鱼类之首[20]。大黄鱼多养殖于东南沿海海域,适宜生存盐度为20~34,养殖水体的盐度易受台风引起的暴雨及地表径流等的影响而骤降,导致大黄鱼应激反应强烈,渗透压紊乱和机体免疫力下降,引起死亡[21]。此外,为扩展大黄鱼养殖区域,最大化利用内陆及河口丰富的咸淡水资源,已有不少研究人员开始尝试大黄鱼的低盐养殖[21-22]。本研究通过对大黄鱼进行急性、慢性低盐胁迫处理后的肝脏抗氧化酶活力及血清磷酸酶活力和溶菌酶活力的变化分析,探究盐度骤降及低盐养殖对大黄鱼非特异性免疫的影响,以期为大黄鱼的健康养殖提供参考。
1 材料与方法
1.1 实验用鱼与养殖条件
实验用健康大黄鱼购自宁德富发水产有限公司,初始平均体长为(15.6±1.5)cm,平均体质量为(46.4±3.7)g,运抵实验场所后暂养一周,持续充氧,水温为(16.0±1.5)℃,海水盐度为23,早晚投喂商品饵料,每天使用相同盐度海水换水1/3左右,吸去残饵和污物。本研究实验于2020年3月开始,4月结束。
1.2 实验设计与管理
实验用鱼养殖于约350 dm3的圆形塑料桶。设置急性低盐胁迫组、慢性低盐胁迫组及正常盐度海水养殖3个实验大组,其中急性低盐胁迫又设置盐度为15和8两个小组,慢性低盐胁迫组仅设置盐度为8组,正常海水盐度组为对照组,盐度为23。每个实验组设置3个平行,共12组,每个平行15尾。将自来水曝气至少48 h以后用于盐度调整,对于急性胁迫组,随机将暂养稳定后群体直接放入目标盐度组(含对照组)中,从实验鱼放入各盐度组水体作为起始0 h,分别在1、3、7 d各盐度组中取样,每平行每次取两尾;对于慢性低盐胁迫组,实验用鱼放入水体后开始调节盐度,按每天降低2将自然海水盐度从23降至15,继续按每天降低1将盐度从15降至8。逐步调节到设定盐度后,在该盐度条件下养殖14 d后取样。
1.3 样品采集与酶活力测定
取样前停止投喂饲料1次,将大黄鱼转移至含MS-222的对应盐度海水中(浓度为50 mg/dm3)约30 s麻醉后,用一次性1 cm3注射器尾静脉采血,采集的静脉血于4 ℃静置过夜后,次日3 000 r/min、4 ℃离心10 min,取上清液冻存于-20 ℃,用于溶菌酶及磷酸酶活力测定;采血后于冰盘上解剖鱼体,取出肝脏用预冷磷酸盐缓冲液(phosphate buffer saline,PBS)冲洗3遍并用滤纸吸干水分后,置于离心管中-20 ℃保存,用于抗氧化酶活力测定。因鱼体较小,每次每个平行取样两尾,实验将同一平行两尾鱼的血液和肝脏合为一个样本。
对于肝脏组织中SOD和CAT的酶活力测定,准确称取组织质量,按质量(g)∶体积(cm3)=1∶9的比例加入9倍体积的预冷生理盐水,冰浴条件下匀浆,制备成10%的组织匀浆液,2 500 r/min离心10 min后取上清,使用南京建成试剂盒进行酶活力测定。其中,定义反应体系中SOD抑制率达50%时所对应的酶量为一个SOD活力单位(U);定义每毫克组织蛋白每秒分解1 μmol的H2O2的量为1个CAT活力单位(U)。
使用南京建成试剂盒直接对血清中ACP和ALP的酶活力进行测定。定义100 cm3血清在37 ℃与基质(磷酸苯二钠,disodium phenyl phosphate hydrate)作用30 min产生1 mg酚为1个ACP金氏单位(1金氏单位 =7.14 U/dm3);定义100 cm3血清在37 ℃与基质(磷酸苯二钠)作用15 min产生1 mg酚为1个ALP金氏单位。采用空白对照法对血清中LZM进行测定,以530 nm处双蒸水调透光度为100%,测定各样品反应管的透光度。
1.4 数据统计与分析
实验数据采用平均值±标准差(mean±SD)表示,采用SPSS 19.0软件进行单因素方差(ANOVA)及Duncan多重比较分析,以p<0.05作为差异显著标准。以Origin 8.0软件绘制柱状图。
2 结果与讨论
2.1 低盐胁迫下大黄鱼的活动能力及存活状况
实验过程中,所有组别大黄鱼均未出现死亡情况,表明大黄鱼具有较好的盐度调节和适应能力。对于急性低盐胁迫组,胁迫初始阶段鱼体活动频繁,体表黏液增多,摄食能力明显减弱,但在较短时间内恢复正常;慢性低盐胁迫组的大黄鱼活动及摄食能力未见明显变化。
2.2 急性低盐胁迫对大黄鱼非特异性免疫酶活力的影响
2.2.1 抗氧化酶 从图1可以看出,急性低盐胁迫下,大黄鱼肝脏组织的SOD活力呈先上升后下降的趋势。盐度为15的胁迫组,SOD活力在第1天开始显著上升(p<0.05)后逐渐下降,至第7天时显著低于对照组水平。盐度为8的胁迫组的SOD活力变化趋势与盐度为15的胁迫组相似,也在第1天时显著上升(p<0.05),然后开始下降,在第3天和7天时,SOD值均显著低于对照组。对于同一时间点的不同盐度胁迫组,胁迫盐度越低,造成的SOD活力值波动越大,即上升或下降的幅度也越大,且同一时间点的两个组别间差异显著(p<0.05),而对照组SOD活力在整个实验周期内未见显著变化。
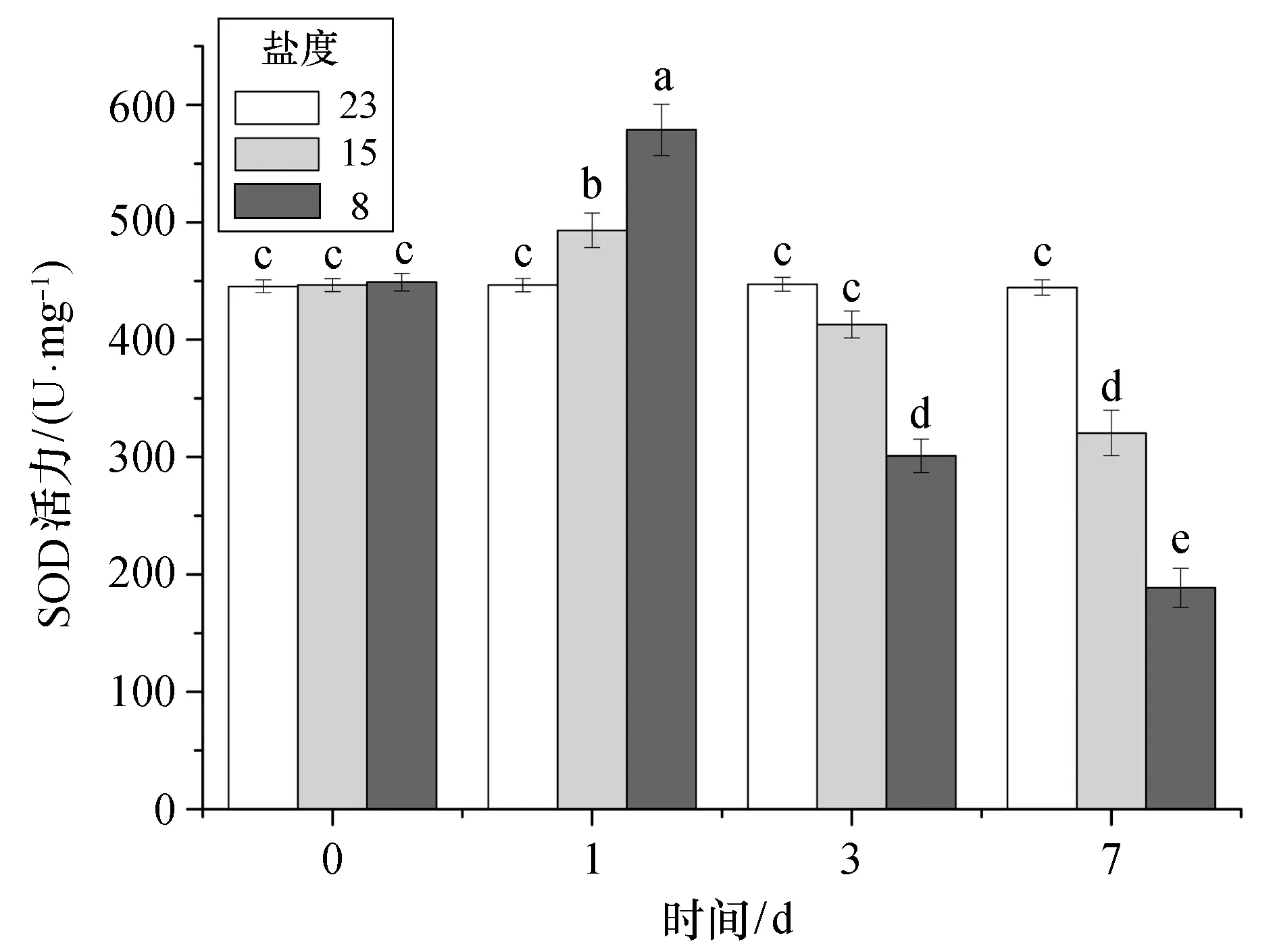
图1 不同盐度急性胁迫下大黄鱼肝脏SOD活力Fig.1 Acute effects of different low salinity stresses on SOD activity in the liver of croaker不同字母代表有显著性差异(p<0.05),相同则无显著差异,下同。
从图2可以看出,急性低盐胁迫下,大黄鱼肝脏组织的CAT活力整体呈先下降后上升再下降的趋势。胁迫盐度为15时,CAT活力在第1天就大幅下降至对照组近一半水平(p<0.05),至第3天时开始提升至对照组水平,而后开始下降,至第7天时CAT活力显著低于对照组。盐度为8的胁迫组的CAT活力变化趋势与盐度为15组相似,也在第1天显著下降后开始升高,第3天后开始下降,至第7天时CAT活力显著低于对照组水平(p<0.05)。对于同一时间点的不同盐度胁迫组,CAT活力值也存在显著性差异(p<0.05),而对照组CAT活力在整个实验周期内保持相对稳定。
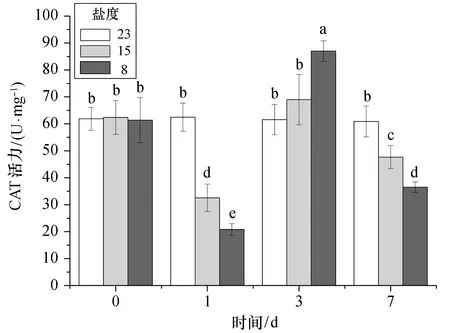
图2 不同盐度急性胁迫下大黄鱼肝脏CAT活力Fig.2 Acute effects of different low salinity stresses on CAT activity in the liver of croaker
2.2.2 磷酸酶 从图3可以看出,急性低盐胁迫下,大黄鱼血清ACP活力呈下降后逐渐升高的趋势。胁迫盐度为15时,血清ACP活力在第1天时显著下降(p<0.05),然后逐步升高,至第7天时虽仍低于对照组水平,但没有显著性差异(p>0.05)。胁迫盐度为8时,血清ACP活力变化趋势与盐度为15的胁迫组相近,第1天时下降至对照组近1/3水平后逐步升高,至第7天时仍显著低于对照组(p<0.05)。对于同一时间点的不同盐度胁迫组,ACP活力值也存在显著性差异(p<0.05),且盐度为8的胁迫组ACP活力值变化幅度要大于盐度为15的胁迫组。
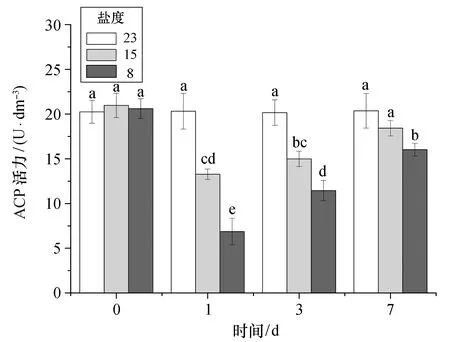
图3 不同盐度急性胁迫下大黄鱼血清ACP活力Fig.3 Acute effects of different low salinity stresses on ACP activity in the serum of croaker
从图4可以看出,急性低盐胁迫下,大黄鱼血清ALP活力呈先逐渐升高后下降的趋势。盐度为15的低盐胁迫组的ALP活力在实验开始的第1天到第3天逐渐升高,且均高于对照组(p<0.05),至第7天时开始下降至对照组水平。盐度为8的低盐胁迫组的血清ALP活力也在实验初期逐渐升高,ALP活力值在第3天时约为对照组的1.8倍,第7天虽开始下降,但仍显著高于对照组(p<0.05)。对于同一时间点的两个不同盐度组,血清ALP活力值也存在显著性差异(p<0.05)。
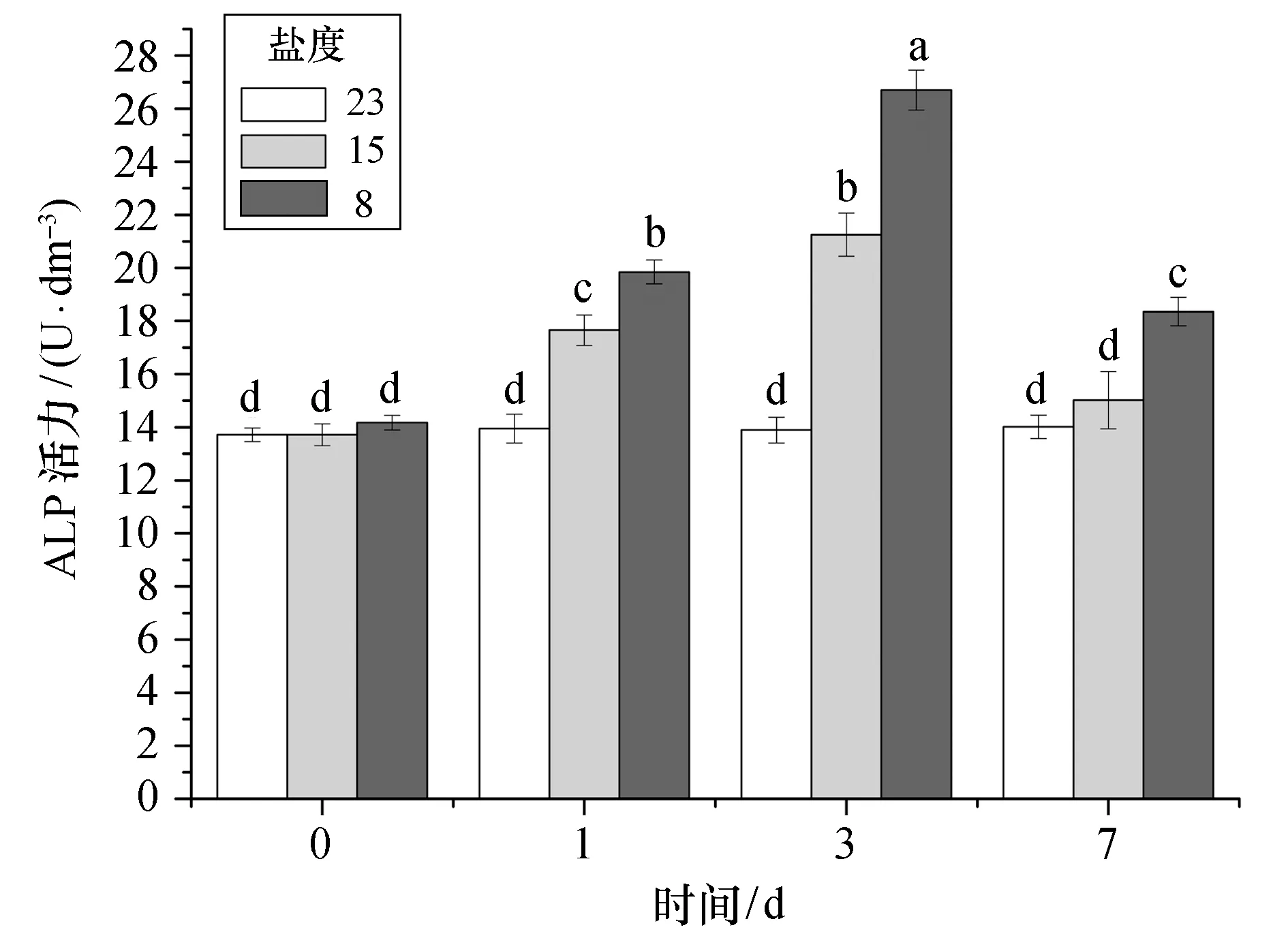
图4 不同盐度急性胁迫下大黄鱼血清ALP活力Fig.4 Acute effects of different low salinity stresses on ALP activity in the serum of croaker
2.2.3 溶菌酶 从图5可以看出,急性低盐胁迫下,大黄鱼血清LZM含量呈波动变化,整体呈先上升后下降的趋势,但数值变化不大。胁迫盐度为15时,血清LZM含量在第1天时先小幅上升(p<0.05),后持续下降,至第3天时与对照组差异不显著,第7天的LZM含量虽显著低于对照组,但也仅下降约10%。胁迫盐度为8时,血清LZM的变化幅度明显大于盐度为15的组,每个时间点的LZM含量均与对照组有显著性差异(p<0.05)。
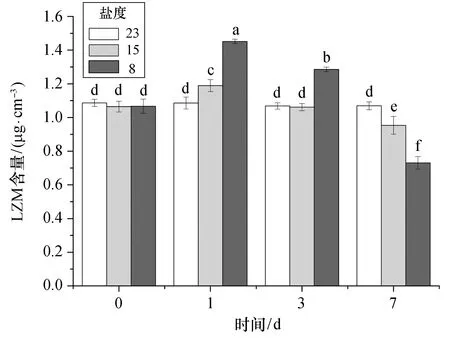
图5 不同盐度急性胁迫下大黄鱼血清LZM含量Fig.5 Acute effects of different low salinity stresses on LZM content in the serum of croaker
2.3 慢性低盐胁迫对大黄鱼非特异性免疫酶活力的影响
大黄鱼在盐度为8的慢性低盐环境下养殖14 d后,肝脏的抗氧化酶活力及血清磷酸酶和溶菌酶活力均出现小幅波动,但与对照组相比所有指标均不存在显著性差异(p>0.05)。抗氧化酶活力方面,肝脏SOD和CAT活力均有小幅下降[图6(a)、(b)];血清ACP活力也有一定的降低[图7(a)],而ALP活力则有小幅提升[图7(b)];血清LZM含量有略微下降,实验周期内对照组所有检测指标均未出现显著变化(图8)。
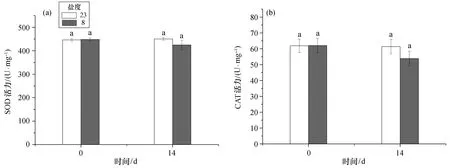
图6 慢性低盐胁迫下大黄鱼肝脏抗氧化酶活力Fig.6 Chronic effects of low salinity stresses on antioxidant enzyme activity in the liver of croaker
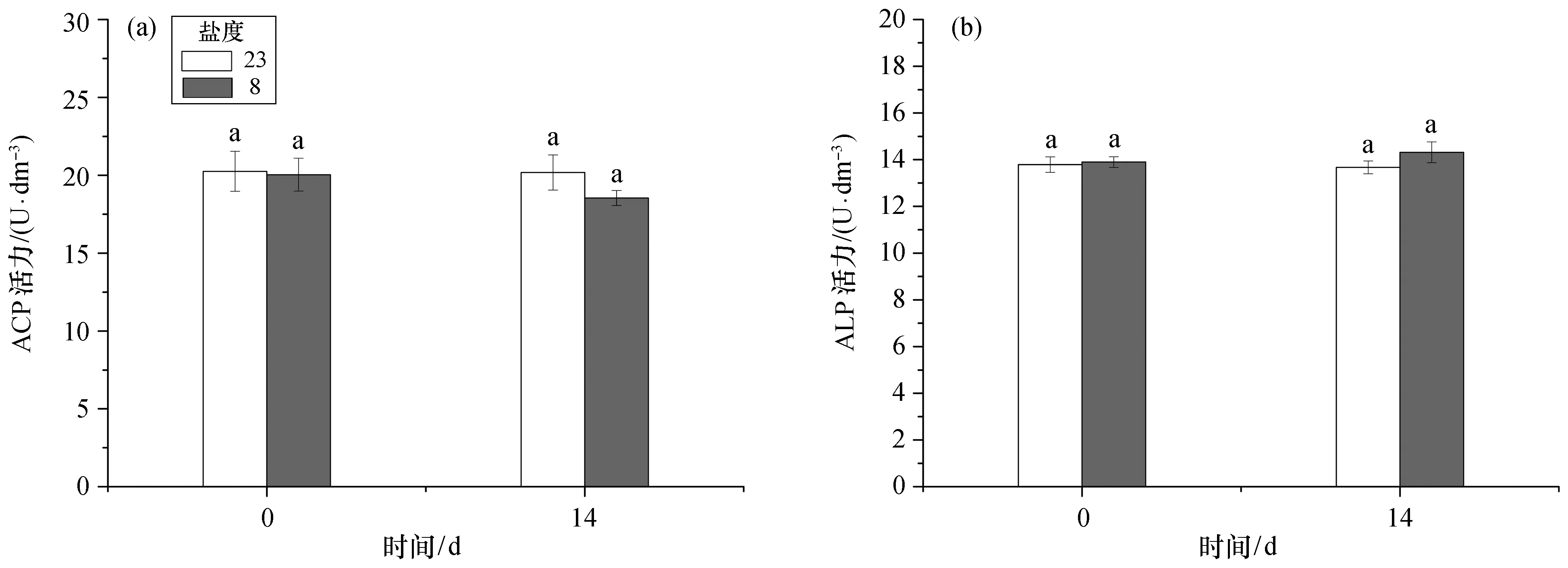
图7 慢性低盐胁迫下大黄鱼血清磷酸酶活力Fig.7 Chronic effects of low salinity stresses on phosphate enzyme activity in the serum of croaker
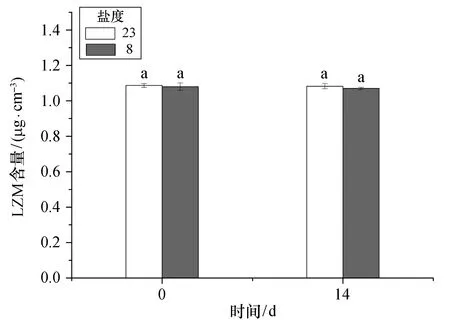
图8 慢性低盐胁迫下大黄鱼血清溶菌酶含量Fig.8 Chronic effects of low salinity stresses on LZM content in the serum of croaker
2.4 讨论
2.4.1 盐度胁迫对大黄鱼活力及其存活状况的影响 养殖水体的盐度对鱼体的生长及存活有显著影响[23-25]。大黄鱼为集群洄游性鱼类,其适盐范围比较广,李兵等(2012)的研究发现大黄鱼30日龄幼鱼对海水盐度的适应范围为5.5~41.0,具有较强的耐盐性[26]。本研究中大黄鱼在盐度为15及8的急性低盐胁迫下,初始阶段出现活动频繁、摄食减弱及黏液增多等现象,这与王涛等(2013)的实验结果[27]相似;不同的是,本研究中所有组别的大黄鱼均未出现死亡,这可能与鱼体大小及实验周期长短有关。在盐度为8的慢性低盐胁迫下,大黄鱼可长期存活,且存活及摄食状况未受明显影响。因实验周期较短,本研究未测定不同处理组间大黄鱼的具体生长指标,不同盐度差异及胁迫方式对大黄鱼生长的影响还有待进一步研究。
2.4.2 急性低盐胁迫对大黄鱼非特异性免疫酶活力的影响 盐度骤变会导致鱼类代谢紊乱及氧化压力增加[28]。肝脏是鱼体内物质代谢以及进行氧化反应的最主要组织,其抗氧化酶活力能指示机体的抗氧化特征。SOD 和CAT 是清除活性氧自由基的重要酶蛋白,对机体细胞损伤后的氧化过程和吞噬作用具有很强的防御功能。在低盐胁迫下,多鳞四指马鲅(Eleutheronemarhadinum)肝脏的SOD活性呈先上升后逐步下降的趋势[29];银鲳(Pampusargenteus)肝脏SOD 活力在胁迫初期显著增强,随后恢复,CAT 活力则呈波动上升变化[30];黄姑鱼(Nibeaalbiflora)肝脏的SOD活力呈先上升后下降变化,CAT活力则呈先减弱后增强而后再减弱的变化趋势[15]。本研究中大黄鱼肝脏抗氧化酶活力的整体变化趋势与上述研究结果相似,表现为整体先上升后下降,表明大黄鱼机体在盐度骤降时会提高抗氧化酶活力来应对氧化压力,与SOD活力变化不同的是,CAT活力会在胁迫初始阶段出现降低,这可能与二者产生过程及作用方式相关[12]。
磷酸酶是生物体内重要的解毒体系组成部分,它们能通过调节蛋白的去磷酸化,在一些营养物质的消化、吸收、转运过程中起着重要作用[16]。王海亮等(2016)研究了不同低盐浓度急性胁迫下花鲈(Lateolabraxmaculatus)的ACP活力变化,其在胁迫初期有下降趋势,而随着时间延长,ACP活力又逐渐回升至正常水平[11];张龙岗等(2011)对澳洲宝石鲈(Scortumbarcoo)的ACP活力在低盐胁迫下的动态变化研究也显示低盐度下ACP活性受到抑制,且盐度越低抑制作用越明显[17]。本研究中大黄鱼的ACP活性在低盐胁迫下呈先下降后逐渐升高的趋势,且盐度为8的胁迫组ACP活力值变化幅度要大于盐度为15的胁迫组,这与上述研究的实验结果相似,可能是由于实验初期盐度骤降抑制了ACP活力,随着鱼体对低盐环境的适应,ACP活力逐渐回升至正常水平,也可能与金属离子对ACP活力的激活有关[31]。王跃斌等(2015)探究了日本黄姑鱼(N.japonica)ALP活力在低盐胁迫下的变化特点,发现盐度为6及18组中的日本黄姑鱼肾脏ALP活力显著高于盐度为24组[1],而张龙岗等对澳洲宝石鲈的ALP活力在低盐胁迫下的动态变化研究也显示低盐度胁迫会显著提高ALP活力,盐度为5的实验组ALP活力极显著地高于其他高盐度组(p<0.01)[17]。本研究中大黄鱼ALP活力在低盐胁迫下呈先逐渐升高后下降的趋势,这与上述研究者的结果类似,但也有研究表明,低盐胁迫会降低鱼体ALP活性,如房子恒等(2014)发现半滑舌鳎(Cynoglossussemilaevis)肌肉和肾脏中ALP活力随实验盐度的升高而逐渐升高,其中肌肉组织中ALP活力在盐度为20和30时显著高于淡水处理[2],这可能与不同鱼种对盐度的适应能力不一样或者实验方法不同有一定的关系,具体情况还需进一步研究。
LZM在鱼体的黏液、血清和某些淋巴组织中广泛分布,是鱼类非特异性免疫系统的重要组成部分,其活力越强,溶菌能力也就越高[19]。盐度胁迫能影响鱼类的LZM含量,王晓杰等(2005)对许氏平鮋(Sebastesschlegeli)在盐度为5和10急性低盐胁迫下的LZM含量进行了测定,结果显示鱼体LZM含量在胁迫24 h达到峰值,之后逐渐下降[32];对其他海水鱼类,如牙鲆(Paralichthysolivaceus)[33]、军曹鱼(Rachycentroncanadum)[34]及黄姑鱼[35]等在低盐胁迫下LZM含量研究也显示出类似变化规律。本研究中大黄鱼血清LZM含量呈先上升后下降的趋势,但数值变化不大,这与上述研究结果相近,胁迫初期,大黄鱼LZM含量增加以应答外源压力,属自身应激保护反应,随着胁迫时间延长,鱼体内多种生理功能发生紊乱,降低了自身的免疫力,导致LZM含量下降。可见,LZM在大黄鱼非特异性免疫中发挥着重要作用。
2.4.3 慢性低盐胁迫对大黄鱼非特异性免疫酶活力的影响 本研究对盐度为8慢性低盐胁迫下14 d后大黄鱼的各项非特异性免疫酶活力进行了测定,结果显示包括SOD和CAT的抗氧化酶活力、包括ACP和ALP的磷酸酶活力及LZM含量均在养殖14 d后无显著性差异,这与王跃斌等[1]的日本黄姑鱼研究结果相似,日本黄姑鱼在不同盐度(0、6、12、18、24及30)下养殖30 d后,仅盐度为24的胁迫组日本黄姑鱼肾脏ALP活力显著低于盐度为6和18的胁迫组(p<0.05),其他各组织中SOD、CAT、ALP 和ACP 活力在不同盐度下均未发现有显著差异[1]。表明大黄鱼与日本黄姑鱼类似,对低盐度有较高的耐受能力,具备低盐养殖的实践基础。
3 结论
鱼体非特异性免疫酶活力的变化可以一定程度上反映鱼体对不同环境胁迫的适应能力。急性低盐胁迫能显著影响大黄鱼肝脏的抗氧化功能、血清中的磷酸酶活力及溶菌酶含量,大黄鱼虽然对低盐度有较强的适应能力,但盐度骤降会引起鱼类的应激反应,消耗鱼体储备,还能影响鱼体非特异性免疫酶活力,导致免疫能力下降,实际生产中应避免养殖环境盐度的剧烈变化。另外,与正常盐度养殖下的大黄鱼相比,慢性低盐养殖下鱼体的各项非特异性免疫酶活力均未出现显著性差异,研究结果将为在河口入海地区及沿海围垦低盐度水域的大黄鱼养殖提供理论依据。

