枇杷等果树中苦杏仁甙的提取检测及生化机理研究进展
林 旺 , 林素英 , 陈 宇 , 吴锦程 *
( 1.莆田学院 环境与生物工程学院, 福建 莆田 351100;2.福建省新型污染物生态毒理效应与控制重点实验室, 福建 莆田 351100 )
0 引言
传统中药苦杏仁为蔷薇科植物山杏(Prunus armeniacavar.ansu)、 西伯利亚杏(P.sibirica)、 东北杏(P.mandshurica) 或杏(P.armeniaca) 的干燥成熟种子。 苦杏仁作为中药最早记载于《神农本草经》, 后被《中华人民共和国药典》 所收载。 苦杏仁中起主要药理作用的物质为苦杏仁甙(Amygdalin), 苦杏仁甙是芳香族中氰甙类化合物的一种, 又名维生素B17, 却不属于B 族维生素[1], 而属于β-型糖苷, 由龙胆二糖和苦杏仁腈组成, 其结构式如图1 所示[2]。 药理学研究表明, 苦杏仁甙具有抗肿瘤、 抗纤维化、 抗菌消炎、 止咳镇痛、 调节免疫力和抗氧化等作用, 但对于其生化机理尚不明确[3]。 有关苦杏仁甙的研究可追溯至19 世纪初, 早在1803 年, Schrader首次发现了苦杏仁甙; 1830 年, Robiqret 等从苦杏仁中提取出苦杏仁甙[4]。 本文综合近年来研究成果, 就枇杷及蔷薇科其他一些果树中苦杏仁甙的提取、 检测及其生化机理研究进展进行了综述, 并展望了未来研究方向和苦杏仁甙的开发应用前景。

图1 苦杏仁甙的结构式
1 苦杏仁甙在枇杷及蔷薇科其他一些果树中含量分析
苦杏仁甙不单存在于山杏中, 在其他一些蔷薇科果树, 如枇杷、 桃、 山楂、 李等的种仁、 果肉、 根、 花、 叶等器官中, 也广泛存在, 但其含量在不同蔷薇科果树、 不同产地、 不同器官、 不同组织中均存在差异。 以枇杷为例, 根据周春华等研究表明, 枇杷果肉的苦杏仁甙含量很低, 而种仁中则含量较高, 一般可达2% ~ 3%固重(dw)[5], 与花、 根相当, 但它们均明显低于叶片, 且不同品种及发育阶段的枇杷果仁苦杏仁甙含量差别较大[6]。 笔者综合了近几年的文献记载, 截至2021 年9 月, 有关从枇杷等蔷薇科果树中提取苦杏仁甙的部分文献见表1。
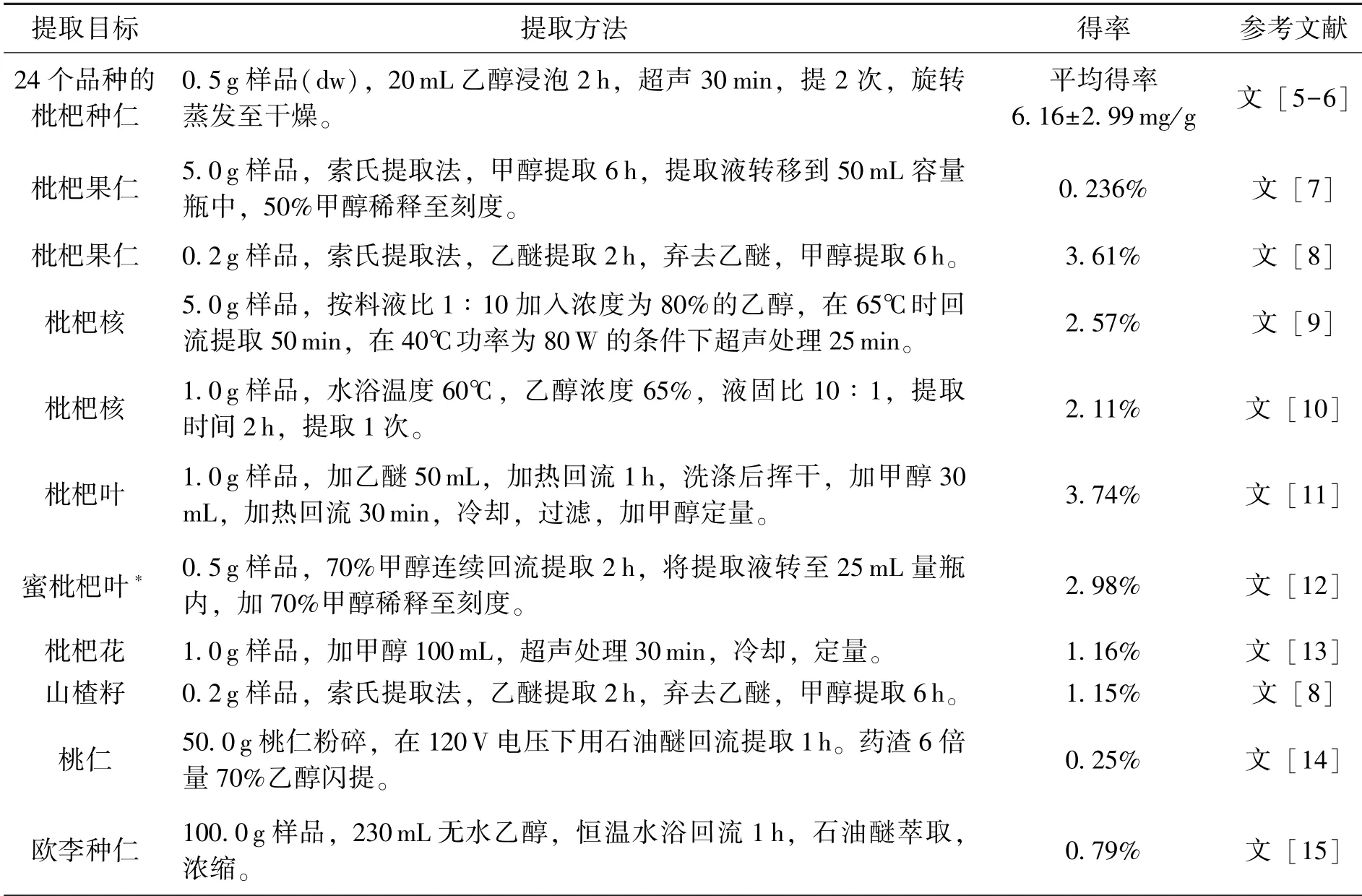
表1 从枇杷等蔷薇科果树中提取苦杏仁甙的相关文献介绍
2 苦杏仁甙检测技术
2.1 样品前处理
在检测前, 需对样品进行前处理。 待测样品往往杂质较多且待测组分含量较低, 前处理是指待测样品在进样检测前所进行的提取、 浓缩、 净化等过程, 可使待测组分纯化、 富集, 以利于后续的定性、 定量分析[16-17]。 样品的前处理在分析检测中至关重要且非常耗时, 对整个检测的效率有着决定性的影响, 前处理的好坏直接影响检测结果。 如田士林等在对蔷薇科植物种仁中的苦杏仁甙进行提取时, 前处理的时间达48 h 之久[10];而张瑾等[11]、 沈廷明等[12]在对枇杷花中的苦杏仁甙进行提取时, 前处理时间为2~3 h。
传统的苦杏仁甙的提取通常采用水浸提法[18], 此法需用大量的水高温浸泡, 耗时长,且苦杏仁甙在浸泡过程中部分水解, 给后续的提纯带来了一定干扰。 在浸泡液中加入一定浓度的乙醇可以提高提取效率[19], 但操作繁复且存在燃爆风险。 后续人们在浸泡法的基础上进行改进, 采用不同功率的超声波辅助来提高对苦杏仁甙的提取速率[20], 但超声功率需精准控制, 否则易造成苦杏仁甙降解; 同时, 如何控制高能耗是有待进一步解决的问题。 利用加压的方式可进行闪式提取, 但闪式提取不利于产率的提高, 原料浪费现象较严重。 此外, Kawahito 等利用超临界萃取法提取苦杏仁甙[21], 该方法的缺点是危险性较高、 成本昂贵。
2.2 检测分析技术
2.2.1 间接法
在加热、 酶或酸性环境下, 苦杏仁甙会在一些酶类(如苦杏仁甙酶及樱叶酶等)的作用下分解为氢氰酸、 苯甲醛和葡萄糖, 间接检测方法是对苦杏仁甙分解后所产生的氢氰酸进行标定的一种方法。 通过化学分析法标定氢氰根的方法有多种, 常见的有银量法、 中国药典法、 化学发光法、 电化学法等。 如夏其乐等在弱酸性条件下,加入氯胺-T 和吡啶-巴比妥酸使其变色, 再测其吸光度[22]。 间接法不需要大型精密仪器, 但是所测结果精度较低, 且过程繁琐, 不适合用于产品的批量检测。
2.2.2 直接法
直接法是目前使用较为广泛、 分析技术较成熟的一种方法, 多用于天然产物的分析检测。 在苦杏仁甙的检测与分析中使用较多的包括薄层扫描法(TLCS)、 高效液相色谱法(HPLC)和二阶导数光谱法(D2S)等。 TLCS 又名薄层色谱扫描法(QTLC), 它是利用各波段的光扫射薄层板, 对薄板存在可见或紫外吸收的成分进行扫描, 将扫描得到的图谱通过电子信号传输至终端, 并用于定性定量分析的一种方法。 HPLC 是在传统色谱法的基础上, 引入了气相色谱的理论, 是以高压下的液体为流动相的检测分析技术。 HPLC 应用广泛, 近80%的有机化合物可用该法测定。 导数光谱又名微分光谱, 属于紫外吸收光谱的一种,D2S 操作简单、 准确率高, 具有可不经分离而直接对复杂成分进行测定的优点。
井山林等通过绘制苦杏仁甙标准溶液紫外吸收曲 线 测 定 其 含 量[23]; Kang 等[24]、 Isozaki等[25]、 吕伟峰[26]用毛细管胶束电泳法测苦杏仁甙异构体的含量; 李吉来等利用QTLC 测定苦杏仁中的苦杏仁甙, 含量可达2.49%[27]; 李海龙等利用高效液相色谱-蒸发光散射检测器测定苦杏仁中苦杏仁甙含量, 测得苦杏仁中苦杏仁甙平均含量为2.31%, 相对标准偏差(RSD) 为1.65%[28]; 刘瑞琛等建立高效液相色谱-串联杆质谱法测定芪龙胶囊中的苦杏仁甙含量, 其线性范围可达20~5000ng/mL, 线性系数为0.9979[29]; 万书彤等建立超高效液相色谱法检测逐瘀通窍口服液中苦杏仁甙含量, 其检出限为39.70 ~794.00 mg/L[30]; 吴迪等对比了HPLC 和D2S 对苦杏仁的分析效果, 结果表明: 该2 种方法所测得的苦杏仁甙的含量基本一致, 精确度高, 重现性好,D2S 消除背景液干扰的效果更佳[31]; 易骏利用D2S 测定桃仁中苦杏仁甙的含量, 结果表明, 该法快速可靠, 测定过程中样品不经分离即可消除背景干扰[32]。
2.2.3 生物分析法
常见的生物分析法有酶联免疫吸附剂测定(ELISA)法等, ELISA 法将可溶性受检样本的抗原或抗体结合到固相载体上, 利用抗原抗体特异性结合进行免疫反应的定性和定量检测。 Cho 等以匙孔血蓝蛋白(KLH)作为载体蛋白与苦杏仁甙结合, 分析苦杏仁甙在坚果中的含量, 同时, 以兔/人嵌合抗体进行竞争性酶联免疫分析, 其检测限可达1×10-9mol/L[33]; 宋正华等将葡萄糖苷酶、 发光氨、 壳质胺和大孔阴离子交换剂组成流动注射系统, 利用苦杏仁甙分解生成的氢氰酸根与溶解氧反应生成超氧阴离子自由基, 可用于苦杏仁甙的测定[34]。
3 苦杏仁甙的生化机理
3.1 苦杏仁甙的药理作用
3.1.1 抗肿瘤作用
关于苦杏仁甙的抗肿瘤作用, 学术界仍存在争议。 赞同方认为, 苦杏仁甙可释放出氰化物和苯, 对肿瘤细胞有选择性的杀伤力, 而对健康细胞则影响不大; 反对方认为, 苦杏仁甙的抗肿瘤依据不充分, 且具有毒性, 不适合用于医疗诊治。 国内目前有较多关于苦杏仁甙抗肿瘤的报道。 聂振等利用β-葡萄糖苷酶激活苦杏仁甙用于限制膀胱癌EJ 细胞株的生长, 结果表明, 肿瘤细胞的凋亡速度随着苦杏仁甙浓度的增加而明显加快, 表明β-葡萄糖苷酶/苦杏仁甙酶解前药系统可能成为治疗膀胱癌的有效策略[35]。 连彦军等的研究表明, 苦杏仁甙可在抗-CEA 单抗-β-葡萄糖苷酶偶联物的作用下, 对人结肠癌细胞(LoVo)有靶向杀伤效果, 副作用低, 疗效显著[36]。
3.1.2 抗纤维化作用
纤维化是器官病理增生, 可发生在人体众多脏器, 导致功能障碍。 张向群等总结了苦杏仁甙在缓解肝、 胰、 肾等器官的纤维化方面有显著疗效[37]。 郭君其等发现, 苦杏仁甙可加速成纤细胞的凋亡, 延缓移植肾的纤维化速度[38]。 李雪梅等的研究表明, 在苦杏仁甙的作用下, 大鼠肝组织的活性有明显提升, 肝纤维化状况得到改善[39]。 洪长福等采用苦杏仁甙对矽肺大鼠进行治疗, 发现苦杏仁甙对大鼠矽肺纤维化有明显的抑制作用[40]。
3.1.3 抗菌消炎作用
研究表明, 苦杏仁甙具有一定的抗菌消炎作用。 卢明芳等观察120 位老年胃溃疡患者, 采用口服苦杏仁甙方式治疗, 结果表明, 苦杏仁甙可提高治疗效果, 加快胃炎的痊愈[41]。 蔡莹在小鼠束缚-冷冻应激性胃溃疡实验中发现, 苦杏仁甙对醋酸性胃炎的愈合有明显效果; 大鼠醋酸烧灼溃疡模型则表明, 苦杏仁甙对胃溃疡有防治作用, 且对大鼠关节的肿胀, 有一定的抑制作用[42]。
3.1.4 止咳镇痛作用
研究表明, 苦杏仁甙分解能产生微量的氢氰酸, 可在一定程度上抑制呼吸神经的敏感性, 从而达到止咳作用。 同时, 苦杏仁甙分解产生的苯甲醛可与安息香缩合酶反应生成安息香, 具有一定的镇痛作用。 林国荣用二氧化硫刺激小鼠, 引发咳嗽, 以苦杏仁甙灌胃, 结果表明, 止咳效果明显[10]。 甘露发现, 苦杏仁甙对支气管平滑肌细胞的增殖具有抑制作用, 可用于大鼠镇咳[43]。朱友平等通过小鼠板热法和醋酸扭体法证实苦杏仁甙有一定镇痛作用, 且无副作用[44]。
3.1.5 调节免疫力作用
方伟蓉等发现, 苦杏仁甙可显著降低大鼠胃蛋白酶活性, 具有调节免疫功能的作用[45]。 郭君其等观察了苦杏仁甙对人淋巴细胞增殖的影响, 结果显示, 苦杏仁甙可增强细胞的免疫作用[38]。 郑巧玲等的研究表明, 苦杏仁甙有明显的促进人血T 淋巴细胞PCC 分裂增殖作用[46]。李春华等以小鼠为实验模型, 发现苦杏仁甙对增强机体免疫功能具有一定作用[47]。
3.1.6 抗氧化作用
董捷等的研究表明, 苦杏仁甙对各种自由基的清除具有一定效果, 抗氧化性能明显[48]。 邬晓勇等发现, 苦杏仁甙可有效清除自由基DPPH,当浓度为7.50 mg/mL 时, 对DPPH 的清除率可达90.9%[15]。
3.2 苦杏仁甙的降解
苦杏仁甙在酸性环境或酶的作用下可水解成葡萄糖和野黑樱甙, 野黑樱甙最终可生成苯甲醛和氢氰酸, 如图2 所示。 李强等通过检测水解产物中的葡萄糖含量来研究苦杏仁甙的水解率, 实验表明, 当苦杏仁甙样品中加入5 倍量的0.2 mol/L 的盐酸溶液, 在40℃下反应40 min, 水解率可达到94.62%[49]。 因此, 为了提高检测精度和准确率, 在测定过程中如何抑制苦杏仁甙的酶解和水解将是今后研究的重点。

图2 苦杏仁甙降解过程
苦杏仁甙在动物体内的代谢研究表明, 其在胃中消化酶的作用下, 同样可分解为野黑樱甙和葡萄糖。 野黑樱甙通过肠道菌群的作用分解为苯乙醇腈(杏仁腈), 继而羟基化反应分解成苯甲醛和氢氰酸。 而实验表明, 苦杏仁甙所发挥的生化机理作用, 如抗肿瘤、 抗纤维化、 抗菌消炎、 止咳镇痛、 调节免疫力等, 多数跟其分解的产物有关, 当然, 这还需要通过更多生化机理性的实验来验证。
4 展望
综观上述研究, 苦杏仁甙不仅存在于苦杏仁中, 在枇杷及其他一些蔷薇科植物中也普遍存在, 其代谢产物具有抗肿瘤、 抗纤维化、 抗菌消炎、 止咳镇痛、 调节免疫力及抗氧化等作用。 关于其提纯、 检测、 生化机理等方面的研究也有不少文献报道, 但在某些方面仍存在不足。
4.1 苦杏仁甙提取、 检测方面
近年来, 对苦杏仁甙的提取研究多集中于水浸提、 醇浸提, 而对于超声、 微波等辅助方法涉及较少, 且提取大多在实验室环境下进行, 对提取效率的追求较极致化, 然而关于量化提取的研究则鲜有报道, 今后可加大对量化生产的研究,合理应用超声、 微波辅助技术。 苦杏仁甙检测技术目前已较为成熟, 但苦杏仁甙在酸性环境或酶的作用下容易分解, 会对最终的测定结果造成较大影响, 此问题应引起更大的关注。
4.2 苦杏仁甙生化机理研究方面
对于苦杏仁甙生化机理的研究方面, 目前多处于动物实验阶段, 人体临床研究相对较少。 而对苦杏仁甙功能作用的分子机理还需更深一步的探索, 如: 抗肿瘤机理大多尚未明确, 分解过程所产生的氢氰酸的毒理作用和药理作用仍有待验证, 苦杏仁甙的其他一些代谢产物的鉴定也有待进一步研究。
4.3 苦杏仁甙开发应用方面
苦杏仁甙作为一种广泛分布的天然活性成分, 其开发应用还处于萌芽阶段。 我国蔷薇科植物资源丰富, 如福建莆田作为国内重要的枇杷基地之一, 拥有大量的枇杷资源。 目前, 对于枇杷资源的利用除了果实和一些常见的深加工产品外, 还鲜有其他方面的开发利用。 而苦杏仁甙作为枇杷加工处理过程中的重要附加产物, 在提高产业附加值方面具有广阔的应用前景和市场价值。

