吡虫啉人工半抗原合成方法的优化
钟艺煊 王彦红 杨成根 邹 辉 顾建红 袁 燕 卞建春 刘学忠*
(1.扬州大学 兽医学院/教育部农业与农产品安全国际合作联合实验室,江苏 扬州 225009; 2.扬州大学 化学化工学院,江苏 扬州 225009; 3.江苏高校动物重要疫病与人兽共患病防控协同创新中心,江苏 扬州 225009)
农药是一类多相化学物质,可以通过控制病菌的危害来减少生物毒素的产生和食源性疾病微生物的污染,保障农产品质量安全。20世纪90年代以来,新烟碱类杀虫剂已成为世界上使用最频繁的杀虫剂之一。根据中国农药信息网数据显示,截止到2017年7月,新烟碱类杀虫剂已占据我国杀虫剂市场份额的1/4以上。其中,作为第一代新烟碱类杀虫剂代表的吡虫啉(IMI),使用最为广泛。IMI是一种尼古丁类神经毒性杀虫剂,通过烟碱型乙酰胆碱受体(NAChR)阻断神经传递,导致昆虫麻痹死亡。通常用于农作物、水果和蔬菜中,以防治刺吸式口器害虫。IMI对昆虫具有急性毒性,因其可在哺乳动物体内蓄积,IMI对哺乳动物的亚致死性损伤作用也日益凸显,长期暴露会影响人和动物的免疫系统、生殖系统和神经系统等。目前有研究表明,IMI对非靶标生物体的不利影响,包括对人体的不利影响,取决于暴露量。因此,对于IMI残留的检测显得尤为重要。
目前,新烟碱类农药残留常规检测方法有气相色谱(GC)、高效液相色谱(HPLC)、气相色谱串联质谱(GC-MS)和高效液相色谱串联质谱(HPLC-MS/MS),这些常规检测方法费时耗力,过度依赖仪器和专业检测人员,不适合进行现场检测。因此,人们迫切希望有一种简单、快速、灵敏及价廉的ELISA检测技术能在室外和实验室内进行大批量的筛选试验。
IMI分子量为255.66,是一种小分子物质。只具备反应原性而不具备免疫原性,只有与载体蛋白偶联以后,才具备免疫原性。一般来说,具有活性基团的小分子,可以与载体蛋白直接进行偶联。因为IMI不具备与载体蛋白直接进行偶联的活性基团,与载体蛋白的连接较困难,所以需要先对IMI分子进行衍生。这主要依赖其分子结构中的 3 个活性位点,分别是:吡啶环上α-Cl、咪唑环上亚胺基H原子和-NO。目前,朱国念等和姚蕾珺主要是通过亲和取代反应替换吡啶环上α-Cl;马寅生等和Lee等主要是通过将-NO还原成-NH,使其与载体蛋白直接偶联;通过吸电子效应取代咪唑环上亚胺基H原子这一方法理论可行,实际操作则会大大降低该化合物与乙酰胆碱受体的结合能力。其中,亲和取代反应法最早被用于IMI人工半抗原的合成,且应用最为广泛。半抗原从-Cl衍生简单碳链,对吡虫啉的结构改动小,且Cl原子位于分子识别的远端,能使IMI的抗原决定簇充分暴露,合成半抗原的抗体非常灵敏。
通过亲和取代反应取代IMI吡啶环上α-Cl这一半抗原合成方法以朱国念等发表的最为成熟。虽然此方法为目前最为常用的IMI人工半抗原合成方法,但也存在很多缺点,如:试验过程中使用高危化学试剂,易造成火灾、半抗原合成过程容易产生较多杂质、免疫后小鼠血清抗体效价低等。本研究旨在减少常规IMI半抗原合成方法中杂质的产生,提高免疫后小鼠血清抗体效价,最终提高IMI单克隆抗体制备过程中融合细胞的阳性率,获得高质量、高产量的IMI单克隆抗体细胞株。
1 材料与方法
1.1 试验材料
1
.1
.1
实验动物健康状况良好的7周龄雌性SPF级BALB/c小鼠(编号为202103799),购自常州卡文斯实验动物有限公司。
1
.1
.2
主要试剂及仪器95%的吡虫啉原药(江苏红太阳集团有限公司),N,N’-二环己基碳二亚胺、98% 3-巯基丙酸、N-羟基琥珀酰亚胺(Sigma-Aldrich),4-二甲基吡啶(上海源叶生物科技有限公司),二甲亚砜、薄层层析硅胶版GF254型(扬州必帮生物技术有限公司),氢氧化钾、二氯甲烷、乙酸乙酯等其他试剂为国产分析纯或优级纯。
maXis超高分辨飞行时间质谱仪、AVANCE 600核磁共振波谱仪NMR(Bruker Daltonics),通风厨(扬州天辉钢木制品公司),电热套、化学用升降台(扬州必帮生物技术有限公司),旋转蒸发仪(上海申生科技有限公司)等。
1.2 试验方法
1
.2
.1
试验原理如图1所示:以IMI原药和3-巯基丙酸为原料,在热碱的作用下,通过亲和取代反应,合成IMI人工半抗原。
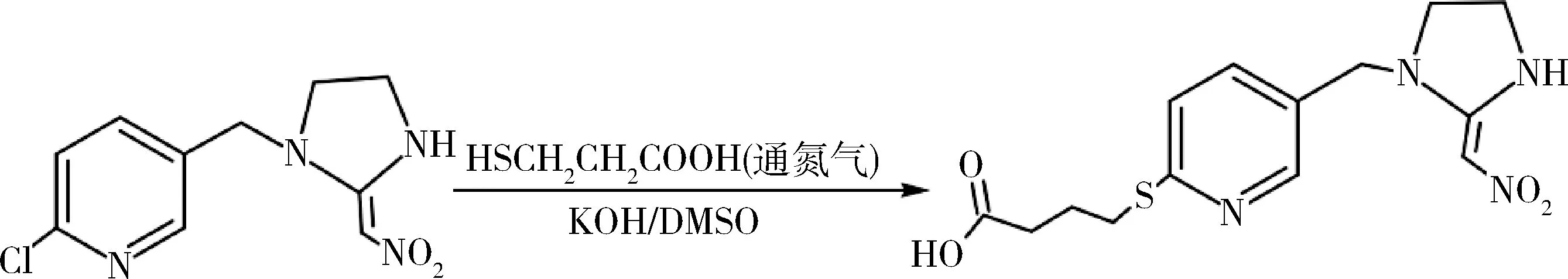
图1 IMI人工半抗原合成路线图Fig.1 Roadmap of IMI artificial semi-antigen synthesis
1
.2
.2
IMI半抗原合成方法的优化IMI半抗原常规合成方法参照朱国念等报道的方法如下:称取IMI 5.15 g,用20 mL DMSO溶解,再加入KOH 2.25 g;另称取3-巯基丙酸2.10 g,用10 mL DMSO溶解;在搅拌下将3-巯基丙酸溶液缓慢滴加到三口烧瓶中,于油浴上使之缓慢升温至100 ℃,保温2 h后;撤去油浴,待产物自然冷却至室温。取反应体系5 mL,加入8 mL双蒸水,以6 mol/L HCL溶液调节pH为3;用4 mL二氯甲烷在分液漏斗中萃取,收集下层。用3 mL NaHCO水溶液萃取,收集上层;用少量乙醚洗涤水相,弃去乙醚层;用6 mol/L HCL溶液调节水相pH为3,然后用3 mL乙酸乙酯分萃取,合并乙酸乙酯提取液。用少量蒸馏水洗涤乙酸乙酯,弃水层。提取液经无水硫酸钠干燥后,减压浓缩。加入少量丙酮溶液溶解,静置过夜,有黄色晶体析出,即为IMI半抗原。
IMI半抗原合成方法的优化(下文称为优化方法)如下:称取IMI 1.3 g于三口烧瓶中,用15 mL DMSO溶解,得到A液;称取筛选出的最适比例的KOH和3-巯基丙酸(专利申请号:CN202110772955.0),用5 mL DMSO溶解,得到B液;打开电热套,将A液缓慢升温至100 ℃;通入氮气;缓慢向其中滴加B液,边加边搅拌;100 ℃保温3 h;撤去电热套,待反应体系冷却至室温。取反应体系5 mL,用8 mL双蒸水溶解,6 mol/L稀盐酸调pH至3.0;用4 mL二氯甲烷在分液漏斗中萃取,收集下层;下层用3 mL NaHCO水溶液萃取,收集上层;上层用3 mL乙酸乙酯萃取,收集下层;下层用6 mol/L稀盐酸调pH至3.0,用3 mL乙酸乙酯萃取,收集上层,产品在上层中。取30 mL产品用DDW萃取后加入1.2 g无水硫酸钠干燥,用旋转蒸发仪蒸发得到IMI半抗原。
1
.2
.3
IMI半抗原结构鉴定IMI半抗原的分子结构采用薄层层析色谱(TLC)法、质谱(MS-ESI)法和核磁共振(H-NMR)法进行确证。
1.2.3.1 薄层层析色谱(TLC)法
采用微量毛细管进行点样。点样前,先用铅笔在薄层板上距末端1 cm处轻轻画一横线,然后用毛细管吸取样液在横线上轻轻点样。将点样的薄层板放在展开剂中展开,待位移至2/3处,取出薄层板。展开后的薄层板干燥后,用紫外光灯照射,检出斑点。展开分离后,化合物在薄层板上的位置用比移值R(溶质移动的距离/溶液移动的距离)来表示。
1.2.3.2 质谱(MS-ESI)法
采用电喷雾串联三重四极杆质谱对IMI人工合成半抗原进行分析, 负离子模式,电喷雾电压3 000 V,毛细管电压为60 V,离子源温度105 ℃,辅助气温度350 ℃,进行一级质谱扫描,获取母离子质荷比,对IMI半抗原进行结构鉴定。
1.2.3.3 核磁共振(H-NMR)法
将合成的IMI人工半抗原用CDSO溶解后扫描其H-NMR谱,根据不同H原子的化学位移和不同位移处NMR谱峰的积分比例,分析合成的IMI人工半抗原中H原子的数目及分布,以确定IMI人工半抗原合成情况。
1
.2
.4
完全抗原偶联鉴定将常规方法合成获得的IMI半抗原和优化方法合成获得的IMI半抗原通过亲和取代反应分别与相同载体蛋白(BSA)进行偶联得到完全抗原。偶联得到的完全抗原(IMI-BSA)进行3 d的透析纯化。采用薄层析色谱法(方法同1.2.3.1),鉴定IMI-BSA是否偶联成功。
1
.2
.5
吡虫啉完全抗原免疫小鼠及血清抗体效价的测定用鉴定后的完全抗原按照表1的免疫程序对7周龄雌性SPF级BALB/c小鼠进行免疫,并于三免和五免7 d之后断尾采血,按照李刚等方法,对小鼠血清采用间接ELISA法测定其抗体效价。
表1 吡虫啉完全抗原免疫小鼠的免疫程序
Table 1 Immunization program in mice immunized with imidacloprid complete antigen
免疫时间Immune time免疫原 Immunogen常规方法Conventionalmethod优化方法Optimizationmethod免疫剂量Immune dose免疫途径Immune route首免First immunizationIMI-BSA+弗氏完全佐剂优化IMI-BSA+弗氏完全佐剂50 μg/0.1 mL/只腹腔注射二免(间隔三周)Second immunization(Three-week interval)IMI-BSA+弗氏不完全佐剂优化IMI-BSA+弗氏不完全佐剂50 μg/0.1 mL/只腹腔+皮下三点注射三免(间隔两周)Third immunization(Two-week interval)IMI-BSA+弗氏不完全佐剂优化IMI-BSA+弗氏不完全佐剂50 μg/0.1 mL/只腹腔+皮下三点注射四免(间隔两周)Fourth immunization(Two-week interval)IMI-BSA+弗氏不完全佐剂优化IMI-BSA+弗氏不完全佐剂50 μg/0.1 mL/只腹腔+皮下三点注射五免(间隔两周)Fifth immunization(Two-week interval)IMI-BSA+弗氏不完全佐剂优化MI-BSA+弗氏不完全佐剂50 μg/0.1 mL/只腹腔+皮下三点注射冲击免疫(融合前3 d)Shock immunity(Three days before integration)IMI-BSA+生理盐水优化IMI-BSA+生理盐水50 μg/0.1 mL/只腹腔注射
2 结果与分析
2.1 半抗原的鉴定
2
.1
.1
薄层层析色谱法检测分析根据图2薄层层析色谱图计算各物质的比移值R(溶质移动的距离/溶液移动的距离),结果显示:IMI、反应体系、有机相和水相的R值分别为0.55、0.23、0.50和0。产品萃取后保留在有机相中,在相同展开剂中,产品的R值与IMI、反应体系、和水相均不相同,且紫外下可见荧光反应,判定IMI半抗原合成成功。
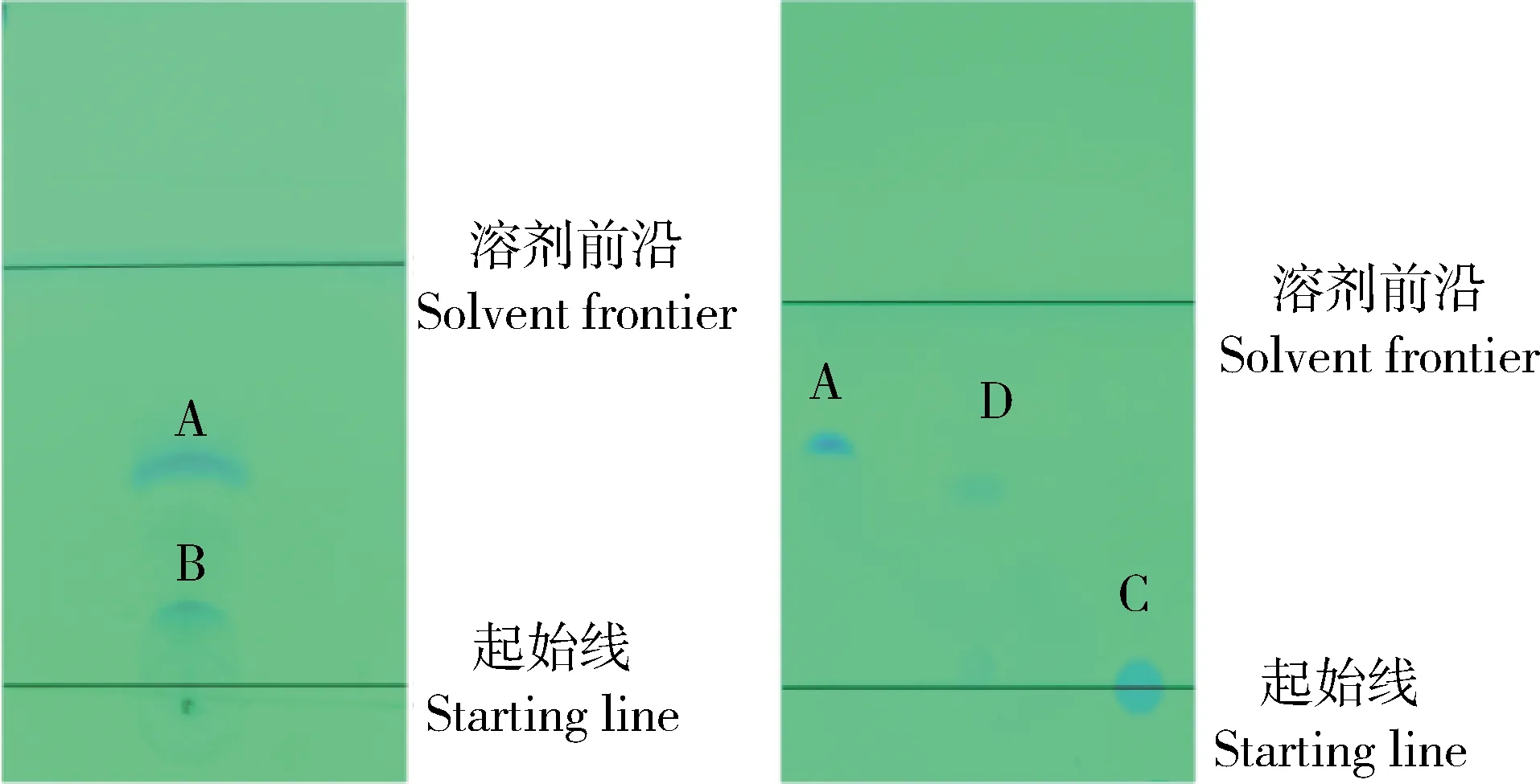
A:IMI;B:反应体系;C:有机相;D:水相 A: Imidacloprid; B: Reaction system; C: Organic phase; D: Aqueous phase图2 TLC法检测半抗原偶联反应Fig.2 TLC method for detection of semi-antigenic coupling reactions
2
.1
.2
质谱法分析结果图3 IMI半抗原质谱法分析结果显示:M,m/z,326,且其余分子离子峰的解释也较为合理,因此可以判断,该碎片离子峰为IMI人工半抗原的分子离子峰[M]。
2
.1
.3
核磁共振法分析结果图4 IMI半抗原核磁共振法分析结果显示,该化合物H-NMR谱(400 MHz,DMSO-D)为:δ12.36 (1H, s, COOH),8.89 (1H, s, NH),8.38~8.39(1H, d, Pry:H),7.52~7.81 (1H, q, Pry:H),8.37~8.98 (1H, t, Pry:H),4.47(2H, s, CH),4.02(2H, q, CH),2.50~2.90 (2H, q, CH),1.24(2H, m, CH),与文献报道的IMI半抗原核磁结果相符。
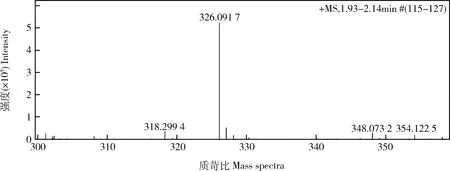
图3 IMI 半抗原质谱图Fig.3 Mass spectrum of imidacloprid hapten
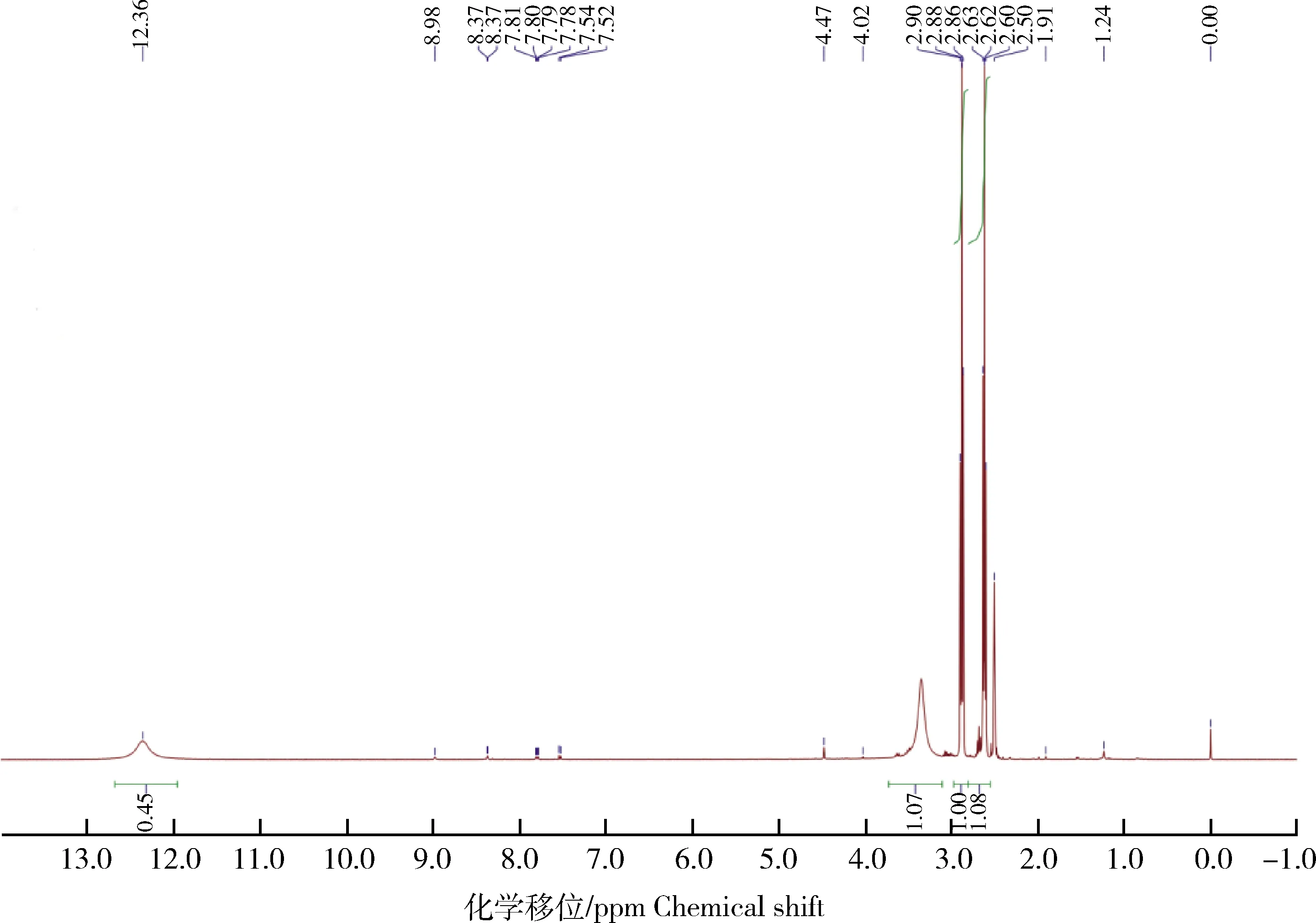
图4 IMI半抗原核磁图Fig.4 Nuclear magnetic resonance (NMR) of imidacloprid hapten
2.2 完全抗原的偶联鉴定
采用薄层层析色谱法对完全抗原偶联过程进行监测。根据图5薄层层析色谱图计算各物质的比移值R(溶质移动的距离/溶液移动的距离),结果显示:IMI-BSA和BSA的R值分别为0.43和0.85。在相同的展开剂下,具有不同的R,判断有新物质生成,而当加入BSA后,经过一段时间样点消失,判断物质偶联完全,可初步验证IMI和BSA反应良好,初步判定IMI-BSA免疫原偶联成功。
2.3 小鼠血清抗体效价测定结果
三免和五免7 d之后断尾采血,测定小鼠血清抗体效价,如图6所示:使用常规方法合成的IMI半抗原进行免疫的小鼠,血清抗体效价在三免后仅达到1∶800,五免后勉强达到1∶12 800;而使用优化方法合成的IMI半抗原进行免疫的小鼠,血清抗体效价在三免后均可达到1∶12 800,五免后可达到1∶51 200。

A:IMI-BSA; B:反应体系 A: Imidacloprid; B: Reaction system图5 TLC法检测完全抗原偶联反应Fig.5 TLC method for detection of complete antigenic coupling reactions
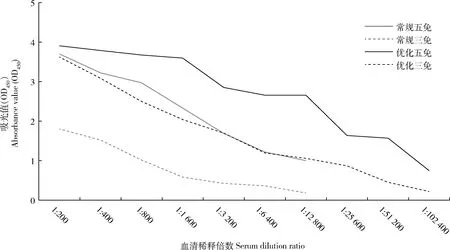
图6 小鼠血清抗体效价测定Fig.6 Detection of antibody titers of mouse serum
3 讨 论
3.1 调整使用试剂对试验安全性的影响
IMI半抗原合成过程,反应需持续加热。常规方法使用油浴加热,导热效果好,能使物质均匀受热且保持恒温,但操作过程需十分谨慎,以防因油外溢而烫伤或因升温过高而引起火灾。优化方法选用恒温电热套代替油浴,升温更快、可控性更好,且可以很好地避免烫伤和失火。
常规方法使用的乙醚等高危化学试剂,操作人员长期低浓度接触会透皮吸收,因毒性蓄积而出现一系列不适症状。优化方法使用乙酸乙酯替换乙醚,降低了化学试剂对试验人员的毒性,提高了试验操作的安全性。
3.2 调整反应顺序和试剂比例对半抗原合成过程杂质产生的影响
常规IMI半抗原合成方法,虽然能够得到最终产品,但合成的半抗原含杂质较多,会产生较多3-巯基丙酸的氧化副产物和其他碎片离子。并且,在普通实验室,每次合成的半抗原数量有限,往往需要进行多次重复试验才可获得足够量的半抗原进行下一步试验。
优化方法在3-巯基丙酸加入反应之前预先通入氮气,并维持到整个反应结束,以此排出氧气,一定程度减少了氧气与3-巯基丙酸发生反应而产生氧化副产物。同时,筛选出最适3-巯基丙酸反应比例,一方面保证3-巯基丙酸能够完全反应,保证IMI人工半抗原的产量,另一方面防止3-巯基丙酸过剩而与其他物质反应生成氧化副产物或者有大量3-巯基丙酸残留而产生过多的杂质。优化方法质谱结果显示质荷比为326的峰是IMI半抗原的分子离子峰,符合质谱分析中有机物的含氮规则。相较于李广领的方法,其余碎片离子峰数量有了很大程度的减少。一方面,说明优化方法合成的半抗原杂质减少,另一方面,溶剂峰的减少和下降,也说明了IMI半抗原合成反应更为彻底。优化方法核磁结果与文献报道相符,相较于朱国念等的方法,12.36处的3-巯基丙酸的氧化副产物峰明显下降,说明3-巯基丙酸的氧化副产物减少,进一步说明优化方法合成的人工半抗原杂质减少。但是,由于专业纯度检测仪器的限制,尚未准确测出半抗原纯度,具体提升值尚不明确,后续可作进一步检测。
3.3 优化方法对免疫后小鼠血清抗体效价的影响
单抗制备过程中动物的免疫效价,会影响其产生特异性抗体的能力,同时也影响单抗的大量生产。若半抗原偶联数量过多, 会因抗原过量而产生免疫耐受;若半抗原偶联数量过少, 则会因抗原不足而不产生抗体。所以, 小分子抗原偶联到载体的数量要适中, 才能使免疫后的小鼠产生高效价的抗体。
使用优化方法合成获得的半抗原与载体蛋白偶联得到完全抗原,用偶联的完全抗原免疫小鼠,三免后,小鼠血清抗体效价均可达到1∶12 800;五免后,小鼠血清抗体效价达到1∶51 200。使用常规合成方法偶联获得的完全抗原免疫小鼠,五免后,小鼠血清抗体效价仅达到1∶12 800。李刚等使用常规合成方法偶联获得的完全抗原免疫小鼠,小鼠血清抗体效价最高达到1∶12 800。说明优化方法可以刺激小鼠更稳定地产生更高滴度的抗体。小鼠血清抗体效价越高,其针对抗原的特异性抗体浓度则越高,细胞融合后筛选出阳性的概率也越大,所以单抗制备过程中,提高小鼠抗体效价十分重要。不仅免疫的抗原能影响免疫就小鼠血清抗体效价,不同的免疫途径和免疫剂量也会使免疫后小鼠效价发生改变。后续可改变免疫的途径和免疫的剂量,进一步筛选出一套可以刺激小鼠更稳定地产生更高效价的免疫程序,使整个免疫流程更为高效、便利。
4 展 望
本研究通过调整半抗原合成过程反应顺序和筛选最适3-巯基丙酸反应比例,在相对安全的试验环境下,减少了IMI人工半抗原合成过程中杂质的产生,一定程度上提高了IMI人工半抗原纯度。免疫后,小鼠能产生更高滴度的抗体。后续可继续进行IMI单克隆抗体的制备,研究更高滴度的抗体是否能够刺激小鼠产生更多的B淋巴细胞用于后续细胞融合,从而提升细胞融合后的阳性率,获得更高质量的IMI单克隆抗体细胞株。最终,建立起能在室外和室内进行大批量筛选试验的简单、快速、灵敏及性价比高的ELISA检测技术。

