长链非编码RNA在胰腺癌发生发展中的作用
王柏清,王珏磊,张宝芹,李甜甜,王 超,孙光斌
王柏清,王珏磊,张宝芹,李甜甜,王超,孙光斌,天津市第五中心医院消化科 天津市 300450
0 引言
胰腺癌发病隐匿,死亡率高,早期难以诊断.胰腺癌诊断相关的标志物,包括癌胚抗原、糖类抗原199、糖类抗原242和某些microRNAs等,其特异性和敏感性相对较低,限制了在胰腺癌诊断和预后判断中的临床应用.近年越来越多的研究发现,LncRNA是胰腺癌发病机制中的一个关键因素,可能在胰腺癌的发生发展中发挥着重要的作用.本文就LncRNA在胰腺癌发生发展中的作用作一综述.
1 长链非编码RNA概述
编码蛋白质的基因在整个基因组序列中所占的比例不到2%,剩下的大部分基因组不编码任何蛋白质,被称为非编码RNA (non-coding RNA,ncRNA).其中大于200个核苷酸的称为长链非编码RNA (long non-coding RNA,LncRNA).LncRNA不编码蛋白质的RNA,与环状RNA不同,LncRNA具有5′端帽和3′端多聚腺苷酸尾,类似于mRNA,但没有编码蛋白的能力,主要分布在细胞核和细胞质内,以RNA形式在多种层面上(如表观遗传学、转录等方面)调控基因的表达水平.尽管LncRNA不能编码任何功能性蛋白,但它们参与了多种生物学过程,在维持细胞生长、分化和增殖中发挥着重要作用.
1.1 分类 LncRNA根据与编码基因的相对位置可分为五类.(1)正义LncRNA:与相同链的另一个蛋白质编码基因的一个或多个外显子相重叠;(2)反义LncRNA:与相反链的另一个蛋白质编码基因的一个或多个外显子相重叠;(3)双向LncRNA:转录起始位点与相反链上编码蛋白质基因的转录起始位点非常接近,但转录方向相反;(4)基因内LncRNA:来源于次级转录物的内含子区域;(5)基因间LncRNA:来源于两个基因之间的区域.
1.2 LncRNA的作用模式 LncRNA的作用模式有很多种分类方法,主要分为四大类.(1)信号:作为一种信号转导分子,LncRNA会被特异性转录并参与特定信号通路的传递,从而调控下游基因的转录;(2)诱饵:LncRNA被转录后,可与DNA结合蛋白结合,阻断蛋白分子的作用,调节下游基因的表达;(3)引导:LncRNA与蛋白质结合后,可将蛋白质复合物映射到特定的DNA序列;(4)支架:LncRNA可以作为支架,引导两种或两种以上的蛋白质组装形成蛋白质复合物,可实现信号之间的整合.
在细胞质中(图1),LncRNA通过RNA-蛋白质(如NRON和Lnc-DC)或RNA-RNA(如Uchl1-AS和linc-MD1)相互作用发挥作用.NRON和Lnc-DC作为转录因子NFAT和STAT3的分子支架.Uchl1-AS通过碱基切割与靶基因相互作用以增强其翻译.在细胞核中(图2),LncRNA可以与蛋白质相互作用作为指导(如lincRNA-EPS:hnRNPL),支架(如RMRP与DDX5和RORγt的相互作用,Morrbid与PRC2相互作用)或诱饵分子(例如:NF-κB p65)介导其分子功能.

图1 长链非编码RNA(long non-coding RNA,LncRNA)在细胞质中的作用模式. 在细胞质中,LncRNA通过RNA-蛋白质(如NRON和Lnc-DC)或RNA-RNA(如Uchl1-AS和Linc-MD1)相互作用发挥作用.NRON和Lnc-DC作为转录因子NFAT和STAT3的分子支架.Uchl1-AS通过碱基切割与靶基因相互作用以增强其翻译.
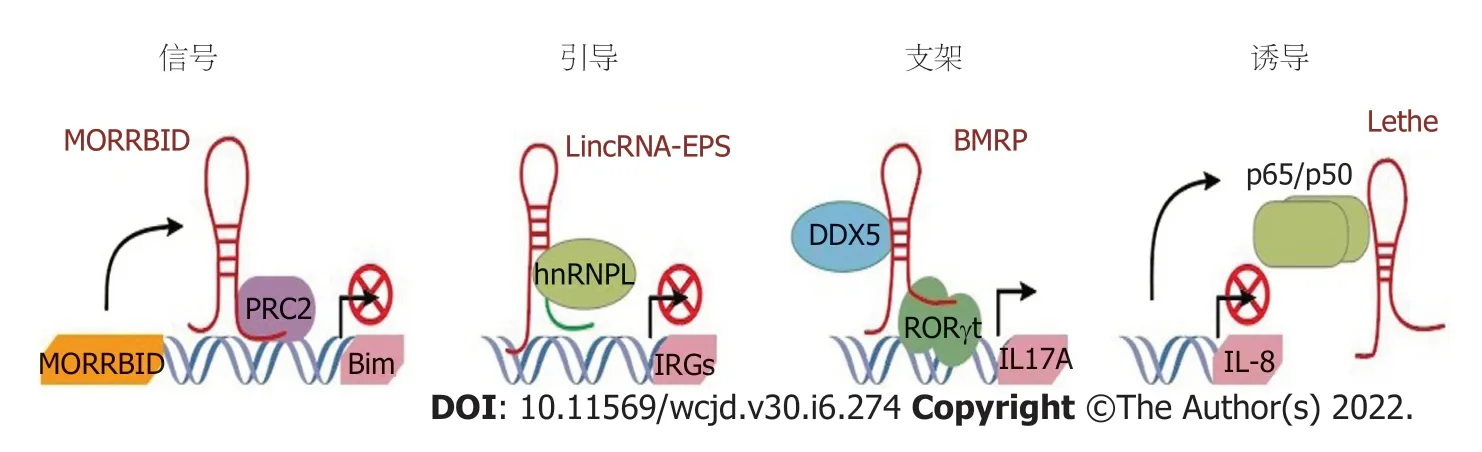
图2 长链非编码RNA (long non-coding RNA,LncRNA)在细胞核中的作用模式.在细胞核中,LncRNA可以与蛋白质相互作用作为指导(如LincRNA-EPS与hnRNPL),支架(如RMRP与DDX5和RORγt,Morrbid与PRC2)或诱饵分子(如NF-κB p65)介导其分子功能.
2 LncRNA与胰腺癌发生、发展的关系
胰腺癌死亡率高,一些血清肿瘤生物标志物如糖类抗原-199,糖类抗原242与癌胚抗原已被用于检测胰腺癌,但是由于阳性预测值低,目前不是一种理想的肿瘤早期诊断指标.因此寻找一种新的肿瘤生物标志物和治疗靶点,对胰腺癌的早期诊断和预后预测具有重要意义.近来的研究表明,LncRNA在肿瘤生物学中有多种功能,可通过多种机制和途径促进或抑制胰腺癌的发生发展,有望作为胰腺癌诊断的生物标记物和治疗靶点它们可能作为肿瘤早期诊.本文汇总了一些与胰腺癌有关的LncRNA,以及它们的作用机制及其潜在的临床价值,以期在胰腺癌的诊治上提供新的思路.
2.1 LncRNA对细胞周期的影响 无限增殖能力是肿瘤细胞最大的特点之一,研究发现LncRNA 在某些肿瘤(包括胰腺癌)的增殖过程中起重要作用.
2.1.1 HOX转录反义RNA:HOX转录反义RNA (HOX transcript antisense RNA,HOTAIR),作为HOX反义基因间RNA,由2158个核苷酸组成,以反转录方式调节基因表达,可以与PRC2结合,导致组蛋白甲基化和HOXD位点转录沉默.在胰腺癌中,具有原癌基因的HOTAIR的表达上调可能通过染色质环和竞争性抑制等机制,促进细胞增殖,调节细胞周期,抑制癌细胞凋亡.Ma等发现,胰腺癌患者的HOTAIR和己糖激酶2(hexokinase,HK2)血清水平更高.这两个因素的血清水平可用于准确预测胰腺腺癌及其预后.HOTAIR和HK2的过表达导致肿瘤细胞增殖的促进,LncRNA HOTAIR可能通过上调HK2来促进胰腺癌癌细胞能量代谢.Kim等研究提示,HOTAIR可通过其5′端与EZH2结合,EZH2在胰腺癌中的表达增加,如果EZH2表达下调,则具有抗肿瘤作用的miRNA,包括miR-34a的表达增加.而敲除HOTAIR后,EZH2对miR-34a的抑制作用减弱,这也为胰腺癌的靶向治疗提供了新的途径.
2.1.2 HOXA末端转录本反义RNA:HOXA末端转录本反义RNA (HOXA transcript at the distal tip,HOTTIP)是HOXA基因远端转录生成的一类长链非编码RNA.研究显示HOTTIP是胰腺癌组织中最显著上调的LncRNA之一,敲除HOTTIP可通过改变细胞周期导致细胞增值停滞,并抑制上皮间质转化减弱肿瘤细胞侵袭能力.Wong等研究提示非经典的反式HOTTIP-WDR5-MLL1途径在HOTTIP调控机制中通过促进致癌蛋白表达具有重要意义.此外,HOTTIP受胰腺癌细胞中的miR-497调控,HOTTIP与胰腺癌组织中的miR-497水平呈负相关;由于抑制性miR-497的缺失,HOTTIP在胰腺癌组织中表达上调.HOTTIP还通过经典的HOTTIP-HOXA13轴促进胰腺癌的进展.也有研究报道,R N A干扰(siHOXA13)对HOXA13的敲除显示HOTTIP至少部分通过调节HOXA13促进肿瘤细胞增殖、侵袭和化疗耐药.HOTTIP可以和WDR5/MLL复合体结合,沉默HOTTIP基因,抑制HOXA 5′端基因表达.LncRNA HOTTIP可以通过调节AURKA蛋白激酶的表达,影响胰腺癌细胞周期,在胰腺癌的发生发展起重要作用,有望成为胰腺癌特异性治疗和预后的靶向标志物.
2.1.3 生长抑制特异性基因5:细胞凋亡是细胞程序性死亡的一种生理过程,是细胞发育和维持体内平衡中不可缺少的一环,而凋亡通路的异常是肿瘤细胞的一个重要特征.生长抑制特异性基因5(growth arrest-specific transcripts 5,GAS5)在进化过程中结构和功能高度保守,其家族成员众多,它们的基因编码产物在微丝组装、细胞生长分化或凋亡、细胞周期调控等方面都具有重要功能.有研究报道,GAS5作为一种细胞周期调节因子,在胰腺癌组织中的表达显著降低,GAS5的过表达可显著抑制胰腺癌细胞的增殖.Liu等研究提示,LncRNA GAS5充当miR-221的竞争内源RNA,通过直接结合并抑制miR-221的表达并增强细胞因子信号传导的抑制作用,从而抑制胰腺癌细胞的增殖、迁移和吉西他滨耐药性、干细胞样特性和上皮-间质转化.Lu等人发现GAS5可能通过调节细胞周期蛋白依赖激酶6的表达来诱导G1/S期转换,抑制GAS5表达可显著降低G0/G1期表达,增加S期表达.
2.1.4 NUTF2P3-001:Li等研究发现,LncRNANUTF2P3-001与鼠类肉瘤病毒癌基因(kirsten rat sarcoma viral oncogene,KRAS) mRNA表达呈正相关,在胰腺癌中过度表达.低氧诱导的LncRNA-NUTF2P3-001通过抑制miR-3923/KRAS途径促进胰腺癌的发生.LncRNANUTF2P3-001和KRAS mRNA的3′端非转录区域(UTR)序列与mir-3923具有竞争性结合关系,mir-3923抑制剂也能消除LncRNA-NUTF2P3-001所引起的肿瘤抑制作用,使KRAS表达降低,胰腺癌细胞的增殖和侵袭在体内外均受到明显抑制.
2.2 LncRNA对浸润和转移的影响 侵袭和转移是恶性肿瘤最主要的生物学特征,也是导致患者死亡的主要原因,LncRNA在多个层面参与其中.
2.2.1 ENST00000480739:ENST000480739位于12号染色体上.Sun等发现,与相应的邻近非肿瘤组织相比,胰腺癌中的LncRNA enst0000480739表达水平显著降低,与胰腺癌患者预后呈负相关.进一步分析表明,LncRNA在肿瘤转移中的这种调节作用可能是通过上调骨肉瘤放大基因-9(recombinant osteosarcoma amplified 9,OS-9),一种与缺氧诱导因子1 (hypoxia inducible factor 1,HIF-1)和HIF-1α-脯氨酰羟化酶相互作用的蛋白,胰腺组织中HIF-1的过度表达在肿瘤细胞对缺氧的适应以及侵袭和转移中起着关键作用.LncRNA-enst0000480739/OS-9/HIF-1通路有望成为治疗胰腺癌的靶向药物途径.
2.2.2 人肺腺癌转移相关转录本1:人肺腺癌转移相关转录本1(metastasis associated in lung denocarcinoma transcript 1,MALAT-1)位于11q13染色体上,8700个核苷酸的长度,属于基因间转录,是一种进化上高度保守的LncRNA.MALAT1由多个启动子控制转录,研究证实,MALAT-1的表达在胰腺癌细胞中更高,抑制MALAT-1降低MMP-2和MMP-9基因的表达,下调包括锌指转录因子Snail、Slug,神经型钙黏蛋白(N-cadherin)和波形蛋白(Vimentin)在内的EMT生物标记物,并显著上调上皮型钙黏蛋白(E-cadherin)的表达.MALAT1通过mir-217影响KRAS蛋白的水平,MALAT1基因敲除可抑制胰腺癌细胞增殖,促进细胞凋亡,阻断细胞周期从G0/G1期向S期的转变,抑制细胞侵袭.
2.2.3 H19:H19位于染色体11q15.5上,约2.3 kb,是一个重要的与胰腺癌相关的 LncRNA.最近的研究报道H19通过miR-675促进肿瘤转移,加速上皮-间充质转化(EMT)进程.H19在癌组织中表达上调,在有转移的原发性肿瘤中的表达水平也高于无转移的肿瘤.H19可以拮抗let-7,增加HMGA2介导的EMT,H19表达降低会明显减少胰腺癌的侵袭和转移.Wnt信号通路在癌症发病机理中的关键作用已得到广泛认可.细胞周期蛋白依赖性激酶14诱导的低密度脂蛋白受体相关蛋白5/6磷酸化是Wnt信号激活中的重要途径.Sun等研究提示,在胰腺癌组织中,H19表达上调;H19敲低抑制胰腺癌的细胞增殖和迁移,LncRNA H19可以激活癌症中的Wnt信号传导,H19/miR-194轴通过PFTK1下游Wnt信号传导调节胰腺癌细胞的增殖和迁移.
2.3 LncRNA对血管生成的影响 血管内皮生长因子(vascular endothelial growth factor,VEGF)是一种具有高度生物活性的二聚体阳离子糖蛋白,可特异性地作用于血管内皮细胞,使之增殖、迁移、血管形成.VEGF可通过增加血浆酶原活化因子和血浆酶原活化因子抑制因子-l的mRNA表达,促进新生毛细血管的形成.VEGF是最强的可增加血管通透性的物质之一,可以诱导血浆蛋白溶酶原激活物和血浆溶酶原激活物抑制剂-1,以及基质胶原酶、诱导组织因子等在内皮细胞的表达,激发V3因子从内皮细胞中释放出来,从而改变细胞外基质,使其更易于血管生长.VEGF是血管生成最重要的一类因子,研究发现,抑制PI3K/AKT和MAPK/ERK1/2细胞信号通路能够下调VEGF蛋白表达,进而抑制肿瘤新生血管的生成及浸润转移能力,在一定程度上能预测肿瘤的大小和评估治疗效果.
3 LncRNA在胰腺癌耐药的作用及相关机制
胰腺癌发病隐匿,早期不易发现,多数患者就诊时已经失去了手术机会.化疗是改善不能手术的患者预后的重要手段.然而,胰腺癌患者很容易对化疗产生耐药性.以吉西他滨为基础的单一治疗或联合治疗不会显著延长患者的总生存时间.因此,寻找新的分子标记物对提高胰腺癌的早期诊断率,探索耐药的分子机制对提高胰腺癌的治疗效果具有重要意义.
LncRNA MEG3在许多恶性肿瘤中被证实是一种肿瘤抑制因子.Zhou等构建了PVT1过表达胰腺癌细胞系,发现耐药细胞的PVT1水平高于对照组,PVT1的敲降恢复了胰腺癌细胞对吉西他滨的敏感性,而PVT1过表达则增加了耐药性,提示高水平的PVT1在体外和体内均可促进胰腺癌细胞对吉西他滨的耐药性.Ma等评估了MEG3在25例胰腺癌组织和8个细胞系中的表达模式,在癌组织和癌细胞系中均观察到MEG3表达缺失.MEG3基因敲除可促进细胞增殖,促进细胞迁移和侵袭,诱导上皮-间充质转化,提高成球能力和肿瘤干细胞特性,降低体外对吉西他滨的化疗敏感性.Xiong等发现,GSTM3TV2通过竞争let-7,上调L型氨基酸转运蛋白2和氧化型低密度脂蛋白受体,从而增强吉西他滨耐药性.在吉西他滨耐药细胞中过表达的GSTM3TV2在体外和体内均可增强胰腺癌细胞对吉西他滨的耐药性.Yang等发现在吉西他滨耐药的胰腺癌细胞中,SLC7A11-AS1的过表达可以通过阻断SCFβ-TRCP介导的NRF2泛素化和降解来清除活性氧(reactive oxygen species,ROS),从而导致细胞内ROS的水平低,这是维持癌症的必要条件.SLC7A11-AS1可能作为克服吉西他滨对胰腺癌治疗的耐药性的治疗靶标.钟岳等发现,LncRNA MIR31HG在胰腺癌组织及胰腺癌细胞中均高表达,MIR31HG可能通过调控C-myc基因来影响胰腺癌细胞的增殖、迁移和耐药.下调MIR31HG表达可对胰腺癌细胞的迁移和增殖产生抑制作用,增强胰腺癌细胞对5-氟尿嘧啶的敏感性,降低其对5-氟尿嘧啶的耐药性.
4 LncRNA对胰腺癌治疗的影响
LncRNA广泛地参与到肿瘤的发生发展,基因靶向治疗已经显示出巨大的发展前景,已成为最有效和最有前途的医学治疗手段之一.最近研究表明,LncRNA在表观遗传调控中的多重生物学功能,可能是胰腺癌潜在的肿瘤生物标志物和治疗靶点.
LncRNA作为肿瘤调节分子的重要性细胞周期使其成为一个有吸引力的治疗靶点,因此,有必要找到调节LncRNA的方法.等位基因特异性寡核苷酸(allele-specific oligonucleotide,ASO)的工作原理是与RNA杂交,然后阻断RNA的作用.到目前为止,美国食品和药物管理局批准了两种ASO作为药物:用于治疗巨细胞病毒性视网膜炎的福米韦森和用于治疗纯合家族性高胆固醇血症的米波美森.通过研究LncRNA的异常表达及其调控机制,可以通过调节异常表达的RNA进而设计靶向药物或提高化疗药物对胰腺癌敏感性,为胰腺癌的治疗提供新的途径.H19是最早应用于胰腺癌治疗的LncRNA.有研究表明,H19调控下可以表达白喉毒素A链质粒载体BC-819,其具有抗肿瘤作用,吉西他滨与BC-819联合应用于动物模型中,可以缩小动物体内肿瘤体积,BC-819局部联合全身化疗可为胰腺癌的治疗提供额外的疗效.
5 展望
胰腺癌缺乏有效的早期诊断和治疗方法,近年来研究发现LncRNA在肿瘤中有差异表达,在胰腺癌的早期诊断和治疗中具有巨大的潜力.但有关LncRNA的具体机制和调控方式尚不明确,对其功能和调控机制的进一步研究将有助于胰腺癌的早期诊治.有理由相信,随着对生物学功能和作用机制研究的深入,我们对LncRNA在胰腺癌中的认识将进入一个新的阶段,这将为胰腺癌的早期诊断和治疗提供新的视角.

