食管鳞癌干细胞电离辐射抵抗的研究
沈燕如 李磊
(1.西藏大学附属阜康医院消化内科;2.西藏大学附属阜康医院实验室,西藏 拉萨 850000;3.郑州大学人民医院肿瘤科,河南 郑州 450000)
2018 年《全球癌症报告》统计显示食管癌的全球发病率在恶性肿瘤中位居第7 位,2018 年约有57.2 万新发病例,死亡病例约50.8 万[1]。2018 年国家癌症中心发布的全国癌症统计数据显示,2014年在我国肿瘤登记地区食管癌发病率为18.85/10 万(新发病例约25.8 万例),同期死亡率为14.11/10 万(死亡病例约19.3 万例)[2]。超过90%的食管癌组织学类型是食管鳞状细胞癌,且超过90%的患者确诊时已进展至中晚期[3]。放疗及化疗是食管鳞癌的重要治疗方式,其中紫杉醇是食管鳞癌的常用化疗药物,但紫杉醇耐药和电离辐射抵抗严重影响放化疗的治疗潜力,因此紫杉醇耐药机制和电离辐射抵抗的研究可能为食管鳞癌靶向治疗提供新方向。近年来,随着肿瘤干细胞学说不断进步发展,肿瘤干细胞(Cancer stem cells,CSCs)被认为是导致肿瘤对放疗和化疗抵抗的重要原因。本研究中,我们诱导出对紫杉醇耐药的食管鳞癌干细胞样细胞,探讨CSCs的电离辐射抵抗特性及机制。
1 材料与方法
1.1 细胞培养及紫杉醇耐药细胞株的诱导
将人食管鳞癌细胞株EC109 细胞(中科院上海细胞库)加入含10%胎牛血清(杭州四季青有限公司)、1%谷氨酰胺和100U/mL 青霉素及链霉素(华北制药股份有限公司)的RPMI1640 培养液(美国Gibco 公司),置于37℃、5%CO2培养箱中孵育细胞。每24 小时观察细胞生长情况,每2 天更换培养液。取EC109细胞,加入0.625μg/mL 紫杉醇(该浓度为紫杉醇对EC109 细胞半数抑制浓度的10 倍余)2 小时,弃培养液。磷酸盐缓冲液洗3 次,0.25%胰蛋白酶(美国Amresco 公司)消化,离心5 分钟,弃上清。重新加入RPMI1640 培养液,接种培养瓶中培养。24 小时后去除死亡细胞,扩增活细胞至80%~90%细胞密度,传代培养3 代。重复上述实验步骤2 次。然后,增加紫杉醇诱导时间至4 小时,重复上述实验步骤3 次。最后诱导出紫杉醇耐药细胞株RR-EC109。
1.2 MTT法检测耐药稳定性
将RR-EC109细胞和EC109细胞按每孔7×103个细胞接种于96孔板中(预先每孔加入100μL培养液)。24 小时后,给药组每孔加入100μL 含0μg/mL、0.0125μg/mL、0.025μg/mL、0.05μg/mL、0.1μg/mL、0.5μg/mL、1μg/mL 和10μg/mL 共8 个浓度梯度的紫杉醇的培养液(每个浓度梯度设6个平行孔)。而对照组每孔加入100μL 培养液。48 小时后,每孔加入20μL四甲基偶氮唑蓝(MTT)溶液(美国Sigma公司),4小时后弃上清,每孔加入150μL二甲基亚砜(美国Sigma公司),振荡10min。采用酶联免疫检测仪测定490nm 波长处其光密度OD值。计算不同浓度紫杉醇作用下的细胞半数抑制浓度(IC50)和耐药指数(RI)。RI=耐药细胞IC50/亲本细胞IC50。后分别在撤药第30d、60d、90d、120d重复上述步骤。
1.3 成球实验
配制DMEM/F12 培养液(美国Hyclone 公司),其中表皮生长因子(美国Peprotech 公司)为20ng/mL,成纤维细胞生长因子(美国Invitrogen 公司)为10ng/mL,B27 为1%.取RR-EC109 细胞和EC109 细胞,以每孔5000 个细胞接种于超低粘附6 孔板中(两种细胞各3孔),每2 天换半量的成球实验培养液。10 天后,观察RR-EC109 细胞和EC109 细胞的成球情况,显微镜下计数>20个细胞的细胞球数量。
1.4 克隆增殖实验
取RR-EC109 细胞和EC109 细胞,每瓶600 个细胞接种到25cm2细胞培养瓶中,RR-EC109 细胞和EC109细胞各3瓶。37℃、5%CO2培养箱孵育,每24小时观察细胞生长情况。每2 天更换培养液。10 天后甲醇固定细胞,结晶紫染色贴壁细胞,计数>50 个细胞的克隆细胞数量。
1.5 侧群分选
取RR-EC109 细胞和EC109 细胞于培养瓶培养至90%细胞密度,胰蛋白酶消化。离心5 分钟,加磷酸盐缓冲液冲洗,重复2次。RPMI1640液(37℃预热)稀释细胞至106/mL。将两种细胞各分为两组,实验组:加入维拉帕米液(美国Sigma 公司)至终浓度50uM,30 分钟后加入Hoechst33342(美国Sigma 公司)至终浓度5μg/mL;而对照组:直接加入Hoechst33342至终浓度5μg/mL。90 分钟后各加5 倍磷酸盐缓冲液混匀,离心10 分钟,加入2mL 磷酸盐缓冲液。使用流式细胞仪分析各组中侧群(Sphere formation,SP)细胞含量。通过Hoechst33342 双参数分析(蓝光450/50nm,红光660/20nm,紫外激发波长355nm),以红光为X轴、蓝光为Y轴。
1.6 电离辐射抵抗
取对数生长期的RR-EC109 和EC109 细胞,各设假照组及2.0、4.0、6.0和8.0Gy4个照射组,分别按600、1000、2000、6000 和8000 个细胞接种于培养瓶中,每组3 个平行试验瓶。接种12h 待细胞贴壁生长后,将培养瓶转移至西门子医用电子直线加速器产生的6MV X 射线照射,照射剂量率为100cGy/min。照射处理后,更换培养液,放回培养箱继续培养10d(每3d 更换培养液),弃培养液,使用100%甲醇固定细胞5min,0.5%结晶紫染色细胞5min。显微镜下计数各组存活的细胞克隆数目,计算细胞接种效率(PE=假照组实际细胞克隆数/假照组接种细胞数)和照射组细胞存活分数(SF=照射组实际细胞克隆数/(照射组接种细胞数×PE))。
根据实验所得细胞存活数据建立细胞存活分数与辐射剂量之间单击多靶模型,通过非线性回归拟合分析得出拟合曲线方程,表达式为:SF=1-(1-e-kD)n。k:细胞存活曲线的钝化常数。n:外推数。D0:平均致死剂量(理论上使每个细胞平均被击中1 次所需要的辐射剂量)。D0=1/k;Dq为准阈剂量(克服单击多靶曲线中“肩宽”的剂量,代表修复亚致死损伤的能力)。Dq=D0×ln n;D37为细胞37%存活分数时相应的辐射剂量。D37=D0+Dq。SER 为放射增敏比,SERDq是由Dq评价辐射敏感性差异,SERDq=Dq(对照组)/Dq(实验组)。
1.7 细胞周期调控检控点基因表达情况
提取RR-EC109 细胞和EC109 细胞总RNA。测定RNA 浓度,鉴定纯度及完整性。将RNA 反转录合成cDNA。最后进行定量PCR 反应(引物序列见表1),取12.5μL 2×SYBR green I master mix、8.5μL ddH2O、2μL cDNA、1μL 10mM 的正义链和1μL 10mM的反义链进行PCR 反应。反应条件为95℃预变性30s;95℃变性5s,60℃退火30s(变性和退火重复45次);最后72℃延伸33s。PCR 反应后马上进行熔解曲线分析,95℃15s,60℃30s,随后65℃开始每增加0.5℃保持15s,逐步增加到95℃。采用2-△△Ct法计算基因相对表达量。

表1 定量聚合酶链式反应基因引物序列
1.8 统计学方法
2 结果
2.1 耐药细胞的诱导
RR-EC109 细胞是通过高剂量间歇诱导+时间递增的方式诱导,整个过程历时7个月。加入紫杉醇后,多数RR-EC109 细胞死亡,极少数的RR-EC109 细胞仍贴壁生长。第二阶段紫杉醇诱导时间增加至4 小时,死亡细胞明显减少,恢复增殖状态加快。
2.2 耐药稳定性的检测
RR-EC109 细胞IC50 为(3.578±0.089)μg/mL;EC109 细胞IC50 为(0.068±0.003)μg/mL(P<0.001)。RR-EC109细胞对紫杉醇RI为67.258,属于高度耐药。在诱导结束30d、60d、90d、120d后分别检测,RR-EC109细胞对紫杉醇的IC50维持在3.5μg/mL左右,RI维持在67左右,显示RR-EC109细胞的耐药稳定性良好。
2.3 成球能力
RR-EC109 细胞的成球率(13.2±2.1%)高于EC109细胞的成球率(7.6±1.7%),差异有统计学意义(P<0.01)(见图1)。
2.4 克隆增殖能力
RR-EC109 细胞克隆增殖能力为(65.2±4.1%),EC109 细胞克隆增殖能力为(36.8±3.9%),差异有统计学意义(P<0.05)(见图1)。
2.5 侧群细胞含量
RR-EC109 细胞中SP 细胞含量为5.8%,EC109细胞中SP 细胞含量为2.3%,差异有统计学意义(P<0.05)。预先加入ABC 转运体抑制剂维拉帕米的RR-EC109 和EC109 细胞中基本没有侧群细胞,分别为0.00%和0.04%,与未加维拉帕米组之间差异有统计学意义(P<0.05)(见图2)。
2.6 电离辐射抵抗
通过克隆存活实验比较RR-EC109 和EC109 细胞在不同剂量辐射下细胞克隆增殖能力的差别,结果显示细胞死亡呈现剂量依赖性。能评价恶性肿瘤细胞放射敏感性的一个重要指标是2Gy 辐射下的平均存活分数SF2,RR-EC109 和EC109 细胞的SF2分别为0.567 和0.483,两者差异有统计学意义(P<0.05)(见表2)。Dq表明细胞受到亚致死损伤后的修复能力,RR-EC109 细胞的Dq值(0.545±0.042)高于EC109 细胞的Dq值(0.367±0.021),差异有统计学意义(P<0.05)。SER 可评价肿瘤细胞辐射敏感性的差异,SERDq=0.673±0.214,SERDq<1 表明RR-EC109 细胞的电离辐射抵抗高于EC109细胞(见表3)。建立单击多靶细胞存活模型后,通过SPSS 软件拟合细胞存活曲线(见图3)。
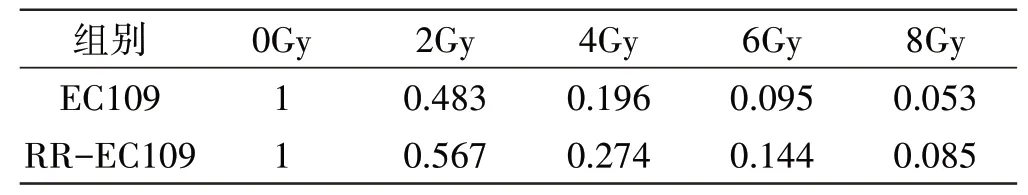
表2 RR-EC109和EC109细胞在不同剂量辐射下的平均存活分数
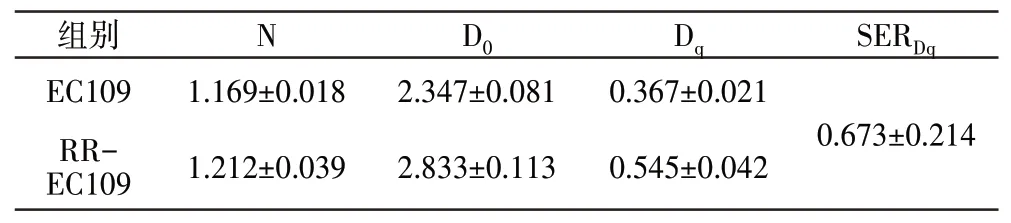
表3 RR-EC109和EC109细胞的放射生物学参数
2.7 细胞周期调控检控点基因表达
检测RR-EC109 和EC109 细胞中细胞周期调控检控点基因ATM、ATR、Chk1 和Chk2 的表达情况,结果显示RR-EC109 细胞中ATM(2.7456±0.1643)、ATR(1.5156±0.0865)、Chk1(2.1689±0.1168)和Chk2(3.4768±0.2268)基因的表达倍数均高于EC109 细胞中ATM(1±0.0870)、ATR(1±0.0392)、Chk1(1±0.0790)和Chk2(1±0.0627)基因的表达倍数(均P<0.05)(见图4)。
3 讨论
CSCs 是肿瘤中一小群具有长期自我更新及分化成为子代细胞能力的细胞亚群。多想研究证明了乳腺癌、肝癌、脑部肿瘤、肺癌等多种肿瘤的CSCs 的存在[4-7]。CSCs可能是引起肿瘤发生、进展、转移并对放疗和化疗抵抗的根本原因。
CSCs 在肿瘤组织或细胞中的含量很少,故CSCs研究的首要问题是如何分离CSCs。目前,分选CSCs的方法主要有流式分选(细胞表面膜蛋白为标志物)、侧群分选、无血清悬浮培养、利用细胞中乙醛脱氢酶含量进行分选。也可以利用CSCs 对放疗和化疗抵抗的特点分选出CSCs。李秋实等[8]和杨婷等[9]通过无血清法培养出食管鳞癌干细胞样细胞。Zhang等[10]和Lopez-Ayllon 等[11]分别从膀胱癌、肺癌中筛选出对顺铂耐药的细胞亚群,后者具有自我更新和表达干细胞表面标志物,致瘤性更强等肿CSCs 的特征。本研究采用高浓度间歇诱导法+时间递增诱导,经过2 个阶段,历时7个月,诱导出人食管鳞癌紫杉醇耐药细胞株RR-EC109。随后本研究对RR-EC109 细胞进行鉴定其是否具有CSCs的特征,进而验证RR-EC109细胞是否为CSCs,从而进行下一步分析。
CSCs因其自我更新能力,能在无血清悬浮培养条件下生长形成肿瘤细胞球,而分化细胞在该条件下会逐渐死亡。所以CSCs 增殖克隆能力会比分化细胞更强。本研究中,RR-EC109 细胞和EC109 细胞模拟无血清悬浮培养条件,接种于超低粘附6 孔板中,随后RR-EC109细胞显示出更强的成球能力和克隆增殖能力。目前已有多项研究从不同肿瘤中分离出SP 细胞[12-14],且研究发现该SP 细胞具有自我更新能力、成瘤能力更强,及高表达干性基因等CSCs 特性。所以可通过SP分选出具有CSCs特性的细胞亚群。本研究中RR-EC109 细胞中SP 细胞含量高于EC109 细胞(P<0.05),说明RR-EC109 细胞富含SP 细胞,进一步验证RR-EC109细胞具有CSCs特性,属于食管鳞癌干细胞样细胞。
肿瘤患者放疗效果取决于肿瘤细胞对电离辐射的敏感程度,但一些肿瘤亚群细胞对电离辐射抵抗,而抵抗机制目前尚不明确。而肿瘤干细胞学说认为CSCs是肿瘤对电离辐射抵抗的重要原因,并由此解释临床放疗难以根治肿瘤及放疗后肿瘤远期复发或转移的原因。Bao等[15]发现神经胶质瘤存在一类CD133阳性的亚群细胞对电离辐射抵抗。并且,其后续的研究发现这一亚群细胞具有CSCs 的特性。截至目前,越来越多研究结果表明CSCs 更抵抗电离辐射[16-18]。本研究对RR-EC109 细胞和EC109 细胞进行不同剂量辐射,建立单击多靶模型,通过非线性回归拟合分析得出拟合曲线方程,最后得到SERDq<1,说明RREC109 细胞的电离辐射抵抗高于EC109 细胞;而RREC109 细胞的Dq值高于EC109 细胞的Dq值(P<0.05),说明RR-EC109细胞的辐射抵抗可能与细胞修复亚致死损伤能力增强有关。
电离辐射对肿瘤细胞的杀伤靶点是DNA,方式有直接作用和间接作用,前者是DNA直接吸收射线能量引起DNA 损伤,后者是DNA 周围分子吸收射线能量产生活性氧簇,其具有很高的反应活性,可间接引起DNA 损伤[19]。DNA 损伤引起DNA 双链断裂,断裂点附近的组蛋白H2AX 蛋白发生磷酸化,形成γ-H2AX,后者能招募DNA 修复蛋白到损伤点,启动DNA 修复过程[20]。ATM 和ATR 是细胞周期检控点途径的重要激酶,其能感知DNA 损伤信号,进而激活一系列磷酸化级联反应,如细胞周期检控点效应蛋白激酶Chk1和Chk2 等。Chk1 和Chk2 激活后将损伤信号传递到下游,阻止细胞周期进程,引起DNA损伤修复,从而使细胞避免死亡[21]。本研究结果显示RR-EC109 细胞中ATM、ATR、Chk1 和Chk2 基因的表达倍数高于EC109 细胞且差异均有统计学意义,由此可知RREC109 细胞可能通过表达更高的细胞周期检控点蛋白引起DNA修复更活跃,导致更强的电离辐射抵抗。
综上,紫杉醇耐药细胞RR-EC109具有CSCs的特性,RR-EC109细胞对电离辐射抵抗更强,且其周期检控点蛋白表达更高,说明CSCs 与放疗抵抗有关,可能是通过更高的细胞周期检控点蛋白引起DNA 修复更活跃来实现的。所以CSCs 电离辐射抵抗的特性可作为治疗肿瘤的靶点,但仍需更深入的研究与探索。

