羧胺三唑乳清酸盐对小鼠胶质瘤相关巨噬细胞系促癌表型的影响
马 瑞,杨黎星,陈秋霞,仇佳星,王钰铖,鞠 瑞,郭 磊
(中国医学科学院基础医学研究所 北京协和医学院基础学院 药理系,北京 100005)
胶质瘤 (glioma) 是源自神经胶质干细胞的原发性脑肿瘤,其在治疗中化学治疗药物耐药问题突出。耐药产生的重要机制是肿瘤细胞与其微环境中的肿瘤相关巨噬细胞(tumor associated macrophages, TAMs)进行信息交流[1]。巨噬细胞的分化并非简单的促进炎性反应的经典活化巨噬细胞M1型和促进生长修复的替代性活化巨噬细胞M2型,而是存在混合表型[2]。其中,依赖糖酵解、磷酸戊糖的促炎介质促进肿瘤发展转移,加重脑水肿,促进胶质瘤的复发[3]。依赖氧化磷酸化和脂肪酸氧化的促修复介质促进肿瘤生长、血管生成以及免疫抑制等过程。因此,调控细胞物质代谢方式,抑制具有促癌作用的M1和M2介质,对抗击肿瘤、减少免疫抑制或有较大帮助。
羧胺三唑(carboxyamidotriazole, CAI)是一种非细胞毒类小分子抗肿瘤化合物[4],通过抑制肿瘤细胞氧化磷酸化,减少天门冬氨酸的生成,抑制细胞增殖[5]。其乳清酸盐形式羟胺三唑乳清酸盐(carboxyamidotriazole-orotate,CTO)可以增加口服生物利用度和吸收速率,降低毒性[6]。由此推测CTO可能对巨噬细胞氧化磷酸化有类似作用从而调控其炎性表型和促癌功能。本研究旨在探索 CTO 对TAMs线粒体呼吸和促癌功能的影响,初步解释抑制巨噬细胞线粒体呼吸下调促癌介质的机制。
1 材料与方法
1.1 材料
1.1.1 动物:C57BL/6 小鼠(6~8周龄,SPF级,雄性,体质量18~20 g(中国医学科学院基础医学研究所动物中心)。常温环境饲养[温度(22±2)℃,湿度40%~70%],12 h明/暗交替。动物自由摄食、饮水。
1.1.2 细胞系: 小鼠胶质瘤(mouse glioma)细胞系GL261和小鼠巨噬细胞系RAW264.7 (中国医学科学院基础医学研究所细胞资源中心)。
1.1.3 药品与试剂: CTO(MCE公司); DMSO(Sigma-Aldrich公司); DMEM 高糖培养基、RPMI-1640培养基、0.25%胰蛋白酶、谷氨酰胺、青霉素-链霉素混合液(中国医学科学院基础医学研究所细胞资源中心); 胎牛血清(Gibco公司); XF Mito Stress Test Kit(Agilent公司); RIPA裂解液、蛋白酶抑制剂、红细胞裂解液(北京索莱宝科技有限公司);5×蛋白上样缓冲液(loading buffer)、三色预染蛋白质分子质量标准(10~180 ku)、脱脂奶粉、抗体稀释液(上海翊圣生物科技有限公司);10×电泳缓冲液Tris-Gly、10×蛋白电转缓冲液(转膜液)、10×封闭-洗涤缓冲液(TBST)、膜再生液、牛血清白蛋白(北京普利莱基因技术有限公司);羊抗兔IgG二抗、羊抗鼠IgG二抗(北京金普来生物科技有限公司)。高纯总RNA快速提取试剂盒(北京全式金生物技术有限公司); Evo M-MLV预混型反转录试剂盒和SYBR®Green Pro Taq HS预混型qPCR试剂盒(湖南艾科瑞生物工程有限公司);低氧诱导因子-1α(HIF1-α)(Novus公司);HIF2-α(Thermo Fisher Scientific公司)、PGC-1β(Abcam公司)。
1.2 方法
1.2.1 细胞分组及处理:将GL261细胞及RAW264.7细胞分别置于含有10%胎牛血清和1%青霉素-链霉素的DMEM高糖培养基中进行培养,于37 ℃和5% CO2气体浓度适度的培养箱中培养,常规消化传代。骨髓来源巨噬细胞(bone marrow-derived macrophages, BMDMs)的获得:取自C57BL/6小鼠股骨与胫骨,骨髓冲洗液离心裂红;将离心得到的骨髓细胞用含10% L929条件培养基重悬,接种于10 cm大皿;12 h后弃未贴壁细胞,48 h后换液培养,48 h后以GL261肿瘤细胞条件培养基(GL261 conditioned medium,GCM)诱导。GL261肿瘤细胞条件培养基收集:GL261细胞按照2.0×106个/皿接种于大皿,48 h后换成含3%胎牛血清和1%青霉素-链霉素的DMEM高糖培养基培养24 h,过滤除菌收集培养上清。细胞分组:BMDM与RAW264.7细胞(统称为TAMS)均分为对照组(control)、诱导对照组GL261细胞上清[GL261 cell culture medium(GCM)DMSO]、10 μmol/L CTO的诱导给药组(GCM CTO)。 均以50% GL261细胞条件培养基(GCM)诱导24 h, 加入配好的药液继续培养24 h, 将细胞始终置于37 ℃和5% CO2气体浓度适度的培养箱中培养。
1.2.2 实时荧光定量PCR检测IL-1β、IL-6、IL-10、Arg-1、TGF-β1和TNF-α mRNA: 按照总RNA快速提取试剂盒说明书提取细胞总RNA,测定浓度和纯度后计算各组所需总RNA的体积,按照反转录试剂盒说明书进行反转录反应以合成cDNA,最后按照qPCR试剂盒说明书配制反应液,进行qPCR检测。引物序列见表1。
1.2.3 Seahorse细胞能量实验检测细胞耗氧速率(oxygen consumption rate,OCR):分别取对数增殖期的RAW264.7细胞和诱导成熟的BMDMs接种于24孔细胞板中,RAW264.7细胞为8.0×104个/孔,BMDM为105个/孔,以肿瘤细胞条件培养基诱导过夜后给药处理6 h,按照XF Mito Stress检测试剂盒的说明书进行操作,使用 Seahorse XF分析仪检测。
1.2.4 Western blot检测HIF-1α、HIF-2α、PGC-1β蛋白表达水平: 收集细胞,向细胞沉淀中加入适量配制好的细胞裂解液(按比例加入蛋白酶抑制剂),置于冰上,小心吹打混匀,裂解30 min,每10 min吹打1次。10 000~14 000 r/min离心3~5 min,取上清,进行蛋白浓度测定。按照蛋白样品:5×蛋白上样缓冲液=4∶1的体积比向蛋白样品中加入一定量的5×蛋白上样缓冲液,98 ℃ 10 min使蛋白变性,-80 ℃保存。根据蛋白浓度计算上样量,每个泳道加入25~30 μg蛋白样品进行SDS-PAGE。电泳初始电压设为恒压80 V,待样品进入分离胶后,改为恒压300 V。设为恒流300 mA,转膜1~2 h。将PVDF膜封闭后进行一抗孵育(HIF1-α、HIF2-α、PGC-1β均为1∶1 000),4 ℃过夜。孵育二抗后显影,保存图片。
1.3 统计学分析

2 结果
2.1 CTO下调GL261细胞上清诱导的TAMs中的IL-1β、IL-6、IL-10、Arg-1、TGF-β1和TNF-α mRNA水平
与对照组相比,GL261诱导组IL-1β、IL-6、IL-10、Arg-1、TGF-β1和TNF-α mRNA水平均有升高。诱导条件下给予CTO处理24 h可使各个因子mRNA水平下降(P<0.05,P<0.01,P<0.001)(图1)。
2.2 CTO抑制TCM线粒体呼吸
在Seahorse细胞能量实验中,RAW264.7细胞、BMDM以GL261条件培养基(GCM)诱导,10 μmol/L CTO处理组细胞的 OCR降低,其中基础呼吸、最大呼吸和ATP产生量都明显降低(P<0.05,P<0.01,P<0.001),而剩余呼吸能力的变化无统计学意义(图2)。

表1 引物序列Table 1 Sequence of primers
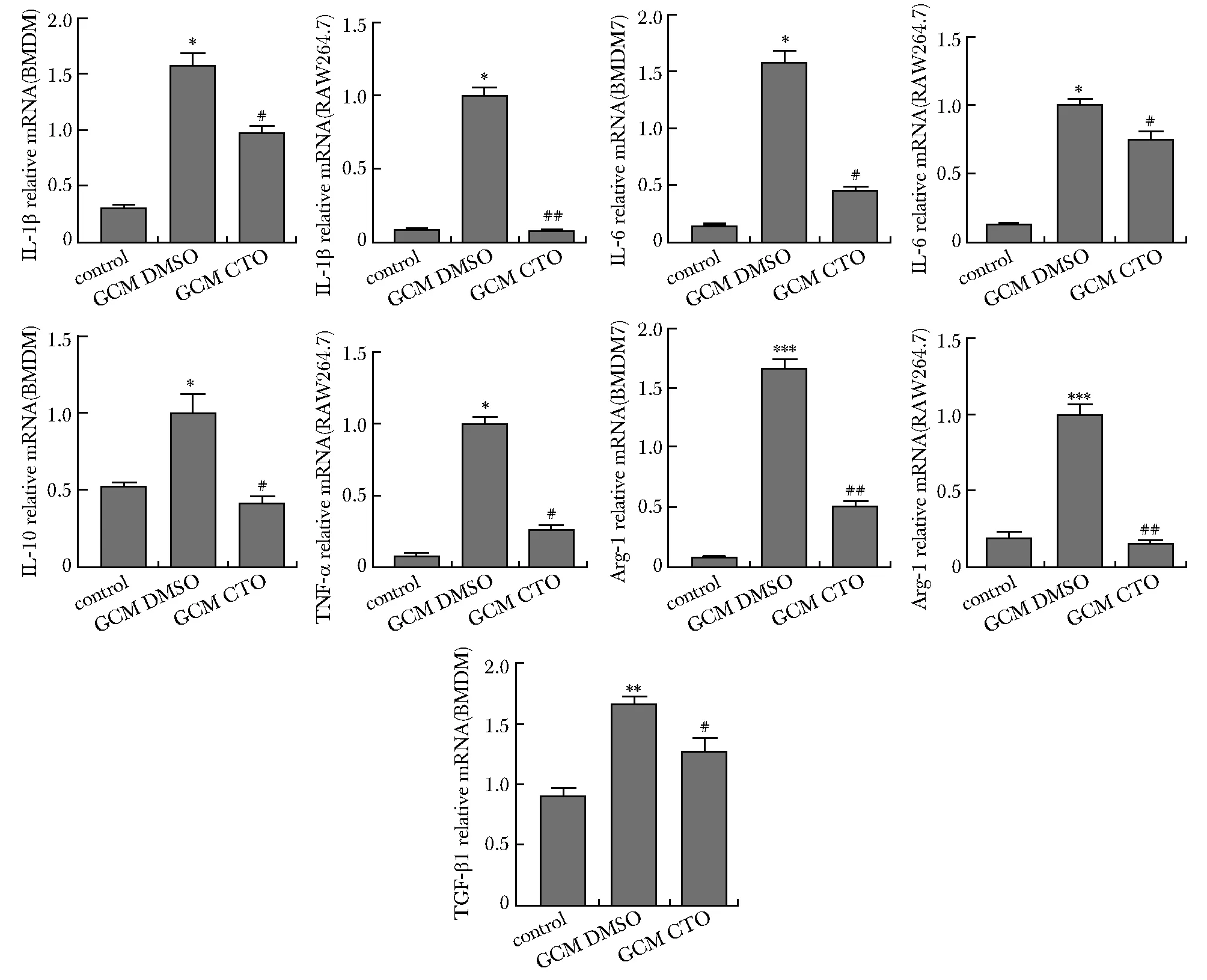
*P<0.05,**P<0.01,***P<0.001 compared with control group;#P<0.05,##P<0.01 compared with GCM DMSO group
2.3 CTO下调 TAMs中HIF-1α及HIF-2α蛋白水平
与对照组相比,GL261条件培养基诱导(GCM DMSO组)的HIF-1α及HIF-2α表达均有升高,在诱导同时给予CTO(GCM CTO组)使其水平下降,而促进线粒体耗氧的氧化磷酸化解偶联剂碳酰氰-4-三氟甲氧基苯腙(FCCP)(GCM DMSO组)可使HIF-1α及HIF-2α表达升高(P<0.05,P<0.01)(图3)。
2.4 CTO抑制TAMs中PGC-1β蛋白表达
与对照组相比,GL261条件培养基诱导组PGC-1β表达升高,在诱导同时给予CTO可下调PGC-1β水平,这一作用与另一线粒体呼吸抑制剂鱼藤酮(rotenone,RTN)一致(均P<0.05)(图4)。
3 讨论
巨噬细胞的M1和M2表型分别由细菌脂多糖(lipopolysaccharide, LPS)(或联合γ-干扰素)和白介素-4(或联合白介素-13)两种刺激条件诱导而成,发挥促炎和抗炎促修复的功能。这一概念是为了深入探索巨噬细胞的不同功能和分子机制而设定的两种极端分类,实际疾病环境中的巨噬细胞受到复杂的刺激物质的诱导而成为混合表型,并存在时间变化和空间差异。M1介质IL-1β与人脑胶质瘤细胞增殖、迁移和侵袭相关,严重影响了其预后效果[7],TNF-α通过刺激胶质瘤细胞表达促血管生成因子、下调肿瘤抑制基因PTEN和诱导产生的基质金属蛋白酶-9促进肿瘤侵袭[8];M2介质IL-10、TGF-β、ARG1可以抑制T细胞激活、发挥功能,与免疫抑制密切相关[9]。无论抑制M1、M2表型具有促癌作用的介质均能起到抑制肿瘤生长、减少血管生成、抑制肿瘤侵袭转移等方面的作用。本课题组目前研究的羧胺三唑乳清酸盐(CTO)等线粒体呼吸链干扰药物表现出对不同表型巨噬细胞的调控作用。在胶质瘤微环境中,CTO对胶质瘤相关巨噬细胞的多种促癌介质均有下调作用,本研究发现其中既有典型的M1标志物,也有M2标志物,这些介质的下调可能与CTO调节细胞代谢的作用有关联。在其他模型中,CTO对炎症和肿瘤不同发展阶段的不同表型巨噬细胞表现出不同的调控作用。因此CTO的促炎和抗炎作用存在炎性反应或肿瘤时空依赖性,并非单纯的两种极端表型的相互转换。CTO下调这些促肿瘤因子水平,提示CTO可能通过改善肿瘤微环境发挥抗肿瘤的作用。
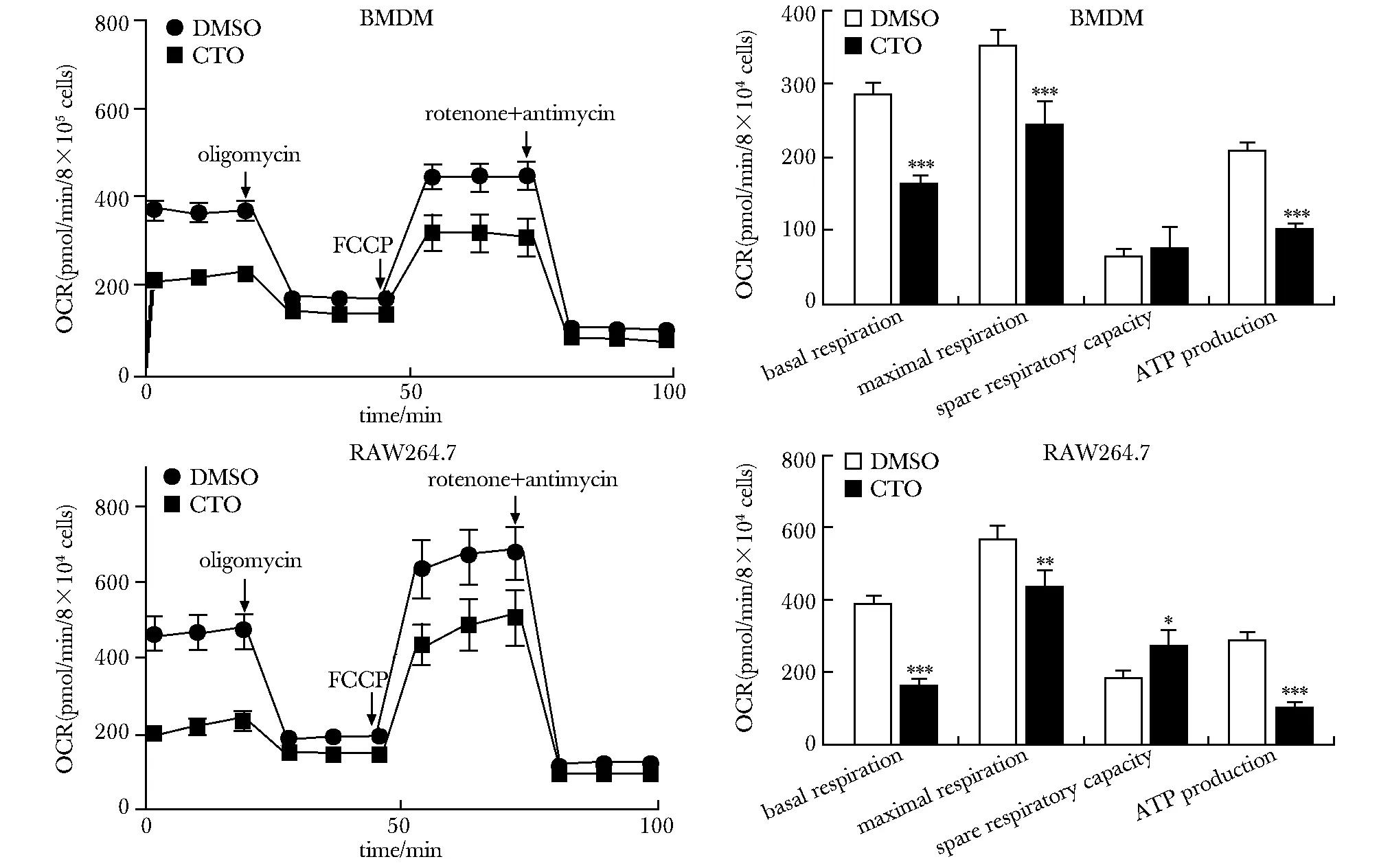
FCCP.trifluoromethocy carbonglcyanide phenylhyodrazone; *P<0.05,**P<0.01,***P<0.001 compared with GCM DMSO group图2 各组RAW264.7细胞与BMDMs的耗氧速率Fig 2 Oxygen consumption rate(OCR) of RAW264.7 cells and BMDMs in various n=3)
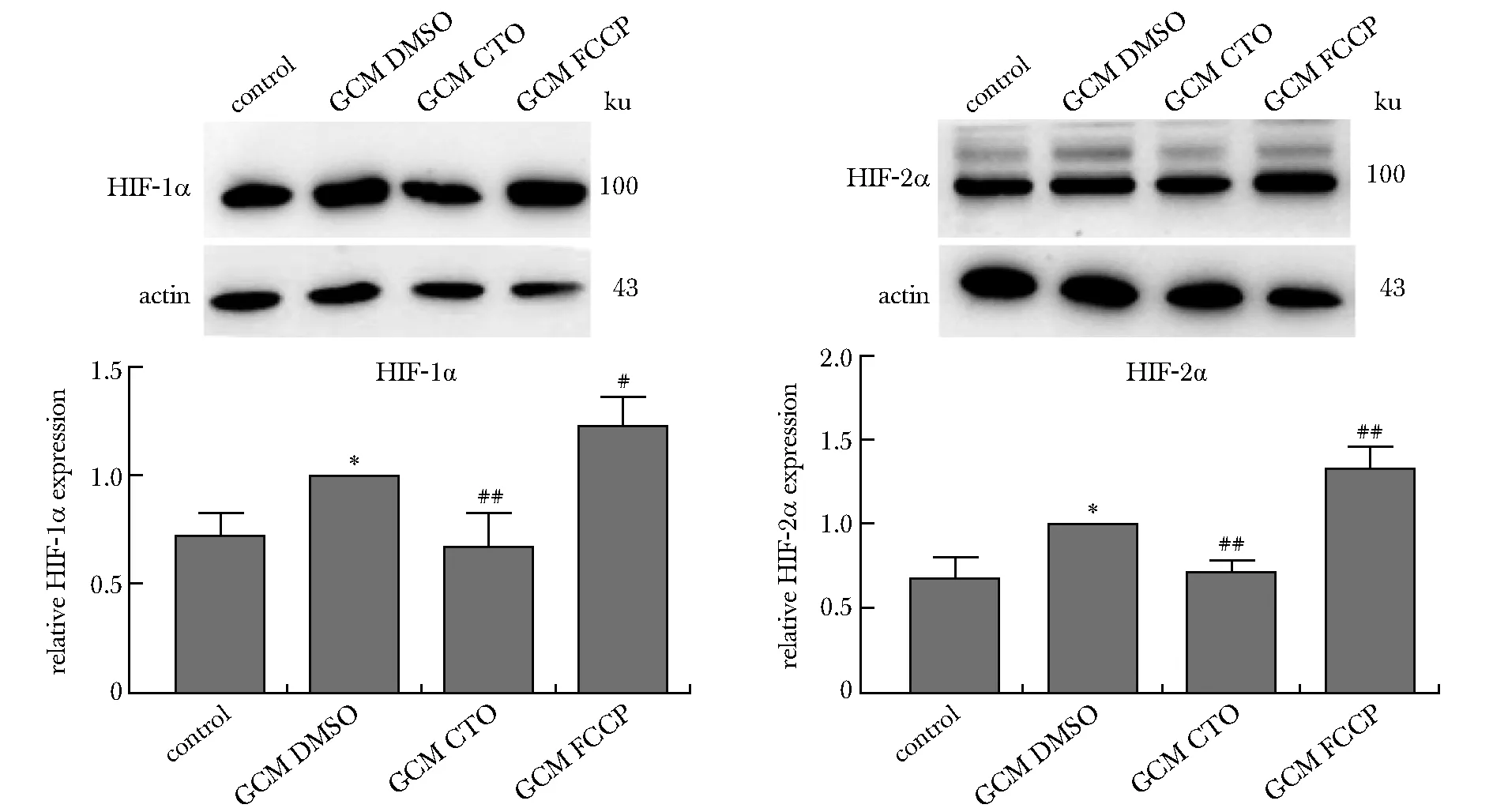
*P<0.05 compared with control group; #P<0.05,##P<0.01 compared with GCM DMSO group图3 CTO对GL261细胞上清诱导的TAMs中HIF-1α、HIF-2α表达的影响Fig 3 Effects of CTO on the GL261 conditional medium induced-expression of HIF-1α,HIF-2α in n=3)
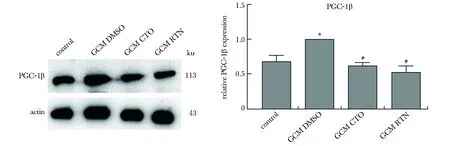
RTN.rotenone; *P<0.05 compared with control group; #P<0.05 compared with GCM DMSO group图4 CTO对GL261细胞上清诱导的TAMs中PGC-1β表达的影响Fig 4 Effects of CTO on the GL261 conditional medium induced-expression of PGC-1β in TAMs n=3)
线粒体呼吸影响巨噬细胞极化表型的调控, CTO下调TAMs中M2介质的作用可能与其对线粒体呼吸的抑制作用相关,但其具体机制尚不十分明确。据报道,二甲双胍通过抑制线粒体耗氧,减少低氧诱导的 HIF-1α 积累发挥抗肝细胞癌的作用[10],而CTO对氧化磷酸化的抑制可能也影响胞内氧气可利用水平,降低HIF-1α、HIF-2α稳定性从而使其水平下降。本研究初步验证了这一猜想,并发现增加氧耗的FCCP对其作用与CTO相反,进一步验证了氧气的可利用度对HIF-1α、HIF-2α水平的影响。HIF1 α通过促进小鼠巨噬细胞糖酵解代谢,诱导M1 极化[11];HIF-2α 则通过调节细胞因子受体 M-CSFR 和趋化因子受体 CXCR4 的表达来调节巨噬细胞迁移,并促进肿瘤进展[12]。
PGC-1β是M2介质转录过程中的重要调控因子[13],已有研究发现线粒体呼吸链抑制剂鱼藤酮可下调PGC-1β表达[14]。CTO对 PGC-1β水平有类似作用,可能是CTO抑制M2极化的机制之一。抑制线粒体呼吸对这一因子表达产生影响的机制有待进一步探究。
综上所述,本研究证实CTO通过抑制TAMs线粒体呼吸作用,增加细胞内氧气可利用度使HIF-1α、HIF-2α减少;并且CTO降低PGC-1β表达,这些作用可能是CTO抑制IL-1β、 IL-6、IL-10、Arg-1、TGF-β1、TNF-α等促癌因子表达的机制。CTO对胶质瘤诱导的巨噬细胞促癌介质的调控作用,可能是其增强替莫唑胺疗效的重要机理之一。

