针对SARS-CoV2不同突变株广谱特异性中和抗体的筛选与鉴定
佟可心,蔡孟华,何 维,张建民
(中国医学科学院基础医学研究所 北京协和医学院基础学院 免疫学系,北京 100005)
新型冠状病毒肺炎 (COVID-19)是由严重急性呼吸综合征冠状病毒2(severe acute respir-atory syndrome coronavirus 2,SARS-CoV2)感染引起的呼吸系统疾病。由于其具有传染性高、传播速度快、病毒变异频率高等特点,已在全球范围内引发公共卫生危机。研究表明,SARS-CoV2进入宿主细胞是由其表面刺突蛋白(S蛋白,spike protein, S protein)介导的[1]。 S蛋白受体结合域(receptor binding domain,RBD)与人宿主细胞表面上的血管紧张素转化酶2(angiotensin converting enzyme2,ACE2)受体的结合是其入侵细胞的第一步。因此,针对RBD的中和抗体,能有效阻止病毒入侵宿主细胞[2]。
相比于疫苗,中和抗体治疗效果更加直接和迅速,更有利于COVID-19重症患者的救治。已有研究表明,恢复期患者的血浆中含有中和抗体,可以用于治疗COVID-19[3]。然而,血浆疗法存在诸如获取过程复杂,难以量产等缺点。利用杂交瘤细胞表达纯化的中和抗体具有纯度高,可量产等优势。目前已经有研究人员通过融合康复者B细胞来制备单克隆抗体,并在体外对单克隆抗体结合病毒活性进行了验证[4-6]。
然而,与所有RNA病毒一样,SARS-CoV2具有容易出错的RNA聚合酶,S蛋白的突变明显提高病毒的传播效率以及对中和性抗体的逃逸[7-9]。因此,本研究致力于通过ELISA多轮筛选和病毒微量中和实验,筛选并鉴定对已经出现的多种SARS-CoV2病毒变异株具有广谱结合活性的中和抗体,为进一步进行人源化改造,以为COVID-19的治疗奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验动物及细胞系:12只雌性,体质量20~24 g的SPF级野生型Balb/c小鼠购买并饲养于中国医学科学院基础医学研究所实验动物中心。所有实验程序遵照中国医学科学基础医学研究所动物伦理要求。SP2/0骨髓瘤细胞(中国医学科学院基础医学研究所医学细胞中心)。
1.1.2 试剂及试剂盒 SARS-CoV2 刺突蛋白mRNA疫苗(由课题合作方提供);SARS-CoV2 SPIKE 相关重组蛋白(北京义翘神州科技股份有限公司);HRP标记的山羊抗小鼠IgG抗体(北京中杉金桥生物技术有限公司);DAB显色液及ELISA终止液(Solarbio公司);SPIKETY假病毒基础通量包LUC(北京中吉当康基因技术有限公司);荧光素酶显色底物(上海碧云天生物科技公司)。
1.2 方法
1.2.1 免疫动物:将12只Balb/c小鼠按剂量分为高剂量组(4.5 μg)、低剂量组(1.5 μg)和空白对照组于腿部肌肉注射脂质体包被的疫苗。经过第1天和第21天的2次免疫,取小鼠尾静脉血,通过ELISA测定筛选抗体滴度,选择抗体滴度较高的小鼠,在第35天进行冲击免疫(图1)。
1.2.2 融合并筛选杂交瘤细胞:复苏小鼠骨髓瘤细胞SP2/0;Balb/c小鼠经加强免疫后,无菌操作取出脾脏再分离脾细胞。将脾细胞与骨髓瘤细胞融合培养用HAT选择培养基重悬,将融合后细胞接种至无菌96孔板(150 μL/孔),置于37 ℃、5% CO2培养箱中培养4 d。融合8 d后吸取上清,加入包被有1 μg/mL S1蛋白和S2蛋白的96孔板, 室温孵育1 h,洗涤后加入稀释的HRP标记山羊抗小鼠IgG,PBST洗涤3次后,加入DAB显色液,观察到明显变色后,终止显色。酶标仪检测450 nm吸光度(A)值,收集阳性孔细胞,重悬于选择培养基中,采用有限稀释法获得单克隆细胞。
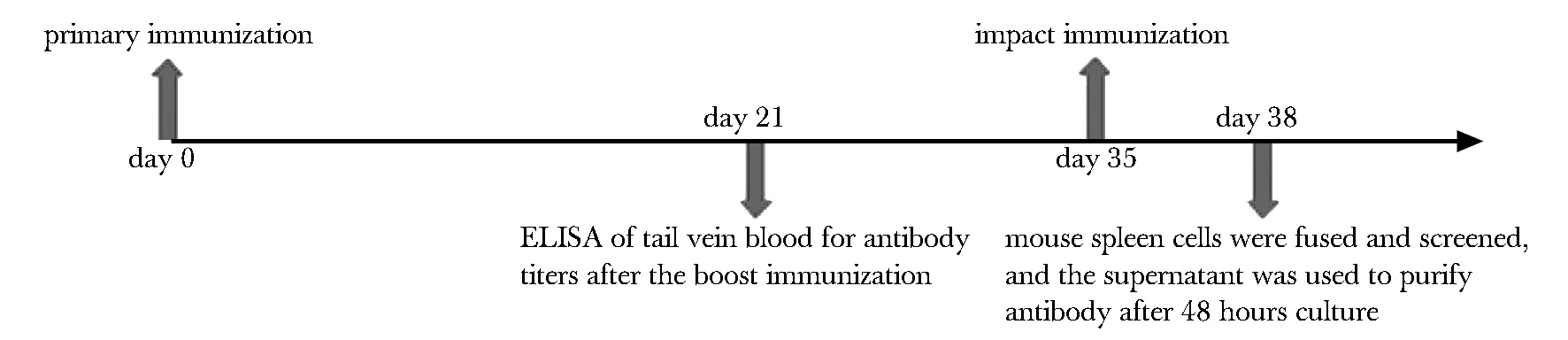
图1 动物免疫策略Fig 1 Animal immunity strategy
1.2.3 单克隆抗体的制备与鉴定:将杂交瘤细胞置于培养瓶中进行培养37 ℃、5% CO2培养箱中培养2 d。收集培养上清液,3 000 r/min离心5 min去除细胞及其碎片,通过AKTA蛋白纯化仪将抗体吸附到Protein A亲和层析柱,再用洗脱缓冲液(洗脱缓冲液:pH 2.8, 0.1 mol/L甘氨酸缓冲液)洗脱。分别将1 μg S蛋白,S1蛋白,S2蛋白,RBD蛋白溶于100 μL包被液,包被96孔板4 ℃过夜,次日加入1∶500比例稀释的纯化抗体室温孵育1 h,洗涤后加入稀释比例为1∶8 000的HRP标记的山羊抗小鼠IgG抗体,室温孵育30 min,PBST洗涤3次后,加入DAB显色液,5 min后较明显变色后,加入终止液。酶标仪检测450 nm吸光度(A)值。
1.2.4 假病毒中和实验:ACE2-293T铺96孔板,每孔100 μL,细胞数量3×104个。12 h后待ACE2-293T贴壁开始实验,将特异性结合RBD蛋白的9株中和抗体用含2% FBS的DMEM培养基稀释为0.5、5、50 μg/mL浓度梯度与稀释的假病毒各50 μL于37 ℃共孵育1 h,96孔板吸去培养基缓慢加中和液,空白细胞换液2% FBS DMEM,48 h后将中和液缓慢吸出再加入50 μL萤光素酶发光底物。用LB942微孔板分析仪测定相对发光单位(relative luminescence units,RLU)。具体方法见参考文献[10]。中和效率计算公式:1-(实验孔RLU均值-细胞对照RLU均值)/(病毒对照RLU均值-细胞对照RLU均值)。
1.2.5 单克隆抗体广谱结合活性的验证:分别将1 μg Omicron(B.1.1.529),Delta(B.1.617.2),Lamda(C.37),Mu(B.1.621)的RBD蛋白溶于100 μL包被液,包被96孔板4 ℃过夜,次日加入1∶500比例稀释的纯化抗体室温孵育1 h,洗涤后加入稀释比例为1∶8 000的HRP标记的山羊抗小鼠IgG抗体室温孵育30 min,PBST洗涤3次后,加入DAB显色液,5 min后较明显变色后,加入终止液。酶标仪检测450 nm(A)吸光度值。
1.3 统计学分析
2 结果
2.1 小鼠血清抗体含量检测
高剂量组(4.5 μg)4号小鼠血清特异性抗体浓度最高(实验由课题合作方完成)。无菌操作取小鼠脾脏细胞用于细胞融合。
2.2 单克隆抗体鉴定与筛选
有限稀释后,ELISA筛选得到12株对S蛋白具有高结合活性的杂交瘤细胞,其中10株针对S蛋白的S1结构域,2株针对S2结构域,没有交叉反应性(表1,图2)。

表1 单克隆抗体筛选结果Table 1 Screening results of monoclonal antibodies
在10株针对S1蛋白的杂交瘤细胞中,9株能产生特异性结合RBD蛋白的单克隆抗体。并且在一定浓度范围内,9株单克隆抗体均能剂量依赖性结合RBD蛋白(图3)。

图2 12株单克隆抗体特异性结合S1,S2和RBDFig 2 12 Strains of monoclonal antibodies specifically bound S1, S2 and
2.3 单克隆抗体体外中和活性的验证
3次独立SARS-CoV2假病毒微量中和实验结果显示,有3株单克隆抗体对假病毒具有中和作用,能够保护细胞免遭病毒感染,分别是41、46和47号抗体(图4)。ELISA和中和实验结果表明,对RBD区域结合能力较强的抗体同样具有较高的中和效率。
2.4 单克隆抗体对四种突变株结合活性
3次独立ELISA测定3株抗体对4种SARS-CoV2突变株的重组RBD蛋白(图5)的结合特异性实验结果显示, 与其他3个突变RBD蛋白相比, 3株抗体对Omicron的RBD蛋白的结合都较低,但46号抗体对Omicron的RBD蛋白有明显结合活性(P<0.001)(图6)。

图3 单克隆抗体与RBD呈剂量依赖性结合Fig 3 Monoclonal antibody dose-dependently bound to RBD protein
3 讨论
中和抗体是B淋巴细胞产生的一些抗体,可以与病原微生物表面的抗原结合,从而防止病原微生物黏附至靶细胞受体并侵袭宿主细胞。在COVID-19治疗中,中和抗体被认为是可以识别病毒表面S蛋白并阻止其与宿主细胞受体结合的抗体,它可以与细胞竞争结合病毒S蛋白上的RBD[11]。由于SARS-CoV2是单股正链核糖核酸(RNA)病毒,没有互补链进行矫正,因此较易发生随机变异。自疫情发生以来,病毒变异已逐渐产生了高度适应性。随着 SARS-CoV2 在全球传播,由于选择压力与病毒在人群中不断复制,变异将继续出现。那些有利于复制与传播以及逃避免疫而形成的新变异势必将影响疫苗的效力。本研究结果表明,通过免疫小鼠获取的中和抗体不仅可以在体外有效中和病毒,还能够广谱结合病毒突变株RBD蛋白。目前Delta病毒株病毒载量高、传播速度较快,已对现有疫苗的有效力产生了影响。相较于其他变异株,最新出现变异株Omicron对本次筛选出的3株中和抗体亲和力都相对更低,这也说明Omicron的突变更加复杂。在本轮中国多地出现的疫情是由最新发现的Omicron分支BA.2所引起的,其传播能力较之前出现的变异株大大提高,大大增加了疫情防控的难度。在这种趋势下,具有广谱亲和活性的中和抗体能够更加有效迅速的应对突然流行的新突变株。
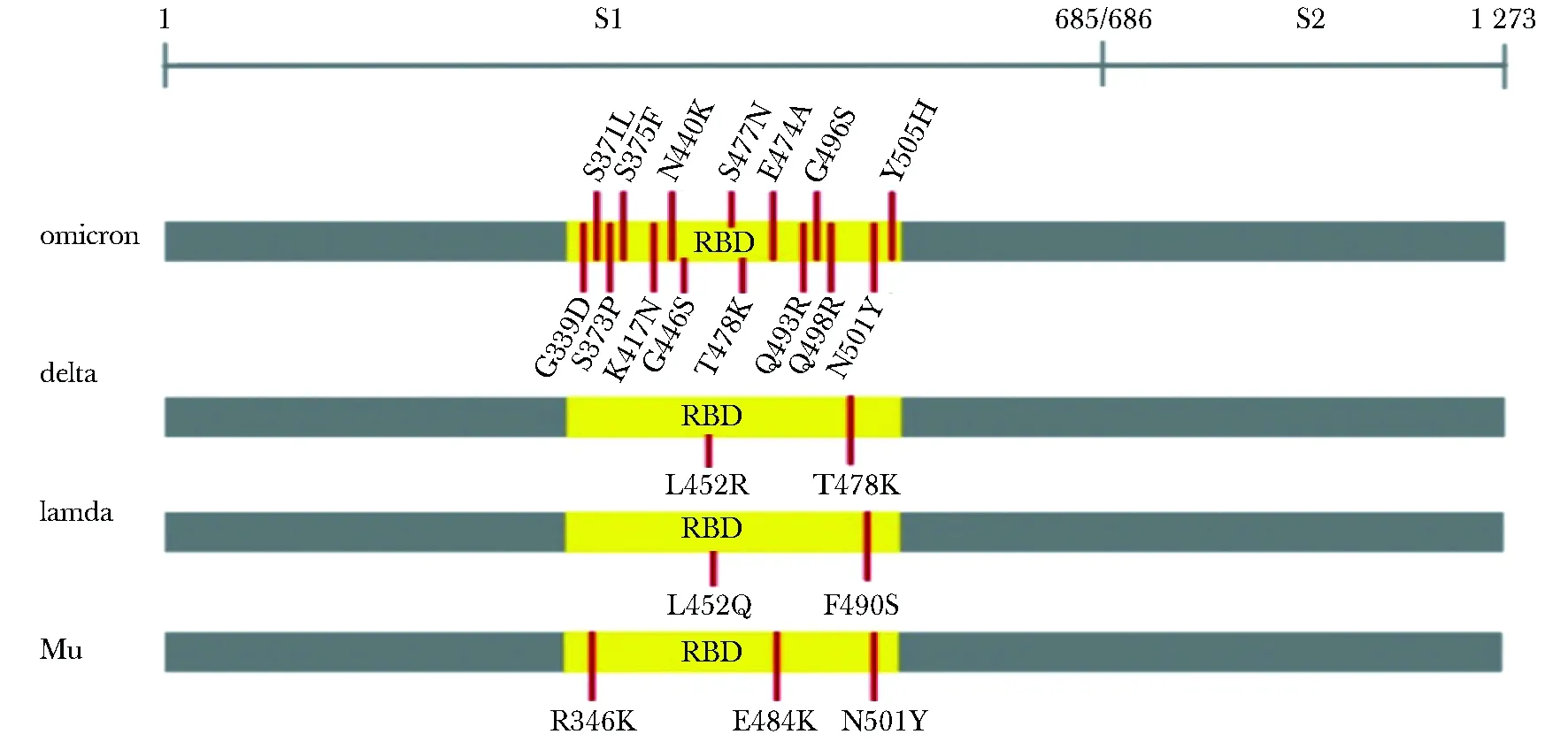
图5 4种病毒突变株RBD蛋白突变位点 Fig 5 Mutation sites in RBD protein of 4 viral mutants
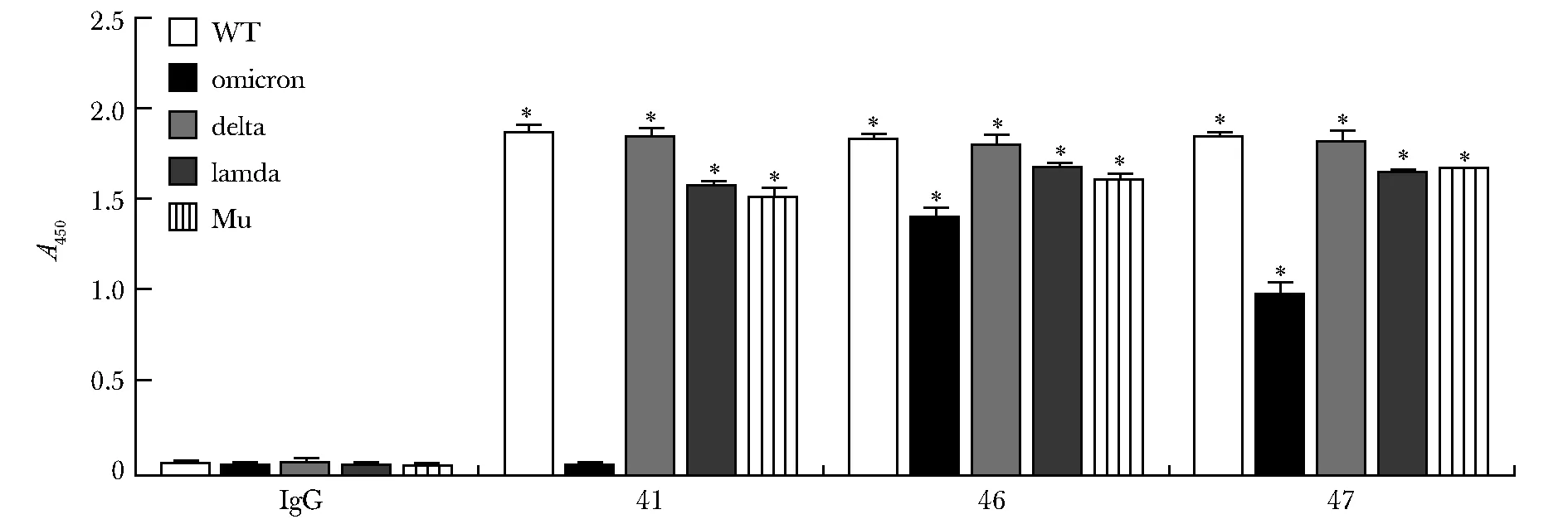
*P<0.05 compared with IgG group图6 46号抗体对4株突变株RBD蛋白有广谱的结合活性Fig 6 Antibody 46 showed broad-spectrum binding activity to 4 mutant RBD proteins
与小分子药物相比, 中和抗体具有给药时间短和安全性高的优点,但它们也面临着诸如制备困难,收率较低和成本较高,尤其是抗体依赖增强效应(antibody dependent enhancement,ADE)的挑战。一些候选的中和抗体已进入临床试验,可用于COVID-19治疗,相信在未来广谱性中和抗体有望成为COVID-19治疗的候选药物。

