产ACE抑制肽乳酸菌的筛选、益生特性评定及应用
宋小玲,高冀婷,曹菲薇,胡子毅,任大喜
(浙江大学动物科学学院,奶业科学研究所,浙江杭州 310058)
高血压是引起心脑血管疾病和中风的重要危险因素之一[1]。近年来,高血压人群在全球范围内持续增加[2]。中国高血压调查发现,2018年我国成人的高血压患病人数达2.45亿,且患者越来越年轻化[3−4]。血管紧张素转化酶(Angiotensin converting enzyme,ACE)在血压调节方面起着重要作用,可以将血管紧张素I(Ang I)转化为具有收缩血管功能的血管紧张素II,还可以将具有血管舒张作用的缓激肽水解成失活片段[5]。血管紧张素转化酶抑制剂是治疗高血压最常用的药物之一[6−7],尽管药物疗法是最广泛用于治疗高血压的方法,但长期使用具有继发性副作用。发酵乳被推荐作为高血压的非药物疗法,主要因为它基本无副作用。发酵乳的降压效果[8−9]主要归因于乳蛋白中的ACE抑制肽(ACEI肽),这些肽可以在特定乳酸菌发酵或胃肠消化过程中被释放出来,通过抑制ACE活性来引起血管扩张反应,从而降低血压。
关于ACEI肽研究最多的是乳酸杆菌菌株[10−11],例如Lb. helveticus、Lb. casei、Lb. paracasei、Lb. fermentum、Lb. plantarum、Lb. rhamnosus等,其中以瑞士乳杆菌(Lb. helveticus)最多。研究最多的ACEI肽[12]是在瑞士乳杆菌发酵乳中发现的VPP和IPP,在几种大鼠模型和人体研究中都显示出降血压效果。目前市面上的降血压发酵乳[13−14]基本都是国外的,芬兰和日本研发的降血压发酵乳对高血压的治疗有显著效果,知名度较高。虽然市面上存在具有降血压作用的商业发酵乳,但品种稀缺,且大多数基于瑞士乳杆菌。
研究表明乳酸菌的细胞壁蛋白酶负责生产ACEI肽,细胞壁蛋白酶可以将乳蛋白分解成寡肽并将其用作营养来源,乳酸菌的细胞壁蛋白酶活性、蛋白水解系统和菌株活性是生产降压肽的基础。酶的特异性决定了释放肽的序列,每个菌株的酶有特异性[15],具有富产ACEI肽潜力的乳酸菌是开发降血压发酵乳的前提。因此,筛选具有富产ACEI肽的新型乳酸菌并开发含有新型乳酸菌的功能性乳制品,对促进人体健康和满足人们对功能性食品的消费需求意义重大。本研究拟在实验室乳酸菌库中,筛选出具有自主知识产权的富产ACE抑制肽的乳酸菌,为后续动物试验、临床研究、降压发酵乳及乳制品的开发提供菌株和科学依据。
1 材料和方法
1.1 材料与仪器
实验菌株:本实验室筛选的菌株来自内蒙及川藏地区酸奶汤、鲜奶、奶疙瘩、手工酸奶及浙江新生婴儿粪便等分离到的遗传稳定性优良的30多株菌;指示菌株:大肠杆菌O157:H7(Escherichia coliO157:H7)ATCC 25922、鼠伤寒沙门氏菌(Salmonella typhimurium)ATCC 13311 美国典型培养物保藏中心;单核细胞增生李斯特菌(Listeria monocytogenes)CMCC 54007、金黄色葡萄球菌(Staphylococcus aureus)CMCC 26003 中国医学细菌保藏管理中心;胆盐、MRS肉汤培养基、琼脂培养基 北京陆桥技术股份有限公司;脱脂乳粉 新西兰恒天然有限公司;水牛乳 广西水牛研究所牧场;FAPGG底物、ACE(来自兔肺,酶活0.1 UN)、胃蛋白酶(1:3000)和胰蛋白酶(1:250) Sigma公司;BCA蛋白试剂盒 上海源叶生物科技有限公司;HEPES(4-羟乙基哌嗪乙磺酸) 阿拉丁(上海)有限公司;抗生素药敏试纸 杭州微生物试剂有限公司;其他试剂 均为国产分析纯。
SpectraMax M5多功能酶标仪 上海道尚生物科技有限公司;3-30K低温高速离心机 德国Christ公司;FE20实验室pH计 梅特勒-托利多仪器(上海)有限公司;TGL-16M高速台式冷冻离心机 湖南湘仪实验室仪器开发有限公司;ES-315高压灭菌锅 日本TOMY公司;BD-305E变温冷冻冻藏箱 浙江星星冷链集成股份有限公司;SW-CJ-IF超净工作台 苏州安泰空气技术有限公司。
1.2 实验方法
1.2.1 发酵乳制备 取出实验室乳酸菌库中保藏的菌株,在MRS固体培养基上活化三代,取单菌落接于MRS液体培养基中37 ℃培养20 h后取出,用PBS将菌株浓度调至108CFU/mL,按照3%(v/v)的接种量接种到灭菌脱脂乳(11%,w/v)中,37 ℃培养48 h后取出,−20 ℃冰箱放置,待进一步分析。
1.2.2 蛋白水解度测定 蛋白水解度的测定参考罗艳华等[16]的方法。以丝氨酸为标准溶液,采用OPA法测定样品在340 nm处的吸光值,通过公式计算蛋白水解度(DH)。称取0.01 g丝氨酸于100 mL容量瓶中定容,使其浓度为1 mmol/L,再加超纯水稀释至0、0.2、0.4、0.6、0.7、0.8、0.9 mmol/L,配制成丝氨酸标准溶液,向96孔板中加入20 μL丝氨酸标准溶液和150 μL OPA溶液混合,静置2 min后读取340 nm的吸光值(标准曲线方程为y=0.5746x+0.0178,R²=0.9935)。将发酵乳清稀释20倍后,取20 μL样品与150 μL OPA溶液混合,静置2 min后读取340 nm的吸光值,计算公式如下:
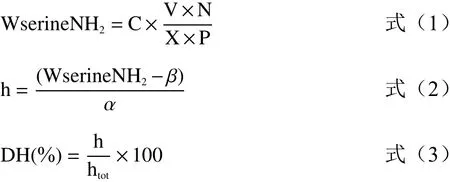
式中:Wserine NH2表示每克蛋白质含丝氨酸的量,mmol/g;C表示样品OD值相对应于标曲中丝氨酸的浓度,mol/L;V表示样品体积,L;N表示稀释倍数;X表示样品质量,g;h表示每克蛋白因水解被断裂的肽键数,mmol/g;htot表示每克蛋白所含的肽键毫摩尔数,mmol/g;乳蛋白的α值为1.0,β值为0.4。
1.2.3 ACE抑制率测定 发酵乳清的制备:将发酵乳pH调至4.6,8000 ×g离心10 min取上清液,再将上清液pH调至8.3,8000 ×g离心10 min取上清液得发酵乳清。
HEPES缓冲液:pH8.3,80 mmol/L HEPES缓冲液(含30 mmol/L的NaCl);FAPGG溶液:取FAPGG粉末加入到HEPES缓冲液中,配制成1.0 mmol/L的FAPGG溶液;ACE溶液:取ACE固体加入到HEPES缓冲液中,配制成0.1 U/mL的ACE溶液。
ACE抑制率的测定方法参考罗鹏[17]和Memarpoor等[18]并略作修改。以FAPGG底物法测定发酵乳清的ACE抑制率。取40 μL样品和50 μL的FAPGG混合均匀,最后加入10 μL的ACE溶液,利用酶标仪测定OD340数值的前后变化来代表ACE酶活性。空白对照采用HEPES缓冲液(40 μL),其余测定同上。抑制率可用公式表示:

式中:ΔA为空白对照组在0~40 min内吸光值的变化;ΔB为实验组(ACE抑制剂)在0~40 min时吸光值的变化。
IC50测定:将发酵乳清冻干,取冻干粉加水复配成30 mg/mL溶液,参照罗鹏[17]测定溶液中多肽含量,将样品溶液8000 g 离心10 min保留上清液,使用10 kDa超滤管对上清液进行超滤,取超滤液借助BCA试剂盒测定其多肽含量(酶标仪法),将样本溶液稀释至6个多肽浓度梯度0.001、0.1、0.2、0.3、0.4、0.5 mg/mL,测定各浓度梯度下的ACE抑制率,利用Graph Pad Prism 8软件计算样品的IC50值(IC50定义为ACE抑制率达50%时所需的多肽浓度)。
1.2.4 模拟胃肠消化 人工胃液和肠液参考Lisson等[19]进行配制。取发酵乳5 mL,将发酵乳与人工胃液按2:1(v/v)混合,于37 ℃恒温水浴振荡器中消化2 h,沸水浴加热10 min以终止反应,取样测定其ACE抑制率;胃蛋白酶消化后的样品按1:1(v/v)的量与人工肠液混合,在恒温水浴振荡器中消化2 h,沸水浴加热10 min以终止反应,取样测定其ACE抑制率。
1.2.5 菌株16S rRNA鉴定 将筛选到的菌株送至生工生物工程(上海)有限公司进行测序,将所得到的序列于NCBI数据库中通过BLAST进行同源性比较确定菌属。使用MEGA 7.0软件进行菌株系统发育树的构建。
1.2.6 益生特性评价
1.2.6.1 乳酸菌酸耐受性能测定 参考郑志瑶等[20]的方法,将乳酸菌(浓度约108CFU/mL)以10%(v/v)接种量接于pH为3.0的MRS液体培养基中,在37 ℃下培养,分别在0、3 h取菌液,进行活菌计数,计算酸耐受性:
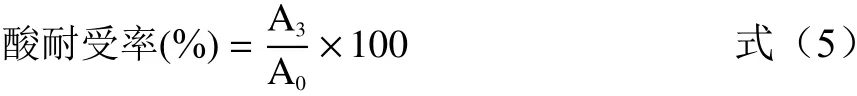
式中:A0、A3分别为待测菌株0和3 h的活菌数,CFU/mL。
1.2.6.2 乳酸菌胆盐耐受性能测定 参考郑志瑶等[20]的方法,将乳酸菌(浓度约108CFU/mL)以10%(v/v)的接种量接于含0.3%牛胆盐(v/v)的MRS液体培养基中,在37 ℃下培养,分别在0、3 h取菌液,进行活菌计数,计算胆盐耐受性:

式中:T3、T0分别为待测菌株0和3 h的活菌数,CFU/mL。
1.2.6.3 乳酸菌的抑菌活性 参考梁竟一等[21]的方法,采用牛津杯法和琼脂扩散法测量菌株ZJUIDS09和ZJUIDS11代谢产物的抑菌活性。将已活化好的4种指示菌株(大肠杆菌、沙门氏菌、金黄葡萄球菌和单核细胞增生李斯特菌)的菌悬液浓度调至108CFU/mL,按1%(v/v)的量接种到LB琼脂培养基(50 ℃)中,混合均匀后倒培养皿中(15 mL/皿),冷凝后拔掉事先放置的无菌牛津杯,将菌株ZJUIDS09和ZJUIDS11的代谢上清样品加入杯孔中(200 μL/孔),以未接乳酸菌的MRS肉汤作为空白对照,在37 ℃下培养,24 h后测量抑菌圈直径。
1.2.6.4 乳酸菌的抗生素敏感性 参考梁竟一等[21]的方法,采用纸片扩散法[22]测量菌株ZJUIDS09和ZJUIDS11的抗生素敏感性。分别取100 μL菌株ZJUIDS09和ZJUIDS11的菌悬液(约108CFU/mL)于MRS固体培养基上,涂布均匀,然后放置抗生素试纸,在37 ℃下培养,24 h后测量抑菌圈直径。
1.2.7 乳酸菌对不同发酵底物效果比较 将荷斯坦脱脂乳粉按11%浓度加水复配,调整pH至4.6,8000×g离心10 min保留上清液,调上清液pH至7.0得荷斯坦牛乳清;水牛乳由广西水牛所提供,将水牛乳5000×g离心10 min脱脂,然后调整pH4.6,8000 ×g离心10 min保留上清液,调上清液pH至7.0得水牛乳清。使用BCA试剂盒分别测定荷斯坦脱脂乳、荷斯坦乳清、水牛脱脂乳、水牛乳清的蛋白浓度。用超纯水将4种底物的蛋白浓度调整为同一浓度,将菌株ZJUIDS09和ZJUIDS11按3%(v/v)的量接种到这4种底物中,37 ℃发酵48 h,取样测定ACE抑制率。
1.3 数据处理
所有试验均重复3次。采用Graph Pad Prism 8.0软件进行非线性拟合得到回归曲线图;采用SPSS 19.0软件进行单因素方差分析及显著性分析(one-way ANOVA和two-way ANOVA),使用Tukey进行多重比较,试验结果表示为平均值±标准偏差,P<0.05的差异被认为具有统计学意义。
2 结果与分析
2.1 产ACE抑制肽乳酸菌的初筛
对实验室保藏的30多株菌进行脱脂乳发酵实验,测定菌株的水解度在2.74%~7.54%之间,筛选出了13株水解能力最强的菌株(P<0.05)用于后期研究,如图1所示。初筛得到的13种菌株,其蛋白水解度均在5%以上,其中菌株ZJUIDS22和ZJUIDS13的蛋白水解能力最强(P<0.05),水解度分别达7.54%和7.51%。
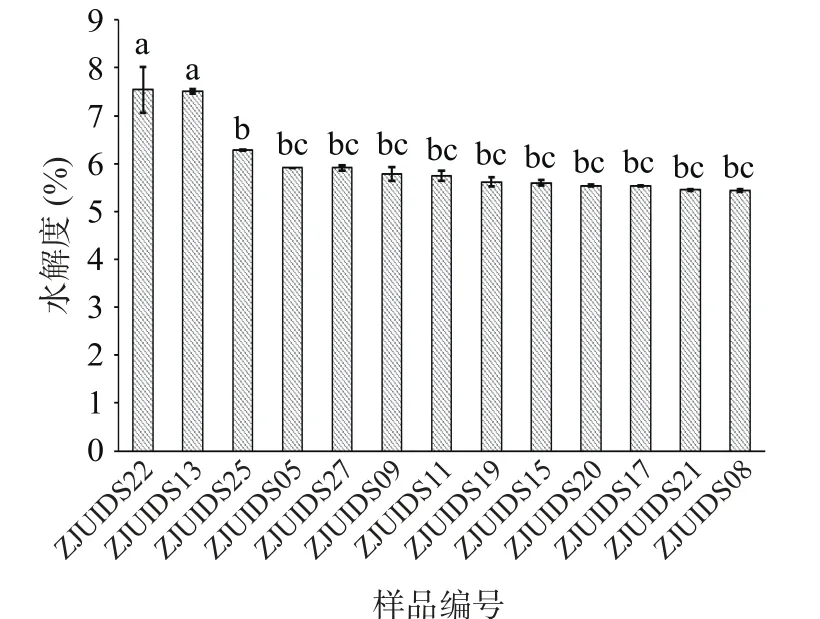
图1 菌株发酵乳的蛋白水解度Fig.1 Protein hydrolysis degree of fermented milk by different strains
2.2 产ACE抑制肽乳酸菌的复筛
对上述筛选到的13株水解能力较强的菌株进行发酵实验,测定ACE抑制率,所得结果见图2。结果显示,抑制效果最好的是菌株ZJUIDS11,其ACE抑制率达90.41%。13株乳酸菌中,有6株乳酸菌发酵乳的ACE抑制率显著高于其它株(P<0.05),其ACE抑制率均在80%以上,筛选该6株菌用于后续的研究。

图2 不同菌株发酵乳的ACE抑制率Fig.2 ACE inhibition rate of fermented milk by different strains
2.3 乳酸菌发酵乳在模拟胃肠液中ACE抑制率的变化
6株菌的发酵乳经人工胃液和肠液消化后的ACE抑制率见图3。6种菌株发酵乳经胃蛋白酶和胰蛋白酶的水解作用后,ACE抑制率全部下降,显著低于消化前(P<0.05)。ZJUIDS09发酵乳经胃液和肠液作用后,ACE抑制率无显著性变化(P>0.05);ZJUIDS11发酵乳经胃液和肠液消化后ACE抑制率先降低后升高(P<0.05);经人工肠液后,ZJUIDS09和ZJUIDS11发酵乳的ACE抑制率分别达到了70.13%±0.15%和76.39%±2.91%,显著高于其它4株菌(P<0.05)。因此,经筛选得ZJUIDS09和ZJUIDS11为富产ACE抑制肽的最佳潜力菌株。
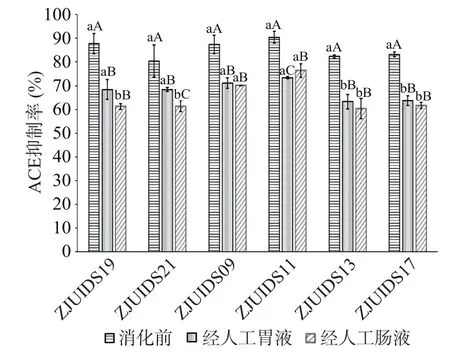
图3 人工胃液和肠液对发酵乳ACE抑制率的影响Fig.3 Effect of artificial gastric juice and intestinal juice on the ACE inhibition rate of fermented milk
2.4 菌株的鉴定和系统发育树构建
经筛选后发现,菌株ZJUIDS09发酵乳的ACE抑制率为87.39%±2.44%,菌株ZJUIDS11发酵乳的ACE抑制率为90.41%±0.99%,两者都能耐受模拟消化环境。送样测定两株菌的16S rDNA序列,将获测序结果进行BLAST序列比对。综合16S rDNA和系统发育树的结果可知(图4),菌株ZJUIDS09为罗伊氏乳杆菌(Limosilactobacillus reuteri),菌株ZJUIDS11为瑞士乳杆菌(Lactobacillus helveticusstrain)。

图4 两株乳酸菌的系统发育树Fig.4 Phylogenetic tree of two lactic acid bacteria
2.5 潜力菌株发酵乳的ACE抑制IC50值测定
ZJUIDS09和ZJUIDS11发酵乳的ACE抑制率与其多肽浓度之间存在明显的量效关系,多肽浓度与ACE抑制率之间的关系如图5A(R2=0.951)和图5B(R2=0.928)所示。根据Graph Pad Prism 8.0软件进行非线性拟合得到ZJUIDS09和ZJUIDS11发酵乳ACE抑制IC50值分别为0.31、0.25 mg/mL(注:IC50定义为ACE抑制率达50%时所需的多肽浓度)。
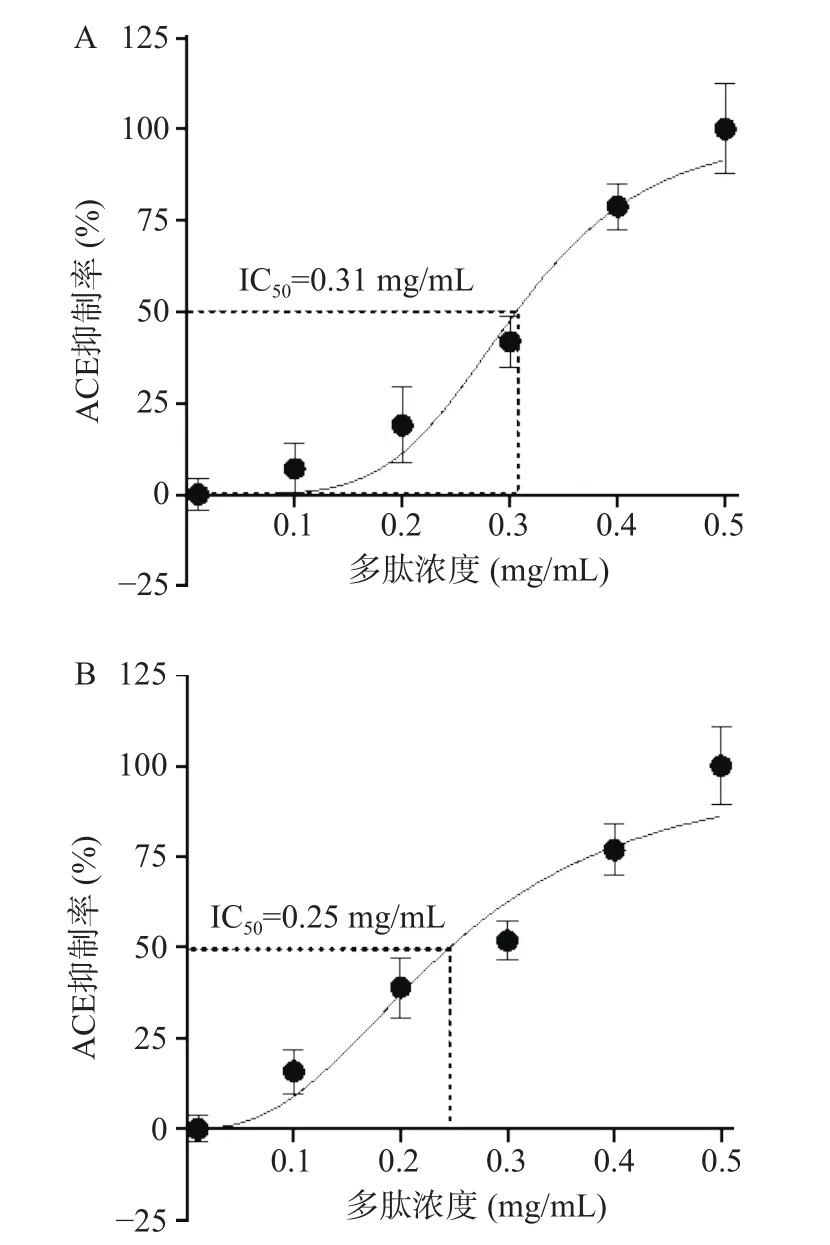
图5 发酵乳的多肽浓度与ACE抑制率间的关系Fig.5 Relationship between the peptide concentration of fermented milk and ACE inhibitory rate
2.6 两株乳酸菌的益生特性
2.6.1 两株乳酸菌的酸耐受率和胆盐耐受率 本试验中,菌株ZJUIDS09和ZJUIDS11的酸耐受率和胆盐耐受率如表1所示。胃液的pH一般在2~3左右,具有酸耐受性的乳酸菌才能进入胃肠道中发挥作用,试验结果显示两株菌的酸耐受率分别为62.50%和152.00%,ZJUIDS11的酸耐受率是ZJUIDS09的2倍以上。人体小肠内的胆盐含量约为0.30%,具有胆盐抗性的乳酸菌才能在小肠中维持活力并发挥益生菌作用,试验结果显示两株菌的胆盐耐受率分别为0.26%和0.004%,表明ZJUIDS09可以耐受小肠的胆盐环境,ZJUIDS11几乎没有胆盐抗性。

表1 乳酸菌的酸、胆盐耐受率Table 1 Acid and bile salt tolerance rate of lactic acid bacteria
2.6.2 两株乳酸菌对4种常见致病菌的抗菌活性 在本试验中,采用4种肠道致病菌作为指示菌,分别检测菌株ZJUIDS09和ZJUIDS11上清液的抑菌活性,数据结果见表2。菌株ZJUIDS09和ZJUIDS11对4种致病菌均有一定的抑制作用,菌株ZJUIDS09对金黄色葡萄球菌和大肠杆菌有显著的抑制效果(P<0.05),抑菌圈达15.25 mm,菌株ZJUIDS11对金黄色葡萄球菌、单核细胞增生李斯特菌和大肠杆菌有显著的抑制效果(P<0.05),其中对单核细胞增生李斯特菌的抑制效果最好,抑菌圈达15.01 mm。因此,菌株ZJUIDS09和ZJUIDS11生长过程中产生的代谢物质具有一定的抗菌活性,对人体肠道健康具有促进作用。
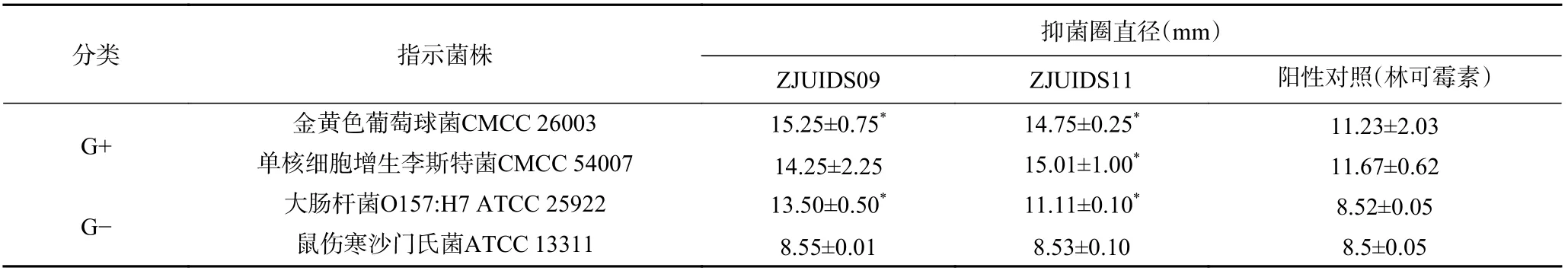
表2 乳酸菌的抑菌活性Table 2 Antibacterial activity of lactic acid bacteria
2.6.3 两株乳酸菌的抗生素敏感性 根据CLSI的药敏试验标准,分别对菌株ZJUIDS09和ZJUIDS11的常见抗生素敏感性进行判断,结果见表3。菌株ZJUIDS09对4种抗生素(氯霉素、红霉素、克拉霉素、林可霉素)呈现敏感状态,其中对氯霉素最敏感,抑菌圈达35.15 mm,对青霉素中度敏感。菌株ZJUIDS11对2种抗生素(红霉素、四环素)呈现敏感状态,其中对红霉素最敏感,抑菌圈达20.51 mm,对氯霉素、克拉霉素和氨苄青霉素中度敏感。试验结果表明两株菌均对红霉素表现出较高的敏感性,对4种常见抗生素(氯霉素、红霉素、克拉霉素、四环素)均无耐药性(注:对抗生素敏感与中度敏感被认为不具备耐药性),菌株安全性较好。

表3 两株乳酸菌的抗生素敏感性Table 3 Antibiotic sensitivity of two lactic acid bacteria
2.7 两株乳酸菌对不同底物的发酵后ACE抑制效果比较
将水牛脱脂乳、水牛乳清、荷斯坦脱脂乳、荷斯坦乳清这4种底物调整为同一蛋白浓度,加入乳酸菌ZJUIDS09和ZJUIDS11进行发酵,测定发酵上清液的ACE抑制率。如图6,不同菌株发酵水牛脱脂乳和水牛乳清,ACE抑制率分别在77.25%~89.92%和34.22%~37.38%之间;不同菌株发酵荷斯坦脱脂乳和荷斯坦乳清,ACE抑制率分别在86.46%~88.48%和37.29%~41.32%之间;无论是荷斯坦脱脂乳还是水牛脱脂乳,发酵后的ACE抑制率都显著高于乳清(P<0.05);对比荷斯坦脱脂乳和水牛脱脂乳发酵后的ACE抑制率,发现二者并无显著性差异(P>0.05);使用不同菌株发酵同一底物,发现其ACE抑制率无显著性差异(P>0.05)。

图6 四种发酵底物的ACE抑制率Fig.6 ACE inhibitory rate of four different fermentation substrates
3 讨论
具有产ACE抑制肽功能的乳酸菌研究[23]受到越来越多的关注,不同菌株的蛋白水解能力存在较大差异[24],菌株发酵乳的蛋白水解度越高,则代表该菌株的蛋白酶解系统越丰富,可以将乳蛋白降解生成大量的多肽,产肽效果较好的菌株更具备生产ACEI肽的潜力。本试验对实验室保藏的30多株菌进行脱脂乳发酵实验,以水解度作为初筛指标选出13株水解蛋白能力最强的菌株(P<0.05),水解度均在5%以上。
乳酸菌[25]酶解乳蛋白释放出ACEI肽,这些短肽可以与ACE活性中心结合,从而阻碍血管紧张素Ⅱ的生成以及促进缓激肽的降解,达到降血压的功效。Li等[26]从41株干酪乳杆菌中,筛选出2株产ACE抑制肽效果最佳的菌株,抑制率最高达73.50%;Chen等[27]从59株瑞士乳杆菌中,筛选出3株产ACE抑制肽的菌株,抑制率最高达81.71%;Pihlanto等[28]筛选出25种具有ACE抑制率的乳酸菌发酵乳,ACE抑制率在5%~74%之间,IC50在0.42~0.52 mg/mL之间;Tsai等[29]使用乳酸菌(嗜热链球菌和保加利亚乳杆菌)和蛋白酶发酵脱脂乳,测定发酵上清的IC50值为0.27 mg/mL;Leclerc等和Fuglsang等[30−31]使用瑞士乳杆菌发酵脱脂乳,测定发酵乳清的IC50为0.16~1.1 mg/mL。本研究从13株水解蛋白能力较强的菌株中筛选出6株产ACEI肽效果较好的菌株,其中罗伊氏乳杆菌ZJUIDS09和瑞士乳杆菌ZJUIDS11发酵乳的ACE抑制率分别达87.39%和90.41%,IC50值分别为0.31和0.25 mg/mL,与上述菌株相比ACE抑制率更强。这可能是因为本试验筛选出的菌株,具有较丰富的蛋白酶系统,其细胞壁蛋白酶、肽链内切酶及氨基肽酶,可以高效地酶解牛乳蛋白,产生的活性肽可以有效且稳定地与ACE活性中心结合,从而抑制ACE的活性。
乳酸菌发酵乳释放的生物活性肽应能抵抗胃肠蛋白酶的消化才能发挥作用[32−33]。一些肽序列在发酵后是无活性的,但是经过胃肠蛋白酶消化后会被激活,一些发酵产生的活性肽在经过胃肠蛋白酶消化后会被水解成小的灭活片段,因此模拟胃肠消化后的ACE抑制率是发酵乳在人体内发挥作用的重要指标。本试验从6株产ACEI肽效果较好的乳酸菌中,通过模拟胃肠消化筛选出2种抗消化的菌株发酵乳,分别是ZJUIDS09和ZJUIDS11。这两种菌株发酵乳在经过胃肠液消化后,ACE抑制率均有所下降,ZJUIDS09菌株发酵乳下降至70.13%,ZJUIDS11菌株发酵乳下降至76.39%。Chen等[34]使用植物乳杆菌L69(Lactobacillus plantarumL69)发酵山羊奶,通过体外胃肠液消化后发现,消化前的ACE抑制率可达79.11%,经胃消化后降至70.22%,最后在肠道环境中维持59.89%,发酵乳经过胃肠消化后ACE抑制率会降低。这与本试验结果较一致,原因可能是乳酸菌生产的ACE抑制肽经胃肠蛋白酶消化后释放出了一些小的失活片段。相比其他学者的试验结果,本试验筛选的这两种菌株发酵乳在经过胃肠液消化后的ACE抑制率仍较为稳定。因此,ZJUIDS09和ZJUIDS11为富产ACE抑制肽的潜力菌株。
胆盐和酸耐受性试验旨在测试乳酸菌是否能够通过模拟人体胃酸和肠道环境,从而提高存活的定植概率。本次试验筛选的两种乳酸菌的酸耐受率均在60%以上,与嗜酸乳杆菌相当[35],具有良好的耐酸性。大部分乳酸菌在胆盐中的存活率都处于0.2%~0.4%之间[36−38],本试验中的罗伊氏乳杆菌ZJUIDS09的胆盐存活率为0.26%,比瑞士乳杆菌ZJUIDS11更有可能在肠道中存活甚至定植。此外,抗菌特性表明这两株菌的代谢产物能在一定程度上抵御肠道有害菌的侵害,罗伊氏乳杆菌ZJUIDS09对金黄色葡萄球菌有较好的抑制效果,瑞士乳杆菌ZJUIDS11对单增李斯特菌有较好的抑制效果。抗生素敏感性结果表明菌株的安全性较好,罗伊氏乳杆菌ZJUIDS09对氯霉素较敏感,瑞士乳杆菌ZJUIDS11对红霉素较敏感。
不同来源(牛、水牛)牛乳的理化特性存在显著差异,不同类型的乳蛋白(乳清蛋白、酪蛋白、脱脂乳)生产的生物活性肽在结构和功能上也有着显著区别[39]。本试验将荷斯坦脱脂乳、荷斯坦乳清、水牛脱脂乳和水牛乳清调整为同一蛋白浓度,经过菌株发酵后对比ACE抑制率,发现以脱脂乳作为发酵底物时的ACE抑制率比乳清高一倍(P<0.05),这表明乳酸菌酶解酪蛋白时生产的ACE肽在效果上比乳清蛋白强。试验发现荷斯坦脱脂乳和水牛脱脂乳发酵后的ACE抑制率无显著性差异(P>0.05),原因可能是牛乳蛋白的序列具有很大的同源性。因此,考虑到经济成本,荷斯坦脱脂乳更适合作为菌株的发酵底物。其中的降压肽的分离及功效评定仍需进一步研究确定。
4 结论
本研究通过比较蛋白水解度、ACE抑制率、模拟胃肠消化后的ACE抑制率,筛选到2株富产抗消化ACE抑制肽的乳酸菌,分别是罗伊氏乳杆菌ZJUIDS09和瑞士乳杆菌ZJUIDS11,ACE抑制率分别为87.39%±2.44%和90.41%±0.99%,IC50值分别为0.31和0.25 mg/mL。在益生特性方面,两株菌对酸和胆盐都有良好的耐受性,且不具备耐药性,对人体健康不存在潜在威胁。经过底物筛选比较得,这两株菌的最佳发酵底物为荷斯坦脱脂乳。研究结果表明罗伊氏乳杆菌ZJUIDS09和瑞士乳杆菌ZJUIDS11发酵乳产ACE抑制肽的能力较好,具有开发降压发酵乳制品的潜力。

