幽门螺杆菌阴性与阳性可切除胃癌的临床特征比较
彭 进 王伟宁 谭 智 叶冠男 周 震
湖南省长沙市第一医院消化内科 410001
幽门螺杆菌感染可引起浅表性胃炎,继而发展为萎缩性胃炎,导致胃酸分泌丧失,进而发展为异型增生和胃癌[1]。与幽门螺杆菌感染阳性胃癌(H.pylori infection positive gastric cancer,HPIP-GC)相比,幽门螺杆菌感染阴性胃癌(H.pylori infection negative gastric cancer,HPIN-GC)的发生率明显较低[2]。先前的研究表明[3],HPIN-GC与HPIP-GC具有不同的临床病理特征和预后,但由于定义上的差异,这些研究并未显示出一致的结果。胃癌的发生是一个复杂的、多因素过程,其中HP感染起着重要作用,是宿主遗传易感因素和环境因素相互作用的结果[4]。一些环境因素,包括吸烟、硝化盐食物和大量饮酒等已被确认为胃癌的独立高风险因素,此外,激活致癌和/或失活抑癌通路的遗传和表观遗传改变的积累也在细胞肿瘤的发生中起着关键作用[5]。因此,本文综合考虑环境因素、遗传易感因素、分子因素以及幽门螺杆菌感染因素等来确定HPIN-GC的特征。
1 对象与方法
1.1 观察对象 选择2010年1月—2019年12月我院收治的340例胃癌患者为观察对象。纳入标准:(1)首次确诊;(2)年龄18~80岁;(3)经病理学诊断确诊为胃癌;(4)临床资料及随访资料完整;(5)对本研究知情同意。排除标准:(1)未接受内窥镜或手术切除;(2)失访或病历不完整;(3)未接受血清胃蛋白酶原(Pepsinogen,PG)检测。入院后通过电子病历系统收集患者的基线资料,包括年龄、性别、吸烟、饮酒和一级亲属的胃癌家族史等。在内窥镜检查时检查或测量受试者的身高和体重,并计算体重指数(BMI)。根据国际肥胖特别工作组对亚太地区人群的标准,BMI分为正常(<23)、超重(23~24.9)和肥胖(≥25)。根据第7版美国癌症协会分期手册确定肿瘤的位置、大小、组织学特征和TNM期。
1.2 方法
1.2.1 血清PG试验与组织学检查对胃萎缩的评价:患者入院后,空腹采集静脉血,使用免疫比浊法测定PGⅠ和Ⅱ的浓度。PGⅠ/Ⅱ比值≤3.0认为患者合并萎缩性胃炎。采用HE染色对每例患者的活检标本进行萎缩性胃炎和肠化生的检测,以评价幽门螺杆菌(H.pylori,Hp)的感染情况。采用更新的悉尼评分系统(0=无,1=轻度,2=中度,3=重度)记录胃黏膜的组织学特征。
1.2.2 幽门螺杆菌检测:取患者活检标本,进行组织学、快速尿素酶试验和培养3种检测,以确定Hp感染状况。将组织标本固定在福尔马林中,通过改良的Giemsa染色评估Hp的存在,另取胃黏膜区标本进行Hp培养,其余组织标本用于快速尿素酶试验。Hp感染被定义为这3种检测方法中至少有1个阳性结果。为了排除既往Hp感染史,笔者进一步采用酶联免疫吸附试验(ELISA)检测每个患者血清中Hp抗体特异性免疫球蛋白G(IgG)的血清阳性率。
1.2.3 免疫组化检测:所有胃组织用多聚甲醛固定,梯度乙醇脱水,二甲苯中水化,石蜡包埋。连续切片约4μm,在100°C条件下进行抗原修复。与兔抗人p53一抗(1∶1 000稀释,美国Abcam)。与辣根过氧化物酶标记的二抗室温下孵育120min。采用ABC试剂盒进行显色。采用PBS代替第一抗体作为阴性对照。
1.2.4 微卫星不稳定性检测:从患者的石蜡包埋组织中提取肿瘤DNA,从周围正常组织中提取正常组织DNA,检测5个微卫星标不稳定(Microsatellite instability,MSI)标志物,包括BAT-25、BAT-26、D2S123、D5S346和D17S250的表达情况。2或2个以上标志物阳性被认为是高频微卫星不稳定性,而<2个标志物阳性被认为是低频率微卫星不稳定或微卫星稳定。
1.3 统计学方法 所有数据均采用SPSS20.0软件进行分析。计数资料采用均数±标准差表示,计数资料采用单因素方差分析,组间比较采用SNK法。P<0.05为差异具有统计学意义。
2 结果
2.1 两组患者临床病理特征比较 340例患者通过3项活检检测,28例(8.24%)患者被确诊为HPIN-GC,322例患者确诊为HPIP-GC。两组的年龄、性别、肿瘤大小、Lauren分型无明显差异(P>0.05)。与HPIP-GC组相比,HPIN-GC组患者的T分期、N分期、TNM分期及PGⅠ/PGⅡ比值明显较高,血清PGⅡ水平明显较低,差异具有统计学意义(P<0.05)。见表1。

表1 两组患者临床病理特征比较
2.2 两组患者组织分子特征 HPIN-GC组MSI-H发生率为21.43%,显著高于HPIP-GC组的8.07%(P<0.05)。HPIN-GC组p53阳性率为28.57%,高于HPIP-GC组的18.63%,但差异无统计学意义(P>0.05)。见表2。
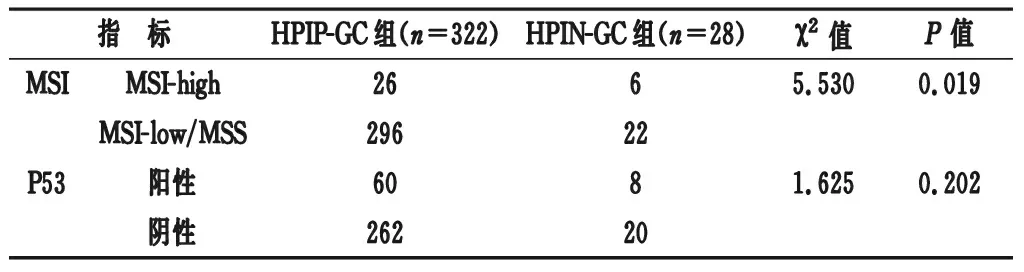
表2 两组患者组织分子特征
2.3 影响患者预后危险因素分析 Cox多因素分析显示,肿瘤大小、MSI状态、P53表达及幽门螺杆菌感染是影响胃癌患者预后的独立性危险因素(P<0.05)。见表3。
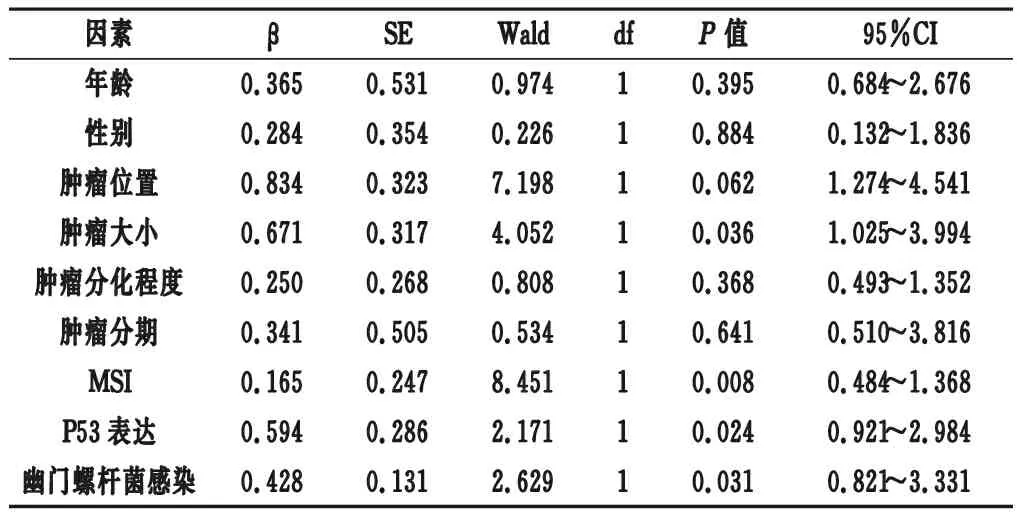
表3 影响患者生存率多因素分析
3 讨论
Hp是至今发现唯一存在于人体胃部内的一种细菌,中国人Hp感染率非常高,有约60%的人群为该菌携带者。Hp已被证明与胃癌、胃炎、消化性溃疡的发生密切相关,已成为一个严重的公共卫生问题[6]。目前,检测Hp的方法很多,包括组织学检查、快速尿素酶试验、Hp培养、Hp抗体检测等。Hp一旦在严重萎缩的黏膜和进展性胃病中长期定植后,可引起胃萎缩和肠化生,因此,根据传统的检测方法,很难确定进展期胃萎缩和肠化生的胃癌患者是否曾感染过Hp[7]。在本文中,采用组织学和血清学双重标准进行诊断,PGⅠ/Ⅱ≤3.0合并中重度胃萎缩和肠化生的存在也被认为是既往Hp的可能。因此,本文中HPIN-GC的实际患病率为8.24%,与以前韩国和日本研究报道的结果相当。
已知癌基因和抑癌基因、细胞周期调节基因和DNA修复基因的遗传、表观遗传改变与胃癌的发生有关。最近的研究表明,胃肠道癌变至少有两条不同的遗传途径,包括抑制子和突变子途径。以MSI为特征的突变子通路和以p53改变为代表的抑制子通路被认为在肿瘤的发生中起重要作用[8]。虽然本文中HPIN-GC的病例数量有限,但HPIN-GC和HPIP-H之间的MSI-H比例也存在显著差异。p53抑癌基因是人类癌症中最常见的突变基因,它的改变或失活可以使DNA受损的细胞逃脱正常生长,导致癌症的发生。据报道[9],p53在胃癌中的阳性表达率为4%~71%。Hp可以通过非突变机制和突变机制影响p53的功能。由于突变型P53蛋白的半衰期比野生型P53蛋白的半衰期长,肿瘤中P53的过度表达被认为是P53突变的另一种形式[10]。因此,深入研究HPIN-GC的分子遗传学对于了解HPIN-GC的确切致癌机制,寻找HPIN-GC的早期诊断标志物具有重要意义。
综上所述,HPIN-GC的发病率较低,其临床病理特征与HPIP-GC相似,但临床分期较晚,是否合并Hp感染是影响胃癌患者的独立性危险因素。但本研究有几个局限性:(1)虽然结合使用了多种诊断方法,将Hp检测结果假阴性的可能性降到最低,但未进行PCR检测。与其他诊断技术相比,PCR更敏感,但通常不在临床环境中使用。(2)本研究仅包括内镜和外科手术治疗的胃癌,排除了姑息化疗或保守治疗的进展期胃癌患者。(3)HPIN-GC在本研究队列中例数相对较少。

