慢性鼻窦炎伴鼻息肉患者鼻腔黏膜组织白细胞介素-17A表达特征及检测临床意义
陈艳丽,宋 鹏,刘接威,徐杨斌,陈丽文
(宁德师范学院附属宁德市医院耳鼻咽喉头颈外科,福建 宁德352000)
慢性鼻窦炎伴鼻息肉(Chronic rhinosinusitis with nasal polypsis,CRSwNP)根据嗜酸性粒细胞(Eosinophils,EOS)浸润程度程度分为嗜酸粒细胞性慢性鼻窦炎伴鼻息肉(Eosinophilic chronic rhinosinusitis with nasal polyps,ECRSwNP)和非嗜酸粒细胞性慢性鼻窦炎伴鼻息肉(non-eosinophilic chronic rhinosinusitis with nasal polyps,nECRSwNP)两类;目前研究[1]证实,东亚人群中nECRSwNP占比更高,可见明显中性粒细胞浸润;同时nECRSwNP患者接受激素治疗效果逊于ECRSwNP。白细胞介素-17A(Interleukin-17A,IL-17A)是人体内常见促炎细胞因子之一,相关研究[2]已证实,其与变应性鼻炎、哮喘、类风湿性关节炎等多种疾病进展关系密切。以往研究[3]证实,CRSwNP患者鼻黏膜组织中IL-17A水平明显增高,但对于IL-17A在nECRSwNP和ECRSwNP人群中表达情况仍无明确定论。此外IL-17A还可加快气道纤维化和气道重塑进程,诱导中性粒细胞聚集,导致激素治疗抵抗发生及哮喘迁延难愈[4]。本次研究纳入我院2018年1月至2020年3月收治行鼻内镜手术治疗CRSwNP患者共84例,分析鼻黏膜组织中IL-17A、CD8+、CD4+、IL-6、转化生长因子-β(Transforming growth factor-β,TGF-β)及IL-23表达情况,采用FCM确定IL-17A来源,探讨nECRSwNP患者IL-17A表达特征及可能机制,现报告如下。
1 资料与方法
1.1 一般资料 研究纳入我院2018年1月至2020年3月收治行鼻内镜手术治疗CRSwNP患者共84例,其中男66例,女18例,年龄18~65岁,平均年龄(37.51±6.80)岁。入选患者根据EOS细胞数占炎症细胞总数比例分组,其中>10%设为ECRSwNP组共28例,≤10%设为nECRSwNP组共56例。病例纳入标准:①符合《中国慢性鼻窦炎诊断和治疗指南(2018)》诊断标准[5];②年龄≥18岁;③鼻黏膜组织标本送检病理;④临床资料完整。排除标准:①伴阿司匹林不耐受三联征;②原发性纤毛运动功能障碍;③近4周内使用糖皮质激素或抗真菌药物;④上颌窦后鼻孔息肉;⑤鼻内镜手术史;⑥自身免疫系统疾病;⑦妊娠哺乳期女性。本研究方案设计符合《赫尔辛基宣言》要求。
1.2 研究方法
1.2.1 标本采集:手术过程中收集鼻息肉、窦口鼻道复合体黏膜组织,去骨质并以0.9%氯化钠溶液清洗表面黏液及血液,放于-80 ℃环境冻存待ELISA法检测;另制备单细胞悬液完成FCM检测。
1.2.2 ELISA法检测:采用ELISA法检测IL-17A、IL-6、IL-23及TGF-β含量,试剂盒由广州艾迪康生物技术有限公司提供,BCA蛋白检测试剂盒由上海生工生物技术有限公司提供。取适量组织标本在液氮中研磨成粉,每100 mg干粉加入1 ml含蛋白酶抑制剂提取缓冲液,4 ℃下10 000 r/min离心10 min,取上清检测并计算被测蛋白浓度。
1.2.3 FCM法检测:FCM检测采用BD FACS Calibur全自动高速分选流式细胞仪;一抗、固定/破膜液及激活剂均由美国达科为公司提供。首先将新鲜组织标本采用PBS充分冲洗,胰酶消化30 min后轻柔研磨;采集滤液制备单细胞悬液;2×106个细胞+2 μl激活剂+1 ml 1640培养基(10%FBS),37 ℃和5% CO2环境下避光染色,培养时间5~6 h。加入UV染料室温下避光孵育30 min后离心收集细胞,加入含细胞表面标记流式抗体100 μl,4 ℃下避光孵育30 min;破膜后加入胞内因子抗体标记,继续4 ℃下避光孵育30 min,最后上样检测及数据分析。
2 结 果
2.1 IL-17A来源 FCM检测结果显示ECRSwNP组和nECRSwNP组患者IL-17A均主要由Tc17细胞和Th17细胞合成,见表1。

表1 FCM法检测IL-17A来源(%)
2.2 两组鼻黏膜组织相关实验室指标比较 nECRSwNP组IL-17A水平、产IL-17A淋巴细胞比例、产IL-17A的CD8+/CD4+T细胞比例及Tc17、Th17细胞比例分别为(157.82±15.89)pg/ml、(10.56±2.80)%、(6.41±1.65)%、(26.96±4.80)%、(3.95±1.87)%、(1.70±0.67)%,均显著高于ECRSwNP组的(9.10±2.33)pg/ml、(3.19±0.65)%、(2.88±0.62)%、(12.49±2.75)%、(1.63±0.93)%、(0.44±0.15)%(均P<0.001),见表2。
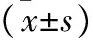
表2 两组鼻黏膜组织相关实验室指标比较
2.3 IL-17A与IL-6、TGF-β及IL-23表达相关性分析 Spearman相关性分析结果显示,IL-17A与IL-6间呈正相关(P<0.001);IL-17A与TGF-β、IL-23间无相关性(均P>0.05)。见表3。

表3 IL-17A与IL-6、TGF-β及IL-23表达的相关性
3 讨 论
慢性鼻-鼻窦炎是一类异质性的鼻腔鼻窦慢性炎症性疾病,主要临床表现包括鼻塞、脓涕或鼻涕倒流、头痛、面部胀痛及嗅觉减退[6]。中国慢性鼻窦炎诊断和治疗指南(2018)根据是否合并鼻息肉将慢性鼻-鼻窦炎分为 CRSwNP和慢性鼻-鼻窦炎不伴鼻息肉(CRSsNP)两类;CRSwNP主要以Th2炎症反应及嗜酸粒细胞浸润为主,而CRSsNP则以Thl炎症反应及非嗜酸性粒细胞浸润为主[7]。慢性鼻-鼻窦炎的发病机制一直是耳鼻喉科亟待解决的问题,目前关于鼻窦炎发病的可能机制有诸多假说;金黄色葡萄球菌超抗原可能与鼻窦炎尤其CRSwNP发生发展有关;CRSwNP患者息肉组织通常含有高水平Th2细胞、IL-5、IL-13及组胺,而嗜酸性组织浸润可能是由于Th2 细胞通过IL-5释放、聚集嗜酸性粒细胞。然而,另一方面似乎能够导致促进Th细胞功能的TGF-β和Treg细胞的总体水平下调,进一步导致了组织水肿和胶原沉积[8]。CRSwNP中观察到的聚集炎性反应通常被分类为由Th2 细胞介导同时合并IL-4、IL-5及IL-13 释放的Ⅱ型炎性反应;另外有文献证明CRSwNP的细胞因子谱及Th细胞类别因地理位置而异,其中中国CRSwNP 患者群体中,Th细胞极性倾向于Th1和Th17,因此约半数患者组织中中性粒细胞水平增加[9]。而另一项研究显示与83%和50%白人患者相比,仅16%的中国CRSwNP 患者表达IL-5,不足10%患者存在组织嗜酸粒细胞[10]。
有学者提出对于CRSwNP患者可根据鼻息肉组织中嗜酸性粒细胞的百分比将CRSwNP分为ECRSwNP和nECRSwNP[11]。IL-17A产生依赖于脂多糖或粒-巨噬细胞集落刺激因子作用于激活单核细胞,主要作用为诱导Th2细胞因子表达,是Th2免疫反应中最重要的调节因子之一,与哮喘、银屑病及类风湿性关节炎发生密切相关[12]。CRSwNP作为一种全球范围性慢性疾病,尽管很少初选致命性疾病结局,但其异质性和易复发性,给患者正常工作生活带来极大影响,给社会经济带来较重负担;而其中异质性和易复发性特征最明显的ECRSwNP作为其中的典型代表,主要表现为组织的嗜酸性粒细胞浸润,且嗜酸性粒细胞水平与患者鼻腔组织重塑有明显的相关性[13]。与西方国家的ECRSwNP高发病率相比,亚洲人群中超过一半(53.6%)的CRSwNP患者表现为nECRSwNP,但考虑到ECRSwNP在复发率方面显著高于nECRSwNP,故ECRSwNP仍获得医学界的广泛重视[14];除一般CRSwNP 的临床表现外,ECRSwNP另一主要临床特征为早期的嗅觉丧失,从现有临床调查数据分析,大部分ECRSwNP患者疾病早期即可出现嗅觉功能减退或丧失情况[15]。
本次研究结果显示,nECRSwNP组IL-17A水平显著高于ECRSwNP组,与以往报道结果相符。有学者研认为IL-17A可刺激鼻黏膜成纤维细胞IL-8、生长调节致癌基因α(GRO-α)等合成量增加,诱导中性粒细胞浸润;同时其还与中性粒细胞相关炎性发生发展关系密切[16],与本次研究结果相符。导致nECRSwNP和ECRSwNP患者鼻黏膜组织中IL-17A表达水平差异原因目前仍存在争议;既往报道证实CRSwNP鼻黏膜组织中IL-17A主要由CD3+T淋巴细胞合成[17-18];本次研究中采用FCM法检测证实,ECRSwNP组和nECRSwNP组患者IL-17A均主要由Tc17细胞和Th17细胞合成;同时两组患者鼻黏膜组织中CD8+和CD4+T细胞比例比较差异无统计学意义;此外nECRSwNP组IL-17A水平、产IL-17A淋巴细胞比例、产IL-17A的CD8+/CD4+T细胞比例及Tc17/Th17细胞比例分别为(157.82±15.89)pg/ml、(10.56±2.80)%、(6.41±1.65)%、(26.96±4.80)%、(3.95±1.87)%、(1.70±0.67)%,均显著高于ECRSwNP组的(9.10±2.33)pg/ml、(3.19±0.65)%、(2.88±0.62)%,(12.49±2.75)%、(1.63±0.93)%、(0.44±0.15)%,以上证据提示nECRSwNP与ECRSwNP患者CD8+和CD4+T细胞数量接近,但nECRSwNP患者分化为Tc17和Th17细胞能力更强。
最新研究[19-21]结果显示,IL-6和TGF-β均是CD4+T细胞向Th17细胞分化的主要激活细胞因子;其中IL-6敲除小鼠往往无法形成Th17细胞应答。IL-23则被证实可直接作用于分化完成的Th17细胞,能够提高Th17细胞稳定性和活性[18]。部分研究[1,12]显示,Th17细胞极化相关细胞因子可调控Tc17细胞分化,同时IL-6和TGF-β水平升高还可诱导CD8+T细胞丧失细胞毒性功能,诱导IL-17合成分泌。对于nECRSwNP患者Tc17、Th17细胞分化能力更强具体机制尚不明确,本次研究中nECRSwNP组IL-6和TGF-β表达水平显著高于ECRSwNP组,但两组间IL-23水平比较差异无统计学意义,推测nECRSwNP患者中IL-6和TGF-β高水平可能与IL-17A高表达有关。进一步采用Spearman相关性分析,结果显示IL-17A与IL-6间呈正相关,但与TGF-β、IL-23间无相关性,说明nECRSwNP患者IL-6和IL-17A间存在相互促进作用,但IL-17A与TGF-β与IL-23并无无相关性,认为这可能与以下因素有关:①TGF-β并非促进IL-17A合成分化的独立影响因素,存在更为复杂未知协同调控作用存在;②IL-17A与IL-23间并无简单协同或抑制效应存在,IL-23可能仅为Tc17、Th17细胞分化终产物,但以上推测仍有待后续研究进一步确证。研究不足:本次研究属于单中心回顾性报道,且纳入样本量较少,所得结论仍有待后续更为深入研究确证;同时对于炎性环境可刺激Tc17、Th17细胞分化具体机制仍有待探索。
综上所述,nECRSwNP患者鼻黏膜组织IL-17A高表达与Tc17、Th17细胞表达分化增强有关,同时IL-17A与IL-6水平间呈正相关,提示该类人群病变组织特殊炎性环境可刺激Tc17、Th17细胞分化。

