腹膜纤维化动物模型的研究进展及中医药的干预
孟立锋,刘前程,吴敏华,刘 鑫,周少华
(1. 广西中医药大学,广西 南宁 530023;2. 广西中医药大学第一附属医院,广西 南宁 530023)
腹膜透析(Peritoneal dialysis,PD)是终末期肾脏病(end stagerenal disease,ESRD)患者有效的肾脏替代疗法,在我国已得到广泛应用。据统计,我国PD人口已逾9万人,占全球 PD 患者总人数的33%[1]。尽管近年来PD患者生存率及技术存活率显著提高[2],但是,由于腹膜炎、腹膜纤维化(peritoneal fibrosis,PF)、透析液的不相容性等原因导致许多患者无法接受长期PD。其中,PF所导致的超滤衰竭(ultrafiltration failure,UFF)是PD患者退出PD最重要的原因。临床研究已经确定了几种防治PF的策略,包括使用新型腹膜透析液[3]、腹透液添加药物单体[4]、间充质干细胞治疗[5]和罗格列酮[6]、维生素B1衍生物都具有有益的作用,但是PF的最佳治疗方案尚未确立,PF仍然威胁PD患者生命。获得PF的病理生理知识并制订相应的治疗策略是改善患者预后的关键,许多关于PF的研究都依赖于体内动物模型或基于体外细胞系统,理想的PF动物模型其疾病进展和特征应与PF患者相似。本文从腹膜纤维化发病机制、实验动物造模方法、每种模型的优缺点及中医药抗腹膜纤维化的应用等方面,总结了近年来常用的感染性腹膜炎、非感染性腹膜炎致腹膜纤维化大鼠模型的研究进展,旨在为腹膜纤维化的发生机制、抗纤维化药物的筛选等研究中的动物模型选择提供参考。
1 PF 的发病机制
尽管PF的主要病因不清楚,但很可能是多因素作用的结果。PD期间,反复发作的腹膜炎症、低生物相容性腹膜透析液的长期暴露、PD开始前尿毒症本身均可能导致腹膜结构改变,包括间皮下增厚和血管病变[7]。持续暴露于这些危险因素最终可能导致PF,但是尚不明确这些因素中每个因素对腹膜损伤发展的贡献程度。
腹膜炎症的反复发作在PF的发生、发展进程中十分重要。首先,反复发作的腹膜炎症是PD患者死亡的重要原因。虽然腹膜炎的病死率仅3%,但它的发生率却很高,每43~47例患者就有1例患者每月发生1次,据报道,16%~18%的PD患者因为感染PD相关性腹膜炎症而死亡[8-10]。其次,反复发作的腹膜炎症是PD患者腹膜免疫功能下降的重要因素。ESRD选择PD患者体内通常存在不同程度的微炎症状态,腹膜长期暴露于低生物相容性腹膜透析液中,对腹膜的结构和免疫功能均产生一定的影响,表现为T细胞中TH2 和 TH1 细胞失去平衡,促炎症因子上调、抗炎症因子下调最终导致免疫紊乱,免疫功能下降。第三,反复发作的腹膜炎症是PD患者残余肾功能下降的风险之一。腹膜炎症发作的次数与残余肾功能水平具有相关性,发生腹膜炎的次数越多残余肾功能水平越低,最终完全无尿。第四,反复发作的腹膜炎症PD患者腹膜损伤的重要原因。腹膜炎能引起腹膜硬化、腹膜纤维化及其导致的腹膜超滤功能衰竭等严重后果,导致PD患者退出PD。
有研究显示,低生物相容性腹膜透析液,特别是那些高渗、高葡萄糖浓度、乳酸含量,低pH值、葡萄糖降解产物(GDPs)和晚期糖基阳离子终产物(AGEs)的溶液可以刺激各种炎症因子上调,如白细胞介素-6(IL-6)、白细胞介素-8(IL-8)等[11]。这些高表达的因子反过来又能促进炎性细胞活化进而加重腹膜损伤,引起腹膜纤维增生。此外,GDPs本身对腹膜细胞有毒性,还能加快AGEs的合成,最终结果是过表达的AGEs与糖基化终产物受体(RAGE)结合,导致RAGE激活并参与介导氧化应激的多种信号通路促进了活性氧(ROS)的上调,引起组织损伤并激活TGF-β/Smad信号传导通路。转化生长因子(TGF-β1)被证实为激活纤维化途径的关键分子[12],可介导腹膜损伤、炎症及纤维化之间的相互转化从而加重腹腔粘连。此外,TGF-β1刺激间皮细胞向肌成纤维细胞转化,诱导腹膜间皮细胞(PMC)发生上皮-间充质转分化(EMT)等致使纤维化的发生[13],并减少降解细胞外基质(ECM)的酶的产生,包括胶原酶、肝素酶和溶血素。因此低生物相容性腹膜透析液在PF的发生、发展中起着重要作用。
上述研究表明,反复发作的腹膜炎症、低生物相容性腹膜透析液的长期暴露等因素在腹膜损伤发展到腹膜功能衰竭中起着至关重要的作用。PF动物模型的建立对改善腹膜炎所致的腹膜损伤、腹膜纤维化有重要意义,对阐明PF的机制和发展以及测试PF的防治有重要的意义。已开发出具有与PD相关性腹膜炎(包括感染性和非感染性腹膜炎)致PF相同的病理特征的动物模型。
2 动物模型
动物模型应基于实际PF中与临床相关的危险因素,迄今为止,由于难以完全再现PF的病理学,已经使用了几种不同的方法,模仿腹膜炎改变腹膜组织来诱导腹膜纤维化。动物模型中建议的腹膜纤维化模型方法包括PD相关的感染性腹膜炎模型、非感染性腹膜炎模型。
2.1感染性腹膜炎模型 感染性腹膜炎是由细菌、真菌或其他微生物感染引起的,包括使用金黄色葡萄球菌、铜绿假单胞菌、白色念珠菌等[14-15],注射方式为反复腹膜内注射或植入导管将真菌、细菌注入腹腔,从而诱导急性腹膜炎症。这些急性传染性腹膜炎模型主要用来阐述腹膜急性炎症或腹膜急性损伤的机制,通常不用于研究PF。Hautem等[16]报道直接腹腔注射细菌内毒素脂多糖(LPS)10 mg/kg诱导腹膜炎,模拟PD合并间歇性炎症刺激致PF,LPS造模方法与临床PD相关性PF比较接近。还有一些学者利用聚维酮碘等增塑剂、酸性溶液和化学刺激物,例如脱氧胆酸盐、二氧化硅或家用漂白剂诱导腹膜炎症致腹膜纤维化[17-18],但报道较少。
感染性腹膜炎致PF模型主要研究了腹膜急性炎症和急性腹膜损伤的机制,能复制出部分PD相关性腹膜炎致PF的特征,可以用于观察不同药物对腹膜炎症的疗效或用于测试防治腹膜炎症的新药。此外,它还可以用于查找腹膜炎症的早期指标。该造模方法的优点是手术过程简单,建立模型所需的时间相对较短。缺点是这些造模方法并未涉及新血管的生成,还容易造成导管堵塞、模型严重感染等后果,病死率较高,因此并未得到广泛的应用。
2.2非感染性腹膜炎模型 随着PD技术的进步,腹膜感染发生率降低,非感染性腹膜炎动物模型亟待构建。各种因素刺激,如高糖腹膜透析液(PDF)、脂多糖、葡萄糖酸盐氯己定(CG)或甲基乙二醛(MGO),都被认为与腹膜纤维化有关。有学者使用脂多糖LPS(0.6 mg/kg)腹腔连续注射7 d引起腹膜损伤模型,结果表现为腹膜厚度增加,TGF-β1显著升高,ECM大量沉积,腹膜超滤显著降低,D4/D0明显降低[19-20];有研究者采用每日腹腔内注射4.25% PDF(100 mL/kg)诱导大鼠腹膜炎症[21];另有报道使用尿毒症大鼠模型采取高糖PDF(100 mL/kg)和LPS(0.6 mg/kg)的造模方法可以建立PD大鼠PF模型,表现为腹膜增厚、成纤维细胞增生、ECM大量沉积,血管增生等纤维化表现[22];此外,有研究使用0.1%葡萄糖酸盐氯己定CG(1 mL/100 g)腹腔连续注射3周后成模,可见模型TGF-β1、α-SMA表达增加[23-24];有学者在模型大鼠腹膜内注射4.25% PDF(100 mL/kg)和20 mM甲基乙二醛(MGO)连续2周诱导PF[25]。另有报道,有一种由机械刮擦腹膜引起腹膜急性炎症从而诱导PF的模型,Nishimura等[26]和Mizuno等[27]首先报道了非感染性腹膜炎刮擦方法诱发的PF模型,Hewitson等[28]改进了这种机械刮擦模型,在刮擦腹膜的基础上每天添加5次酵母聚糖(5 mg/d)诱导腹膜炎、腹膜纤维化。Guo等[29]和Liu等[30]分别使用复制子缺陷并携带转化生长因子β1基因腺病毒,通过腹膜内注射1次给予,引起腹膜纤维化和上皮间质转分化的组织学改变。
在非感染性腹膜炎模型中,MGO、CG、PDF+LPS等腹腔注射的方法优点是手术过程简单,重复性较好,但反复穿刺可能有腹膜机械损伤及刺破内脏的风险。经导管注射可以避免这种反复穿刺的机械损伤,并且将导管植入腹腔最能真实地模拟临床PD情况。此外,腹腔置管还能用来了解在PD过程中导管对腹膜的作用情况。缺点是外科手术难度较大,如果喂食,可能由于较高的感染风险而导致病死率增加[31]。转基因动物PF大鼠模型虽出现血管增生、腹膜高转运等表现,但价格较贵、且要求的材料及技术水平较高,限制了其推广应用。现以所查文献做腹膜炎动物模型特点的简单评估,见表1。
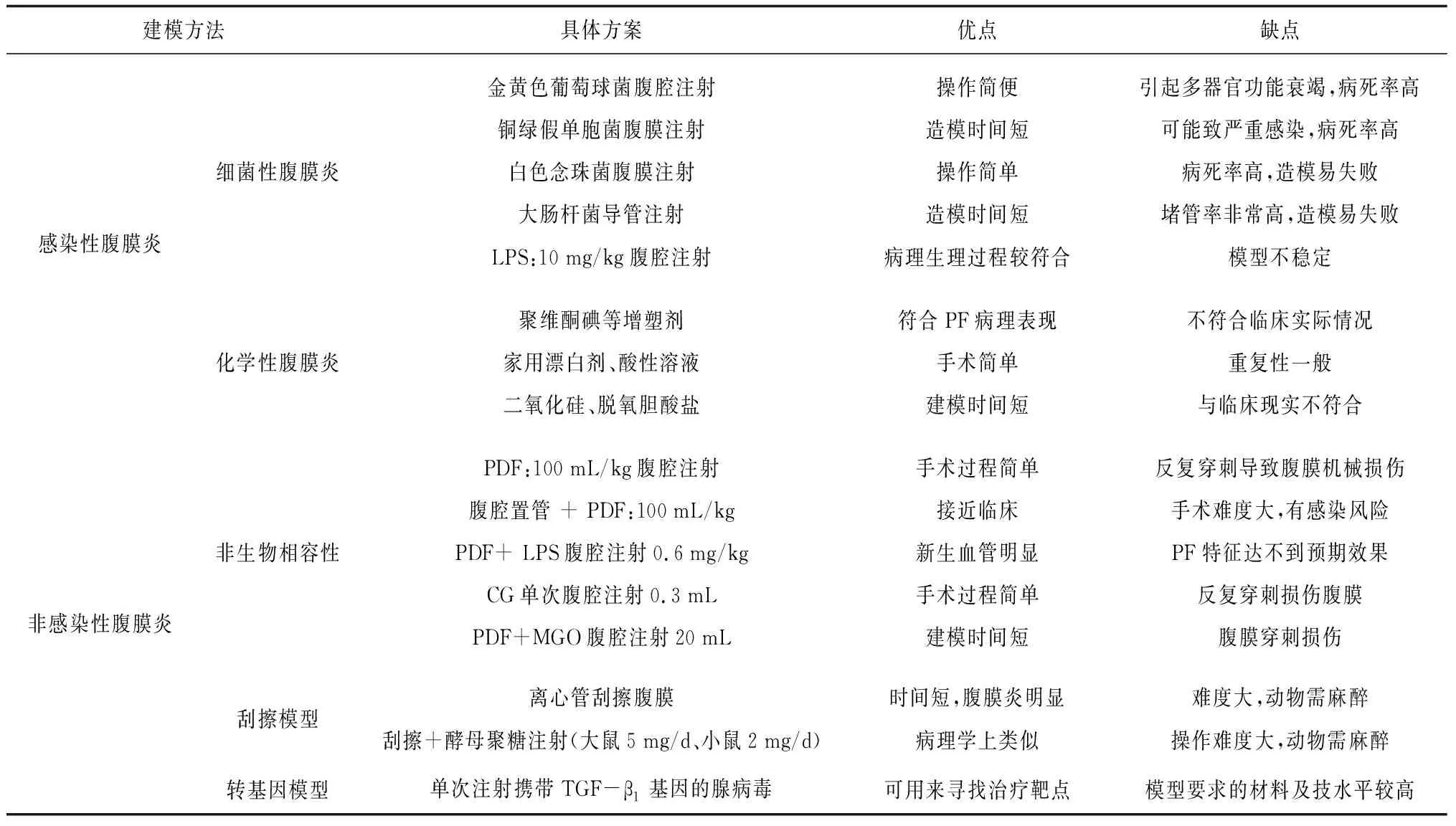
表1 感染性、非感染性腹膜炎动物模型的特点
2.3动物模型的局限性 尽管以非生物相容性透析液(如PDF+LPS)注射的实验模型考虑了腹膜长期暴露于生物不相容的腹膜透析液、PD 微炎症状态、PD开始前尿毒症本身对PF的影响。但应使用正确反映PF发病机制(尤其是腹膜炎症和新生血管形成)的合适的动物模型来探讨合适的PF治疗方法。然而,单纯利用腹膜在非生物相容性腹透液长期暴露的方法很难制作出与人类PF相一致的动物模型。其中一个因素是时间跨度:腹膜透析患者需要很长时间才能发生PD相关性PF,但在动物模型中诱导的腹膜纤维化改变却发生在很短的时间内,一般在4周以内。此外,用于造模的试剂通常被注射到腹膜腔内,反复穿刺会对腹膜组织造成机械性损伤[32]及多次腹腔注射本身引起的感染均可能干预实验结果。
在使用动物模型时,物种和品系的选择至关重要。在 PD相关性PF或腹膜炎的模型中多使用龋齿动物:大鼠或小鼠。大鼠和小鼠模型之间的主要区别是建立模型所需的时间长短以及所用药物的量。通常要获得相同的结果,大鼠模型需要的药物和时间更多。大鼠的优势在于它可以获得相对较多的样品,但其需要的药物及时间也更多。另一方面,由于转基因模型的载体多为小鼠,使用小鼠进行机制研究将更具有优势[33]。因此,动物种类和品系的差异可能会影响活体研究的结果,需要在动物模型中仔细评估腹膜结构和功能。
3 PF动物模型的中医药治疗策略
长期使用 PD 治疗最终会导致PF、超滤失败和 PD 中断。当前没有有效的疗法来预防或延迟这种病理过程,其原因为对PF的发病机制认识有限及治疗途径狭窄。研究表明,临床上许多现代抗纤维化药物可能有效,但存在一些较大的不良反应,如干咳、血肌酐水平增高等[34]; 中医中药具有疗效好、毒副作用较小及价格便宜等优点,成为近年来防治PD相关性腹膜纤维化研究热点[35]。中医药的应用在纤维化动物模型抗纤维化研究中取得长足进展。
3.1中药策略 近年来,通过应用不同的PF动物模型,发现许多中药,包括中药单体、中药复方及中成药等对PD相关性PF防治具有重要作用。其中,利用动物模型结合其他交叉学科、新技术,如中医中药治疗PF机制可呈现在代谢组学、蛋白质组学、基因组学、肠道菌群、免疫等方面,并取得一定的进展,见表2。通过探究中医药治病机制的过程也可为全面认识PF提供了更好的研究方向。

表2 PF动物模型在抗纤维化中医药研究中的应用
3.2针灸策略 通过中药的应用,我们可以看出中医药在防治腹膜炎症、PF中的潜力和优势。但PF患者病情急、相关并发症多,口服药物可能具有的肾脏毒性,不利于残余肾功能的保护。研究显示,针灸可以改善PD患者肾功能,提高患者生活质量。姜新龙等[36]通过临床发现针灸可改善患者临床症状,减轻尿蛋白生成,改善肾功能;Yu等[37]发现针刺治疗后,SCr下降、肾小球滤过率上升患者肾功能得到改善;聂峰等[38]针灸患者后发现,患者24 h尿蛋白定量下降明显,SCr明显降低,患者肾功能得到改善。
3.3中医“证候”的腹膜纤维化动物模型 辨证论治是中医的特色,在中医药抗PD相关性PF中据有重要地位;建立中医PF“证候”的动物模型,是中医药抗PD相关性PF研究的难点之一。一些学者结合中医基础理论,就建立腹膜纤维化对应的中医“证候”动物模型进行了有益探讨。孟立锋等[39]采5/6肾切除联合腹腔注射PDF造模法,发现大鼠出现毛发稀疏、反应迟钝、喜好蜷卧等症状,且逐渐出现形体消瘦等症状,建立了中医脾气亏虚证的PF动物模型。郑登勇等[40]认为PF中医亦属于“微型癥积”“血瘀证”范畴,PDF联合LPS腹腔注射可建立血瘀证型PF动物模型。此外,还有研究认为痰瘀交结是腹膜纤维化的主要病机,采取PDF加红霉素腹腔注射可建立痰瘀交结证型PF模型[41]。
4 小结与展望
获得PF的病理生理知识并制订相应的防治手段对改善患者预后至关重要;使用PF动物模型并评估可能导致PF的危险因素对研究PF病理生理过程至关重要;建立标准PF模型对于分析数据并使之适应临床至关重要。但由于临床PD相关性PF发病的复杂性,目前暂无公认的用于PF研究的标准模型,也难以完全复制PF的病理生理过程,各研究中模型动物的选择、造模方法、给药途径、模型评价方法等也存在较大差别。研究者基于不同的研究目的、研究方向去选择合适的PF动物模型,在现有的啮齿类动物外,重视非啮齿类PF动物模型的研究,更精准地模拟PD患者临床状况,是今后研究的重点之一。PF动物模型应用于中医药抗PD相关性PF的研究取得了一定的进展,表明中医药在一定水平可以改善腹膜超滤功能,延缓腹膜超滤衰竭发生的时间,弥补了当前PDF和PD技术本身的欠缺,有着不错的研究远景。当前,大多数研究偏重于相应的药理实验研究,选择动物模型的标准也未十分明确。如何将传统中医理论与现代新技术和交叉学科联合应用,从而深入探究PD相关性PF的病理、药物作用机制,是一个很有意义的探索方向。
利益冲突:所有作者均声明不存在利益冲突。

