活性炭微生物限度检查方法探究
邹 云,孙 康,陈 芳
(1.宣城市食品药品检验中心,安徽 宣城 242000;2.中国林业科学研究院林产化学工业研究所,江苏 南京 210042;3.宁国市食品药品检验所,安徽 宁国 242300)
0 引言
活性炭(供注射用)标准收载于《中国药典》2020年版四部,是2015版时新收载的药用辅料[1],较之前用于注射剂的木质活性炭标准显著提高,其中对微生物有明确的限度要求,具体检验方法应按药典要求进行方法适用性试验,但因活性炭外观颜色、理化特性比较特殊[2],在全面考虑试验的同时要强调注意事项,因为关键点直接影响方法运行的可行性。
1 材料与试剂
1.1 活性炭(供注射用)样品
宁国市恒达活性炭有限公司,批号为20201104(记为样Ⅰ)、批号为20201105(记为样Ⅱ)、批号为20201104(记为样Ⅲ)活性炭(供注射用)样品采用干热灭菌工艺生产,国内首创,活性炭(供注射用)产品研发项目列入2020年度安徽省重点研究与开发计划长三角科技创新联合攻关专项。样品为黑色粉末,粉碎度61~75 μm(200~240目)占80%以上,依据《〈中国药典>2020年版四部》质量标准检验[1]。
1.2 培养基及试剂
胰酪大豆胨琼脂培养基、胰酪大豆胨液体培养基、沙氏葡萄糖琼脂培养基、肠道菌增菌液体培养基、紫红胆盐葡萄糖琼脂培养基、麦康凯液体培养基、麦康凯琼脂培养基、RV沙门增菌液体培养基、木糖赖氨酸脱氧胆酸盐琼脂培养基、三糖铁琼脂培养基(以上培养基生产厂家均为北京三药科技开发有限公司)、氯化三苯基四氮唑(TTC,红四氮唑,罗恩试剂)。
1.3 菌种
大肠埃希菌(Escherichiacoli)[CMCC(B)44 102];乙型副伤寒沙门菌(SalmonellaparatyphiB)[CMCC(B)50 094];金黄色葡萄球菌(Staphylococcus aureus)[CMCC(B)26 003];铜绿假单胞菌(Pseudomonasaeruginosa)[CMCC(B)10 104];枯草芽孢杆菌(Bacillussubtilis)[CMCC(B)63 501];黑曲霉(Aspergillusniger)[CMCC(F)98 003];白色念珠菌(Candidaalbicans)[CMCC(F)98 001],以上菌种均来自北京三药科技开发有限公司,中国食品药品检定研究院监制。
1.4 仪器
恒温培养箱和Ⅱ级生物安全柜。
2 试验环境
该方法适用性试验在环境洁净度D级背景下的B级单向流空气区域内进行。试验全过程严格遵守无菌操作,防止再污染。单向流空气区域、工作台面及环境已定期按医药工艺洁净室(区)悬浮粒子、浮游菌和沉降菌的测试方法的现行国家标准进行洁净度验证合格[3-4]。
3 菌液制备
按药典操作制成不大于100 cfu/mL的大肠埃希菌、乙型副伤寒沙门菌、金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、黑曲霉和白色念珠菌的菌悬液。
4 微生物计数方法适用性试验
根据供试品的理化特性与生物学特性,采取适宜的方法制备供试液。取供试品10 g,用pH 7.0无菌氯化钠-蛋白胨缓冲液100 mL溶解或稀释制成1∶10供试液。但因样品外观颜色等特殊性,稀释后的样品溶液显墨汁样深黑色,平皿法培养后进行微生物计数时,不利于需氧菌、霉菌和酵母菌菌落的观察、识别和计数。先后经多次试验:(1)1∶10供试液取1 mL每皿试验时因活性炭颜色太深试验组无法计数。(2)1∶10供试液取0.5 mL每皿试验时也因活性炭颜色太深试验组菌落无法计数。(3)采用薄膜过滤法,因1∶10供试液中活性炭颗粒过大,无法通过滤膜被截留,此方法不可行。(4)采用低速离心(500 r/min,离心5 min)法,虽然将1∶10供试液中的活性炭固体物质分离,但除黑曲霉外的4种菌回收率均达不到,考虑活性炭吸附力较强所致,此法不可行。(5)采用1∶10供试液取0.2 mL每皿试验,结果各菌回收率达到要求,且便于观察计数,此具体试验过程及数据如下。
4.1 供试液的制备
取供试品10 g,加入100 mL pH 7.0无菌氯化钠-蛋白胨缓冲液中,摇匀,使分散均匀,制成1∶10供试液[5]。
4.2 接种和稀释
4.2.1 试验组取上述制备好的1∶10供试液0.2 mL共10份,分别置10个直径90 mm的无菌平皿中,每皿分别加入上述制备好的不大于100 cfu/mL菌液1 mL,再分别注入15~20 mL温度不超过45 ℃熔化的胰酪大豆胨琼脂(含0.001%TTC)或沙氏葡萄糖琼脂培养基,混匀,凝固,倒置培养。为了保证科学准确,先加的5皿菌落平均值为1份,后加的5皿菌落平均值为平行制备的第2份,每种菌均按上述方法试验。
4.2.2 供试品对照组取制备好的供试液,以稀释液代替菌液,同试验组操作。
4.2.3 菌液对照组取上述制备好的不大于100 cfu/mL菌液1 mL,置直径90 mm的无菌平皿中,注入15~20 mL温度不超过45 ℃熔化的胰酪大豆胨琼脂(含0.001%TTC)或沙氏葡萄糖琼脂培养基,混匀,凝固,倒置培养。每个菌种平行制备2平皿,按规定条件培养、计数。
4.3 回收率试验数据与结果
样Ⅰ,Ⅱ,Ⅲ的测量数据分别如表1—3所示。
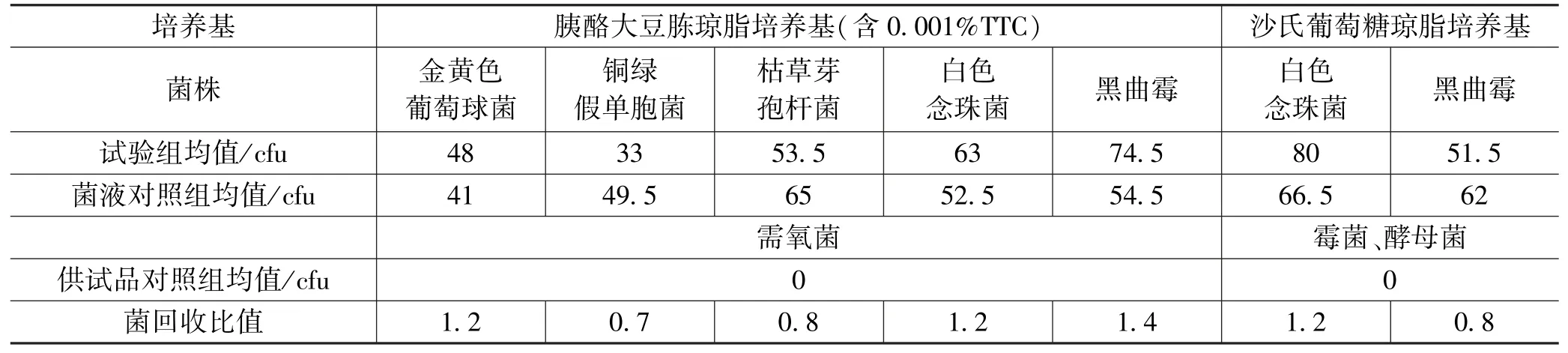
表1 样Ⅰ测量数据
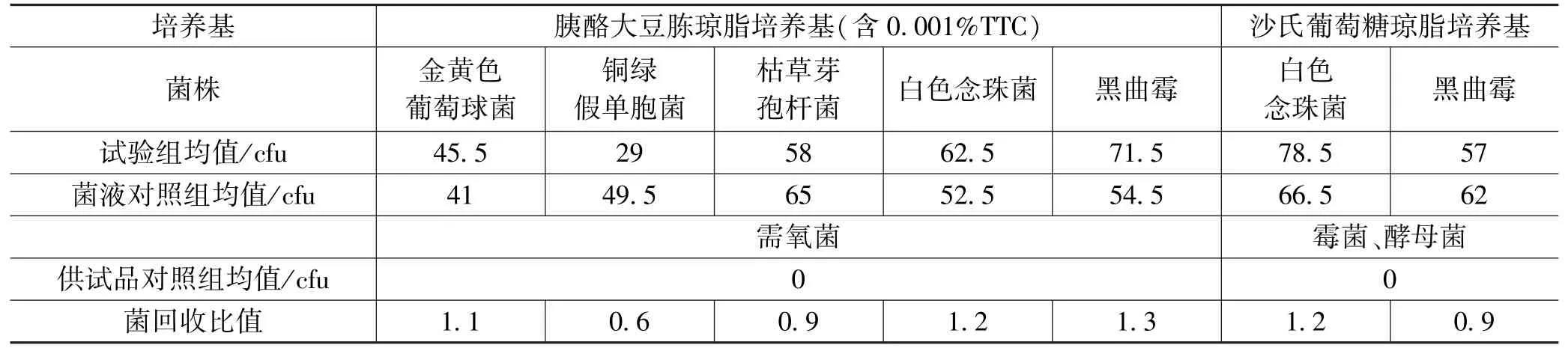
表2 样Ⅱ测量数据
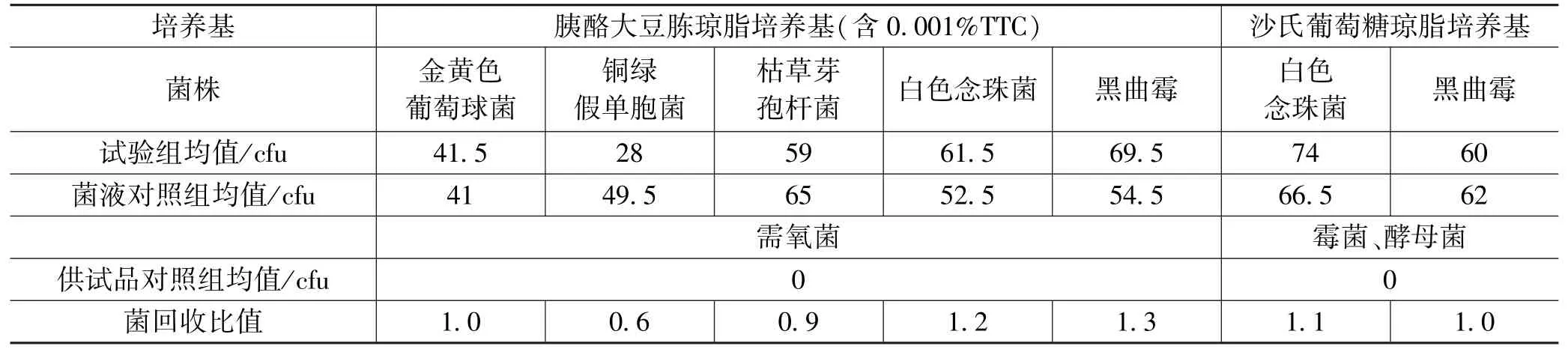
表3 样Ⅲ测量数据
4.4 结果判断
试验组菌落数减去供试品对照组菌落数的值与菌液对照组菌落数的比值应在0.5~2范围内;从表1,2和3可知,若各试验菌的回收试验均符合要求,对照所用的供试液制备方法及计数方法进行该供试品的需氧菌总数、霉菌和酵母菌总数计数,上述试验比值均符合要求。
5 控制菌检查方法适用性试验
5.1 大肠埃希菌
5.1.1 供试液制备
同上述4.1制备的1∶10供试液。
5.1.2 试验菌大肠埃希菌[上述制备好的不大于100 cfu/mL菌液]。
5.1.3 操作方法
取胰酪大豆胨液体培养基4份,每份100 mL,第1份加入1∶10供试液10 mL,第2份加入1∶10供试液10 mL及不大于100 cfu的大肠埃希菌液(1 mL),第3份加入不大于100 cfu的大肠埃希菌液(1 mL),第4份加入与供试品溶液等量的稀释剂10 mL。上述4份同置35 ℃培养箱中培养18 h后,各取1 mL,接种至100 mL麦康凯液体培养基中,43 ℃培养24 h。取麦康凯液体培养物划线接种于麦康凯琼脂培养基平板上,35 ℃培养18 h,看平板菌落生长情况(见表4)。
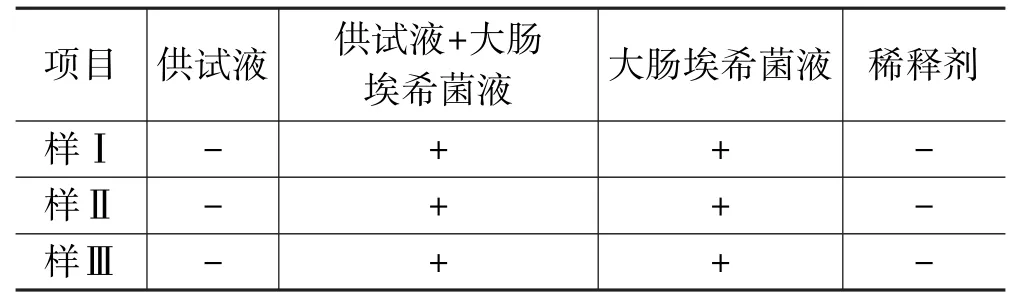
表4 大肠埃希菌检查方法适用性试验(麦康凯琼脂培养基)
5.1.4 结果判断从表4可以看出,加入菌液的供试液均检出试验菌,说明供试品对大肠埃希菌无明显抗菌作用,该控制菌检验方法的专属性好,方法可行。
5.2 沙门菌
5.2.1 试验菌乙型副伤寒沙门菌[上述制备好的不大于100 cfu/mL菌液]。
5.2.2 操作方法
取胰酪大豆胨液体培养基4份,每份100 mL,第1份加入供试品10 g,第2份加入供试品10 g及不大于100 cfu的乙型副伤寒沙门菌液(1 mL),第3份加入不大于100 cfu的乙型副伤寒沙门菌液(1 mL),第4份作为空白对照。将上述4份同置35 ℃培养箱中培养18 h后,各取0.1 mL,分别接种至10 mL RV沙门增菌液体培养基中,35 ℃培养箱培养18 h后,取少量RV沙门增菌液体培养物分别划线接种于木糖赖氨酸脱氧胆酸盐琼脂培养基平板上,35 ℃培养18 h,看平板菌体生长情况。用接种针挑选疑似菌落于三糖铁琼脂培养基高层斜面上进行斜面和高层穿刺接种,培养18 h,查看培养结果(见表5)。
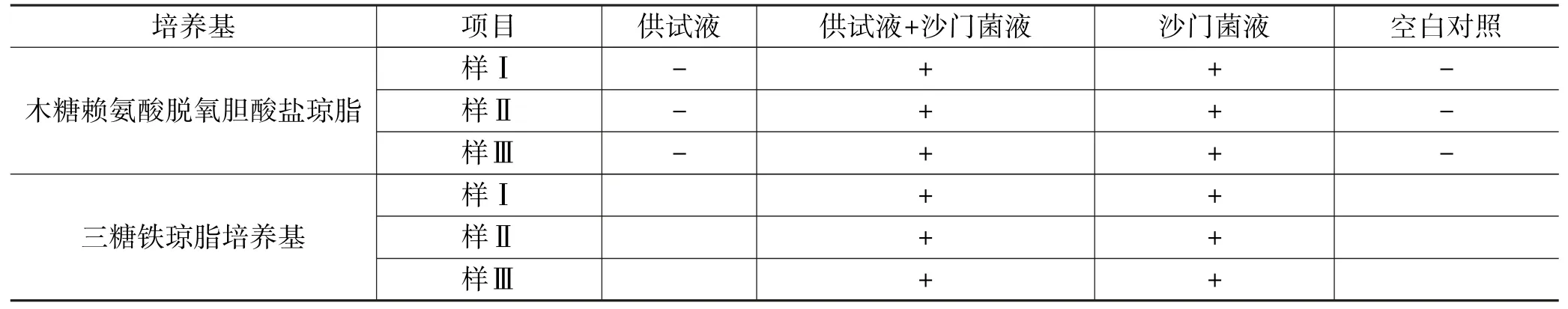
表5 沙门菌检查方法适用性试验
5.2.3 结果判断从表5可以看出,加入菌液的供试液均检出试验菌,说明供试品对沙门菌无明显抗菌作用,该控制菌检验方法的专属性好,方法可行。
6 结语
活性炭(供注射用)微生物限度检查中:微生物计数法(需氧菌总数、霉菌及酵母菌总数的检查)采用培养基稀释法,即称取供试品10 g,加pH 7.0无菌氯化钠-蛋白胨缓冲液100 mL,混匀,作为1∶10的供试液。取1∶10供试液按0.2毫升每皿进行注皿试验(5皿合计为1 mL计数);控制菌检查用常规法,大肠埃希菌检查取1∶10供试液10 mL加至100 mL胰酪大豆胨液体培养基中进行增菌培养后按规定试验;沙门菌检查称取10 g供试品加至100 mL胰酪大豆胨液体培养基中进行增菌培养后按规定试验。
因活性炭(供注射用)样品为黑色,影响菌落观察计数,使用的胰酪大豆胨琼脂培养基需加TTC使含0.001%TTC,以便菌落显色观察计数;含供试液的平皿注入培养基后要格外注意手动慢摇,使供试液充分分散并与培养基混合均匀。

