Hp感染性胃溃疡患者血清炎症因子、MMP-9和TIMP-1水平变化及其与炎性活动度的相关性
袁浩壬,付晓林
鞍钢集团公司总医院消化内科,辽宁 鞍山 114002
1.1 一般资料 回顾性分析2020 年2 月至2021年3月鞍钢集团公司总医院收治的140例胃溃疡患者临床资料。纳入标准:①符合胃溃疡临床诊断标准[5];②可正常沟通交流且具有一定执行力;③溃疡直径3~20 mm;④ 入组前3个月内未接受免疫调节剂、质子泵抑制剂治疗。排除标准:①合并胃出血、胃穿孔等并发症;② 急慢性感染性疾病或恶性肿瘤疾病;③沟通障碍,无法配合研究;④ 癌前病变、复合性溃疡;⑤预计生存期限<6 个月;⑥ 肝、肾、心功能严重障碍。根据Hp 感染情况将80 例Hp 感染性胃溃疡患者设为观察组,60 例非Hp 感染性胃溃疡患者设为对照组。
胃溃疡是临床多发消化系统疾病,其中幽门螺杆菌(Helicobacter pylori,Hp 是诱导胃溃疡发生的首要原因,可引起胃出血、胃穿孔,威胁人们身体健康[1]。数据显示,Hp感染性胃溃疡约占胃溃疡总数的4/5,随着医疗水平的提高,Hp感染性胃溃疡的治疗虽有较理想效果,但受其高患病率的影响,治疗有效率仍有待提高[2]。研究表明,Hp的致癌作用较强,当其受到感染后会诱导胃黏膜出现慢性炎症反应,进一步损伤临近组织,诱导病情恶化[3]。故如何有效诊治、监测Hp 感染性胃溃疡病情变化对提高治疗效果有重要意义。资料表明,炎症反应,如白细胞介素-8(IL-8)、基质金属蛋白酶-9 (matrix metalloproteinase-9,MMP-9)、血清肿瘤坏死因子-α(TNF-α)、基质金属蛋白酶抑制剂-1(tissue inhibitor of metalloproteinase 1,TIMP-1)与呼吸道疾病、肿瘤疾病、心血管疾病密切相关,但关于其与Hp感染性胃溃疡是否相关的报道较少[4]。本研究旨在观察Hp 感染性胃溃疡与血清炎症因子、MMP-9、TIMP-1 的水平变化,并分析其与炎性活动度的相关性,现报道如下:
1 资料与方法
观察组患者中男性47 例,女性33 例;年龄45~65 岁,平均(54.21±3.02)岁;Hp 感染程度:轻度18 例,中度25例,重度37例。对照组患者中男性32例,女性28例;年龄46~66岁,平均(53.98±3.21)岁;Hp感染程度:轻度10例,中度20例,重度30例。两组患者的一般资料比较差异均无统计学意义(P>0.05),具有可比性。本研究经我院伦理委员会批准。
1.2 方法
1.2.1 Hp感染判定 在电子胃镜辅助下,选择溃疡旁、胃窦距离幽门2.0~3.0 cm处取胃黏膜组织,采用快速尿素酶、美蓝染色测定Hp感染情况,结果显示阳性则为Hp感染。
1.2.2 Hp 感染程度标准[6]轻度:<标本组织长度30%存在少量Hp;中度:Hp 稀薄、连续分布上皮表面或达到组织长度的31%~60%;重度:组织长度>60%且Hp量多。
1.2.3 炎症因子检测 采集患者空腹静脉血3~5 mL,置于含有抗凝剂的无菌采血管中,以3 000 r/min 的速度离心(r=3 cm)处理5 min 分离血清,用ELISA 法(生产厂家:武汉宏鑫生物工程公司)测定TNF-α、IL-8、MMP-9、TIMP-1 水平,步骤按试剂盒说明书进行。
1.2.4 炎性活动度标准[7]轻度:黏膜浅层有少量中性粒细胞且<1/3;中度:黏膜层出现大量中性粒细胞,且可见于表面上皮细胞、小凹上皮细胞;重度:中性粒细胞密集分布,达到黏膜全层,小凹脓肿可见。
1.3 观察指标 比较两组患者的血清TNF-α、IL-8、MMP-9、TIMP-1的水平及炎性活动度;分析Hp感染性胃溃疡患者肿瘤坏死因子-α、白细胞介素-8、MMP-9、TIMP-1与炎性活动度的相关性。
1.4 统计学方法 应用SPSS21.0 统计软件分析数据。计量资料以均数±标准差()表示,两两比较采用LSD-t检验,多组间比较采用方差分析,计数资料比较采用χ2检验,等级资料采用秩和检验,相关性采用Spearman 相关性分析法分析。以P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者的血清炎症因子、MMP-9、TIMP-1水平比较 观察组患者的TNF-α、IL-8、MMP-9、TIMP-1 水平明显高于对照组,差异均有统计学意义(P<0.05),见表1。
表1 两组患者的血清炎症因子、MMP-9、TIMP-1水平比较()
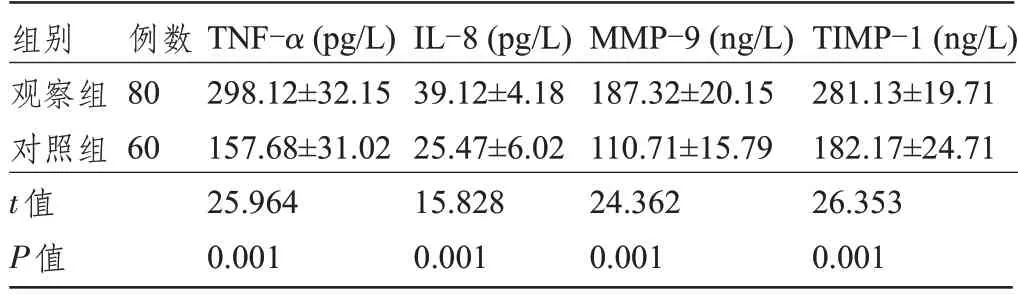
表1 两组患者的血清炎症因子、MMP-9、TIMP-1水平比较()
2.2 两组患者的炎性活动度比较 两组患者的炎性活动度比较差异有统计学意义(Z=4.214,P=0.028<0.05),见表2。

表2 两组患者的炎性活动度比较[例(%)]
2.3 不同炎性活动度Hp感染性胃溃疡患者的血清炎症因子、MMP-9、TIMP-1 水平比较 重度Hp 感染性胃溃疡患者的肿瘤坏死因子-α、白细胞介素-8、MMP-9、TIMP-1 水平明显高于中度、轻度Hp 感染性胃溃疡患者,且中度者上述指标高于轻度者,差异均有统计学意义(P<0.05),见表3。
表3 不同炎性活动度Hp感染性胃溃疡患者血清炎症因子、MMP-9、TIMP-1水平比较()
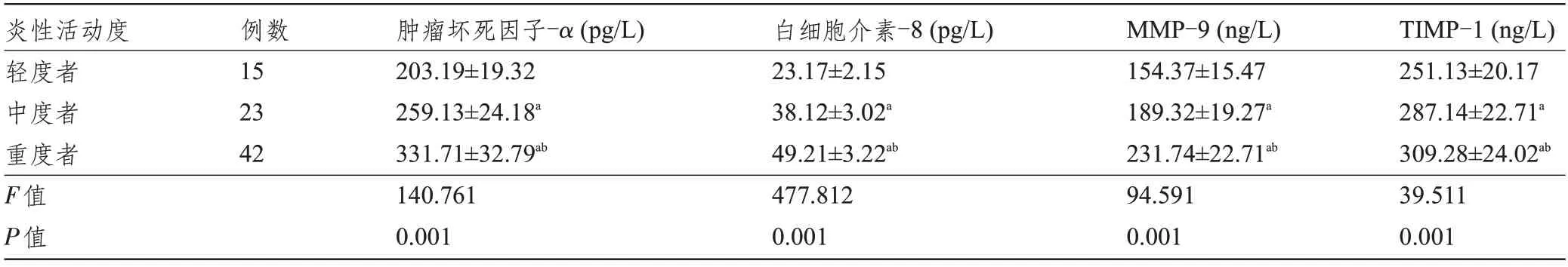
表3 不同炎性活动度Hp感染性胃溃疡患者血清炎症因子、MMP-9、TIMP-1水平比较()
注:与轻度者比较,aP<0.05;与中度者比较,bP<0.05。
2.4 TNF-α、IL-8、MMP-9、TIMP-1 与炎性活动度的相关性 经Spearman 相关性分析结果显示:TNF-α、IL-8、MMP-9、TIMP-1 水平均与炎性活动性呈正相关(r=0.771、0.864、0.397、0.419,P<0.05)。
3 讨论
Hp是诱导胃溃疡的首要致病因子,主要寄居于胃幽门部,当患者遭受Hp 感染后会产生大量的毒力因子,如脂多糖、黏附因子等,其中脂多糖主要存在于内毒效应之中,可诱导细胞因子大量释放,进而导致胃上皮细胞与层黏素之间相互作用,导致病情加重[8];另外尿毒酶又可分解氨,损伤胃黏膜屏障,有碍细胞能量的正常代谢,可见Hp感染与胃溃疡的发生、进展密切相关[9]。资料表明,当Hp 感染后,中性粒细胞会不同程度浸润胃黏膜表面,通过观察其高低能够反映Hp感染性胃溃疡患者的病情严重程度,但缺乏客观数据评价患者病情及炎症程度[10]。
目前,关于Hp 感染慢性胃炎患者炎症因子水平与病情间关系尚无定论。因此本研究笔者分析了炎症因子(TNF-α、IL-8及MMP-9、TIMP-1)与病情之间的关系,旨在为后期临床诊疗提供依据。IL-8为中性粒细胞因子,其贯穿整个炎症反应发展的始终,通过监测其水平变化可了解病情严重程度[11]。KONTUREK 等[12]研究指出,IL-8 是诱导Hp 感染胃炎的主要细胞因子,对激活炎症反应相关信号通路有促进作用。TNF-α具有活化淋巴、中性粒细胞的作用,被认为是炎症反应的启动因子,对炎症细胞黏附、浸润具有促进作用,可局部聚集后产生趋化作用,进一步诱导炎症发生[13-14]。巩会杰等[15]研究指出,Hp 感染后会诱导体内的免疫应答系统出现炎症反应,进而诱导炎症反应,如:TNF-α、IL-8 水平上升。本研究表明,Hp感染性胃溃疡患者TNF-α、IL-8 水平高于非Hp 感染性胃溃疡者,与上述报道相似,可见TNF-α、IL-8 与Hp感染性胃溃疡的发生密不可分。
MMP 被认为是内肽酶的总称,其主要是通过酶原活化、抑制、合成等调控其对应的TIMP 表达,满足生理状态下MMP 及TIMP 处于相对平衡、稳定状态[16-17]。MMP-9 由多种细胞分泌而来,如中性粒、巨噬、纤维等细胞,在胃溃疡、胃炎、溃疡等疾病中广泛存在,不管是溃疡的形成及修复均有它的作用[18],当其在机体组织中过度表达时可降低复合物的完整性,进而导致胃黏膜结构受到损伤[19]。TIMP-1由内皮、单核巨噬细胞分泌而来,为基质金属蛋白酶活性抑制剂,当机体受到感染侵袭时,其水平无法与MMP-9 水平相当,损伤正常胃黏膜屏障,进而诱导胃溃疡的发生,引起持续性病理改变[20-21]。本研究表明,观察组的MMP-9、TIMP-1水平明显高于对照组,表明Hp感染性胃溃疡患者的活动度明显升高,且显著高于非Hp感染性胃溃疡患者,进一步说明胃溃疡患者感染后会诱导炎性活动度改变,且Hp感染患者的炎性活动度较高。本研究证实,Hp感染越严重,胃溃疡患者的血清炎症因子TNF-α、IL-8、MMP-9、TIMP水平则越高,因此可通过监测上述指标水平利于病情精准把握。通过观察Hp感染性胃溃疡患者的炎症因子、MMP-9、TIMP-1水平及炎性活动度发现,TNF-α、IL-8、MMP-9、TIMP-1水平分别与炎性活动性呈正相关。
综上所述,Hp 感染性胃溃疡患者的炎症因子、MMP-9、TIMP-1水平明显升高,且与炎性活动度密切相关,通过监测四者水平有利于把握患者炎性活动度,具有较高的临床运用价值。

