北五味子在胸主动脉瘤发生发展中作用机制的网络药理学和分子对接技术分析
李 妍, 侯月, 牟星蔚, 刘冰清, 万 红, 刘 畅, 夏 薇
(北华大学医学技术学院实验中心,吉林 吉林 132000)
胸主动脉瘤(thoracic aortic aneurysm,TAA)被定义为胸主动脉局部扩张且直径大于其正常值的1.5 倍,是临床上一种十分凶险的心血管疾病[1]。目前主要通过血管置换术进行治疗,其死亡率高且预后不良。TAA 的临床诊断主要通过影像学技术,TAA 药物治疗手段并不十分明确。北五味子(Schisandrae Chinensis Fructus,SCF)为木兰科植物五味子的干燥成熟果实,性味酸甘温,主要成分包括木脂素类、挥发油类和多糖类等,具有补气生液和益肾安神的功效[2]。SCF 在心血管疾病中的保护作用[3]逐渐被研究者认识。JANG 等[4]研究表明: SCF 具有抑制基质金属蛋白酶(matrix metalloproteinase,MMPs)生成、血管平滑肌细胞(vascular smooth muscle cell,VSMC)增殖与迁移的功能,如SCF 的有效成分木质素可通过抑制衔接蛋白1 相关信号通路来抑制VSMC 增殖;从SCF中提取的精油能够选择性抑制MMP9,从而逆向调 控 核 转 录 因 子-κB (nuclear transcription factorκB,NF-κB)信号通路介导的VSMC 迁移[5]。且在TAA 病理条件下,VSMC 表现出以异常增殖、迁移、细胞外基质降解和收缩力丧失为特征的表型变化[6-8]。然 而SCF 对TAA 的 具 体 作 用 机 制 尚 不 明确。网络药理学是基于系统生物学理论,对生物系统进行的网络分析,选取特定信号节点进行多靶点药物分子设计的新学科,强调对信号通路的多途径调解,提高药物的临床治疗效果,降低毒副作用,从而提高新药临床试验成功率,节省药物的研发费用[9]。通过网络药理学已预测出苦参[10]、雷公藤[11]和麦冬[12]等中药材抗心血管疾病的分子靶点与作用机制。本研究旨在通过网络药理学研究和分子对接技术,结合GEO 数据库基因表达谱实验验证,探索SCF 对TAA 发生发展的作用机制及分子靶点,为TAA 的药物选取提供依据。
1 材料与方法
1.1 SCF 有效成分筛选在TCMSP 数据库(https://tcmsp-e. com/)以口服生物利用度(oral bioavailability,OB)≥30%和类药性(drug-likeness,DL)≥0.18%为筛选条件获取SCF 的有效成分及其对应靶点, 运用UniPort 数据库(https://www.uniprot.org/)将靶蛋白转换成基因名称。
1.2SCF 靶 点 获 取在 PubChem 数 据 库(http://pubchen.ncbi.nlm.nih.gov/)检索SCF 有效 成 分 对 应 的 2D 结 构 式, 导 入 Swiss TargetPrediction 在 线 分 析 网 站(http://www.swisstargetprediction. ch/) 进行靶点富集预测;在CTD 数据库(https://ctdbase. org/) 筛选与SCF有效成分相作用的靶点,并在Uniprot 数据库(https://www.uniprot.org)搜索靶点基因名,去重整合得到SCF 的潜在靶点。
1.3 TAA 疾病靶点获取在GeneCards、OMIM和OpenTargets 数据库中输入关键词“thoracic aortic aneurysm”进行检索,去重整合得到TAA 相关疾病靶基因。在Omicshare 云平台(https://omicshare.com)输入SCF 有效成分靶点和TAA 疾病靶点绘制韦恩图取交集,得到SCF 影响TAA 的潜在靶点。
1.4 SCF 潜在作用靶点互作网络构建和分析将SCF 影响TAA 的潜在作用靶点导入String 数据库(https://string-db. org), 选 择 物 种 为“Homo sapiens”,其余参数选择默认值,获得预测靶点的相互作用网络。使用Cytoscape 3.7.2 软件绘制蛋白-蛋白相互作用(protein-protein interaction,PPI)网络。
1.5 潜在靶点的基因本体(Gene Ontology,GO)功能富集和京都基因组与基因百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析将SCF 对TAA 作用潜在靶基因上传至DAVID 数据库(https://david.ncifcrf.gov/),获得GO 功能富集及KEGG 信号通路富集分析结果,并利用生物信息分析学习平台——OmicShare 云平台对分析结果进行可视化处理,研究靶点参与的生物学过程(biological process,BP)、细胞组分(cellular component,CC)、分子功能(molecular function,MF)和信号通路,明确SCF 影响TAA的主要药理机制。
1.6 核心靶点的获取使用Cytoscape 3.7.2 软件的cytoHubba 插件,对SCF 影响TAA 潜在靶点的PPI 网络进行拓扑分析,选取综合排名前10 位的靶点作为SCF 对TAA 作用的核心靶点。
1.7 五味子酯乙[Schisandra chinensis(turcz.)baill,SchB]刺 激 大 鼠VSMC 的测序分析检 索GEO 数据库,选取GSE87439 数据集,获得SCF主要活性成分 SchB 对转化生长因子 β1(transforming growth factor,TGF-β1)处理的A7r5大鼠主动脉平滑肌细胞基因表达谱影响结果。使用GEO2R 在线分析不同处理组基因表达差异情况。
1.8 分子对接与可视化从PDB 数据库(https://www. rcsb. org/) 获取靶蛋白pdb 文件,TCMSP 数 据 库(https://tcmsp-e. com/) 获 取SCF 有效成分的mol2 文件,在autodock 软件中对目标文件进行去水和加氢等操作,储存为pdbqt 文件并进行分子对接。对接结果运用PyMOL 软件进行可视化处理。
1.9 统计学分析使用Graphpad Prism 7.0 统计软件进行统计学分析。各组细胞样本中基因表达水平均符合正态分布,采用t检验分析不同处理组间基因表达差异。以P<0.05 为差异有统计学意义。
2 结果
2.1 SCF 有效成分与靶点筛选TCMSC 数据库得到SCF 有效成分共130 个,经筛选得到符合条件的有效活性成分8 个(表1)。 Swiss Target Prediction 和CTD 数据库预测有效成分及其对应靶点,使用Uniprot 数据库将作用靶点转为基因名称,删除无效与重复靶基因,共得到SCF 有效成分作用靶点共332 个(图1)。

图1 SCF 主要成分与靶点网络Fig.1 Main components and target network of SCF
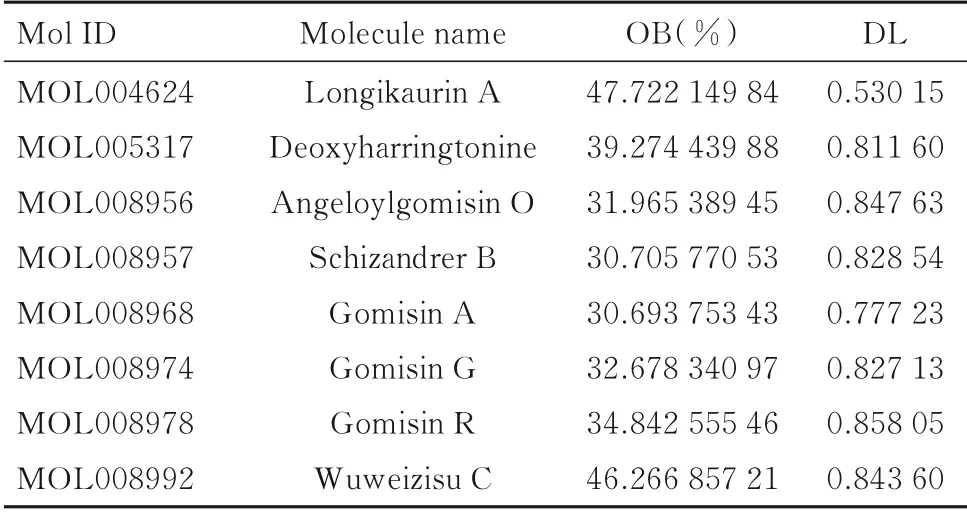
表1 SCF 有效成分Tab.1 Main active ingredients of SCF
2.2 TAA 疾病相关基因获取整理GeneCards、OpenTargets 和OMIM 数据库得到的TAA 疾病靶基因,将3 个数据库搜索到的结果整理合并后删除重复项,共得到TAA 疾病相关靶基因共676 个。将SCF 有效成分靶基因与TAA 疾病相关靶基因导入Omicshare 云平台绘制韦恩图,得到SCF 作用于TAA 潜在靶点46 个(图2)。
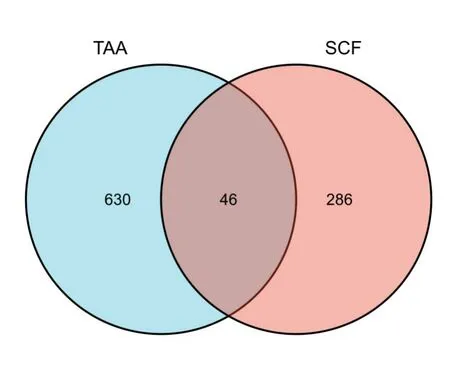
图2 SCF 靶点与TAA 靶点的韦恩图Fig.2 Venn diagram of SCF targets and TAA
2.3 SCF 潜在作用靶点蛋白-蛋白互作(proteinprotein interaction,PPI)网络构建在String 数据库获取SCF 对TAA 潜在作用靶点的互作信息,导入Cytoscape 3.7.2 软件中对蛋白相互作用信息进行可视化,得到PPI(图3)。PPI 网络包含46 个节点,代表分子靶点,节点的颜色深浅代表连接度的大小;361 条边,代表分子间相互作关系,节点间连线颜色深浅代表连接紧密度。PPI 网络展示了SCF 对TAA 多靶点和多核心的作用机制。
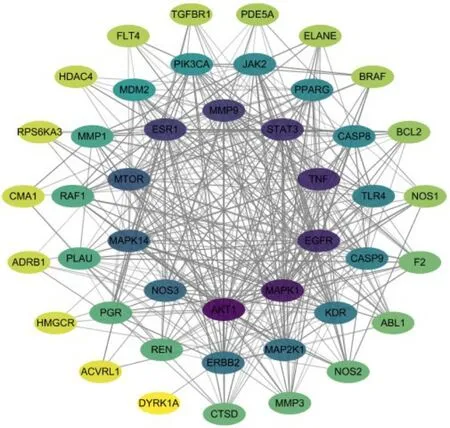
图3 靶点蛋白PPI 网络Fig.3 PPI network of target protein
2.4 SCF 作用于TAA 潜在靶点GO 和KEGG 分析运用OmicShare 云平台对SCF 作用于TAA 潜在靶点进行GO 和KEGG 富集分析及可视化,其中BP 主要涉及细胞蛋白质代谢过程的正调控、蛋白质代谢过程的正调控和催化活性的正调节等;CC 主要涉及细胞膜、细胞器和细胞连接等;MF 主要涉及蛋白质催化活性、分子结合活性和抗氧化活性等(图4)。GO富集分析结果显示:SCF作用于TAA 潜在靶点主要参与细胞增殖、氧化物代谢正向调控和蛋白质修饰正向调控等。见图5。KEGG 富集分析结果显示:46 个潜在靶点主要在194 条通路上富集,涉及血管平滑肌细胞收缩、血管内皮细胞迁移、调控动脉粥样硬化的发生和细胞增殖与凋亡等生物学过程。图6 展示了KEGG 富集分析前20 位信号通路分析结果:其中血管内皮生长因子(vascular endothelial growth factor,VEGF)信号通路、受体酪氨酸激酶(receptor tyrosineprotein kinase,ErbB)信号通路和低氧诱导因子1(hypoxia-inducible factor 1,HIF-1) 信 号 通 路 与SCF 对TAA 的影响关系较为密切(图7~9)。

图4 潜在靶点的GO 功能分析Fig.4 GO function analysis of potential targets

图5 GO 富集分析中潜在靶点分布Fig.5 Distribution of potential targets in GO enrichment analysis

图6 潜在靶点KEGG 富集分析Fig.6 KEGG enrichment analysis of potential targets
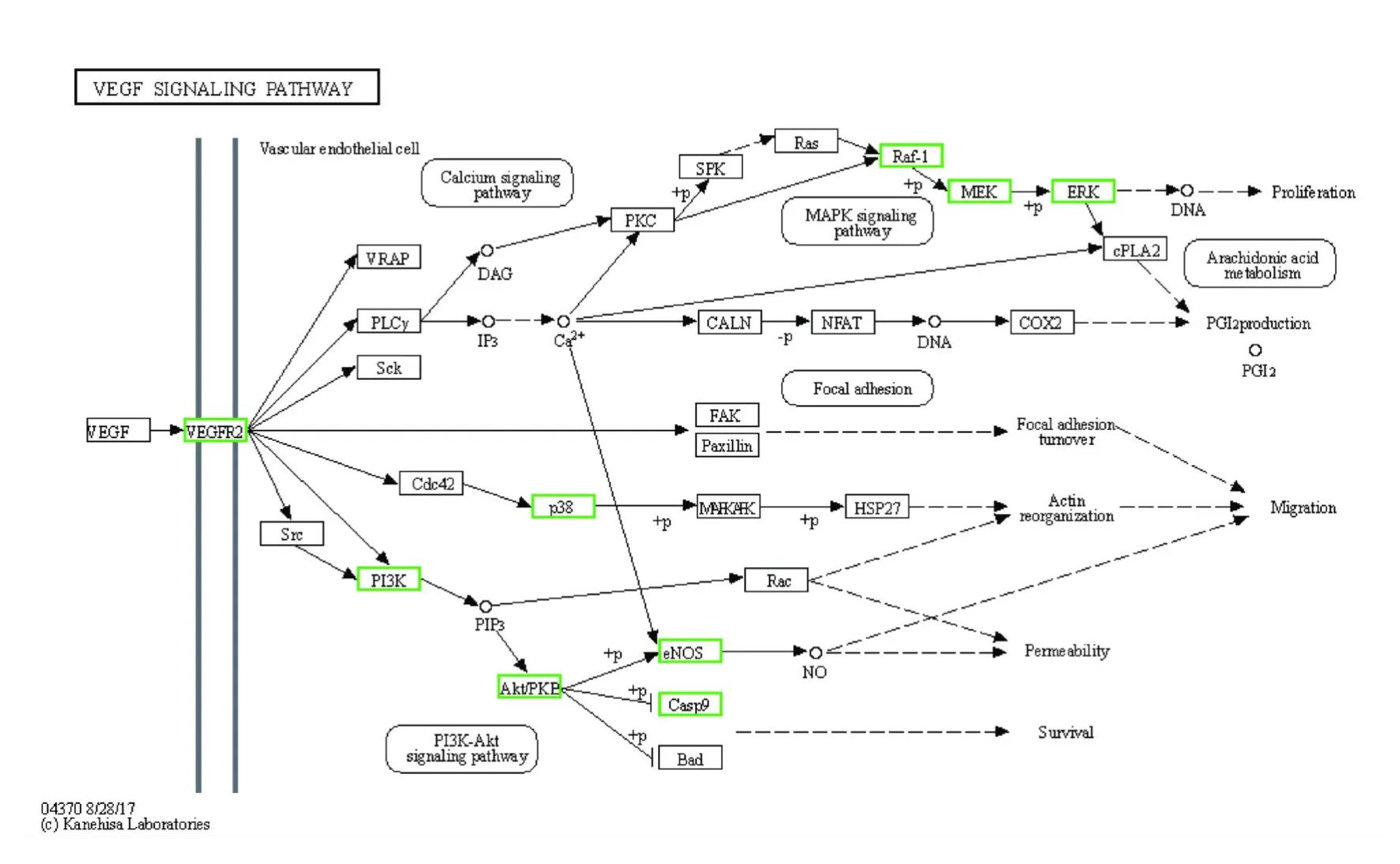
图7 关键靶点在VEGF 信号通路的分布Fig.7 Distribution of key targets in VEGF signaling pathway
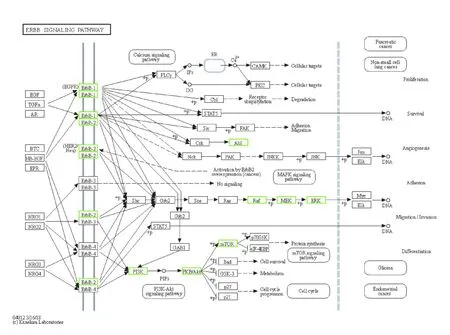
图8 关键靶点在ErbB 信号通路的分布Fig.8 Distribution of key targets in ErbB signaling pathway
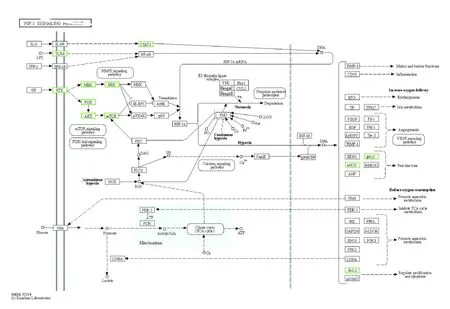
图9 关键靶点在HIF-1 信号通路的分布Fig.9 Distribution of key targets in HIF-1 signaling pathway
2.5 SCF 作用于TAA 核心靶点的筛选对PPI 网络进行拓扑分析,筛选其中综合排名前10 位的靶点作为SCF 影响TAA 核心靶点(图10)。表皮生长因子受体(epithelial growth factor receptor,EGFR)已被证实经由MAPK 信号通路参与血管平滑肌细胞增殖与迁移,抑制EGFR 是对抗高血压和动脉粥样硬化等心血管疾病的候选疗法[13-14]。在血管中,蛋白激酶B(protein kinase B,Akt)对血管紧张性和炎症反应调节有重要作用[15-16],其中Akt1 在体外促进VSMC 的增殖和迁移[17]。主动脉夹层患者急性期伴有全身炎症反应,肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)等促炎介质在血浆和组织中浓度与主动脉受累程度明显相关[18]。MMP9 已被证实能够导致心血管疾病组织炎症进展活跃,可作为评估血管稳态的亚临床标志物[19-20]。此外,信号转导与转录激活因子(signal transducer and activator of transcription 3,STAT3)在血管内皮屏障完整性[21]、巨噬细胞介导的血管炎症反应[22]和VSMC 增殖的正向调控中发挥重要作用[23]。因此SCF 可能通过靶向以上分子靶点发挥作用抑制TAA 的发生。
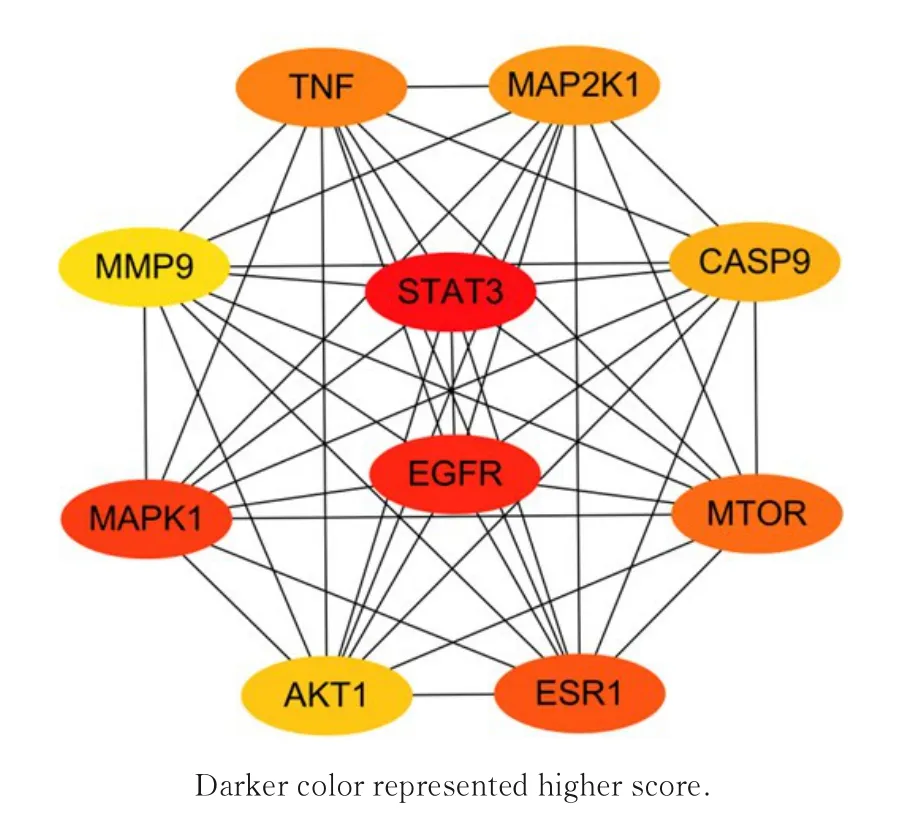
图10 PPI 网络中的核心靶点Fig.10 Key targets in PPI network
2.6 SchB 刺激大鼠VSMC 的测序分析从GEO数据库下载GSE87439 芯片与平台数据,其采用SchB 刺激肿瘤生长因子β1(tumor growth factor-β1,TGF-β1)诱导的大鼠主动脉平滑肌细胞,随后进行微阵列实验,利用SCAN 法进行归一化处理[24-25]。按P<0.05,差 异 倍 数(logFC) >2 筛选,共得到4159 个差异基因(DEGs),在其中检索PPI 网络中关键靶点的基因表达情况,结果显示:与TGF-β1 组比较,SchB-TGF-β1组STAT3和MMP9 表达下调且差异有统计学意义(P=0.0004 和P=0.0152)(图11)。表明SchB 可能通过靶向STAT3 信号通路抑制MMP9 表达,从而缓解TAA。
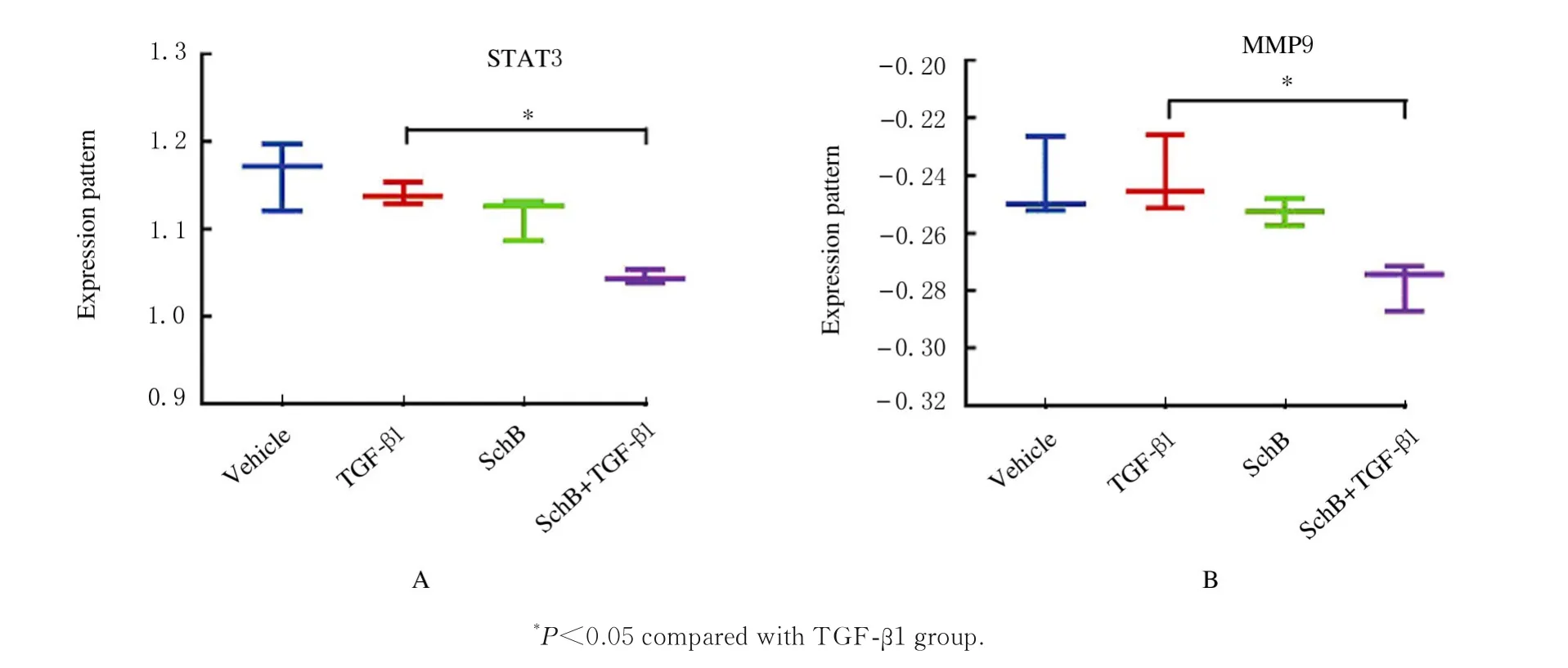
图11 SchB 刺激大鼠VSMC 结果Fig.11 Results of rat VSMC stimulated by SchB
2.7 分子对接综合PPI 网络拓扑分析、GO 和KEGG 富集分析及GEO 数据库芯片数据结果,将STAT3 和MMP9 选定为SCF 作用于TAA 的重点核心靶点,SCF 主要有效成分SchE 选定为配体小分子,将重点核心靶点作为受体蛋白与配体小分子进行分子对接(表2)。选取对接结合能最低的组合利用pyMol 软件进行可视化处理(图12)。一般认为对接结合能小于-5 kJ·mol-1的分子可以在自然状态下对接,且对接结果良好[26]。SCF 主要有效成分与重点核心靶点对接结合能均远小于-5 kJ·mol-1,且对接效果较好,进一步验证了SCF 可以靶向STAT3 和MMP9 抑制TAA 的发生发展。
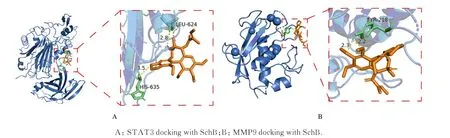
图12 SchB 与重点核心靶点分子对接模型Fig.12 Molecular docking models of SchB and key core targets

表2 分子对接结果Tab.2 Molecular docking results
3 讨论
TAA 是一类以胸主动脉壁进行性扩张为特征的心血管疾病,但其继发的胸主动脉夹层与主动脉破裂是患者死亡的主要原因。现有药物治疗只能将发病后死亡率维持在50%左右[27],因此开发新药对于TAA 预防与治疗显得尤为重要。本研究采用多学科交叉的方法,整合多个生物信息学数据库,共收集到龙胆碱A (longikaurin A)、脱氧三色堇(deoxyharringtonine)和当归甙O(angeloylgomisin O)等8 个SCF 有效成分,其中SchB 已被证明能够抑制血管平滑肌细胞NF-κB 信号通路的活化[24]。
整理得到46 个SCF 作用于TAA 的潜在生物靶点,涉及VSMC 收缩、血管内皮细胞迁移、调控动脉粥样硬化的发生和细胞增殖与凋亡等生物学过程,其中VEGF、ErbB 和HIF-13 条信号通路与SCF 作用于TAA 关系最为密切。VEGF 是血管生成的关键因子,TGF-β1 刺激VSMC 形成Smad3/HIF-1α 复合物,进而激活VEGF-A 启动和转录,抑 制 VSMC 凋 亡[28]。 此 外, VEGF-A 通 过VEGFR2/STAT3 介导上调细胞周期蛋白D1(Cyclin D1) 和增殖细胞核抗原(proliferating cell nuclear antigen,PCNA) 等标志物的增殖来促进VSMC 增殖[29-30]。在腹主动脉瘤小鼠动物模型中,槲皮素可以降低HIF-1α/VEGF 信号通路的活化,抑制血管新生[31]。神经调节蛋白(neuregulin,NRG) 是多种心血管疾病的保护性和修复性生长因子[32]。在神经调节蛋白-1(neuregulin-1,NRG-1)的调控下,ErbB 参与调节血管重构、VSMC 凋亡和心脏发育等过程[33]。
拓扑网络分析得到10 个核心靶点,通过网络关系图的构建可以了解基因间的互作方式与上下游调控关系,充分展示SCF 作用于TAA 多成分、多靶点和多通路的作用特点,相比于西药单基因-单靶点,优势更加明显。TGF-β1 参与了一系列血管纤维化疾病的发病机制,如主动脉术后再狭窄、胸主动脉粥样硬化和高血压[34-35]。在上述病理状态下,TGF-β1 作用于VSMC,诱导合成表型,包括细胞迁移和增殖[36-37]。因此本研究选取TGF-β1 刺激下的VSMC 进行药效观察。已有研究[38-39]表明:SchB 有效地抑制VSMC 中诱导的Smad 活化和肌球蛋白轻链(myosin light chain,MLC) 磷酸化。上述结果表明SchB 具有潜在的抑制TAA 发生发展作用。
GSE87439 测序结果显示:SchB 下调大鼠主动脉平滑肌细STAT3 和MMP9 基因表达水平且差异有统计学意义。STAT3 是平滑肌细胞增殖反应和新生内膜形成的关键分子,外源性药物下调JAK/STAT3 通 路 可 有 效 抑 制VSMC 增 殖[40-41]。MMPs 家族已被广泛认为是TAA 的重要促进因子,具有水解细胞外基质和促进炎症反应等作用[42-43]。分子对接结果显示:SCF 主要有效成分与重点核心靶点对接结果良好,提示筛选得到的药物有效成分与核心靶点之间有较强的结合能力,进一步证明网络药理学预测药物有效成分与疾病靶点的研究成果。
本研究首次通过网络药理学探究SCF 作用于TAA 的分子机制,利用基因表达谱数据分析与分子对接验证了SCF 的有效成分—SchB 可能是通过作用于STAT3 等信号通路,抑制平滑肌中MMP9表达水平发挥抑制TAA 发生发展的作用,为后续进一步实验研究奠定基础,所得结果也与现有文献报道基本符合。同时本研究尚存在一些缺陷:①本研究只分析了SCF 主要有效成分,使得研究成果有一定的局限性;②研究结果只是理论上预测,药物在体内的作用机制仍需动物实验进一步验证。

