神经内镜下经鼻蝶入路切除无功能性垂体腺瘤临床疗效分析
孙凯颉,李英斌,李清泉,褚冬,张光敏
无功能性垂体腺瘤(non-function pituitary adenomas,NFPAs)是由腺垂体引起的最常见的垂体腺瘤亚型,占全部垂体腺瘤的14%~55%[1-2],占外科手术治疗的垂体腺瘤的30%~40%[3],特征是缺乏激素分泌过多的临床证据。NFPAs的微腺瘤(<1 cm)通常无临床症状,NFPAs发现时常见为大腺瘤(≥1 cm)或巨大腺瘤(≥3 cm),常因肿瘤对周围结构的影响而出现体征和症状,引起头痛、视力视野障碍或垂体功能低下[4]。根据世界卫生组织《内分泌肿瘤分类》第4版(WHO 2017)[4],NFPAs可分为八种亚型:沉默性腺炎,皮质激素,体细胞生长激素,甲状腺营养素,乳腺营养素,多发性激素Pit-1,空细胞和双重/三倍的NFPAs。NFPAs的治疗策略根据患者年龄、垂体功能和患者选择进行个性化设定,但考虑到终身肿瘤生长的可能性更高,NFPAs应首选手术治疗[5]。本研究回顾性分析2015年1月—2019年12月南京医科大学第二附属医院神经外科采用神经内镜经鼻蝶切除NFPAs的45例患者,探讨NFPAs接受手术治疗后的临床疗效。现报告如下。
1 资料与方法
1.1 一般资料 共纳入45例,其中男15例,女30例;年龄16~79岁,平均年龄(53.3±14.4)岁;绝经后女性15例,无孕期女性;其中42例为首次诊断发现垂体腺瘤患者,3例为术后复发垂体腺瘤,临床表现为头痛20例,主要以眉心或双颞侧疼痛为主,视觉障碍24例,术前平均视觉损害评分VIS(44.88±26.75)分;内分泌检查泌乳素(prolactin,PRL)轻度升高5例(<100 ng/mL),促甲状腺激素(thyroid stimulating hormone,TSH)升高2例,生长激素(growth hormone,GH)轻度升高1例,促黄体生成素(Luteinizing hormone,LH)升高1例,三碘甲状腺原氨酸(triiodothyronine,T3)降低2例,甲状腺素(thyroxine,T4)降低2例。
1.2 术前内分泌检查 所有患者术前均行内分泌检查,包括GH、PRL、血尿皮质醇、甲状腺功能7项、性激素5项、促肾上腺激素及胰岛素样生长因子,排除功能性垂体腺瘤。约25%~65%的NFPAs患者因垂体柄受压而引起轻度高泌乳素血症[6],Hong等[7]发现NFPAs常见的PRL水平<100 ng/mL,PRL垂体腺瘤>250 ng/mL,因此PRL升高但<100 ng/mL的仍纳入NFPAs研究。
1.3 术前视觉功能评估 所有患者均在术前采用对数视力表检测视力,全自动视野仪检测视野,并排除原发性眼部疾病。计算术前视觉损害评分(visual impairment score,VIS)与术后VIS进行比较。
1.4 影像学评估 所有患者术前均行1.5 T或3.0 T垂体核磁共振平扫及增强,了解垂体大小及周边侵袭情况。根据垂体冠状位T1增强进行Knosp分级[8],0级18例,1级16例,2级4例,3级3例,4级4例。行蝶鞍区CT薄层扫描及三维成像(3D-CT)根据蝶窦气化类型进行蝶窦分型[9],全鞍型21例,半鞍型13例,鞍枕型6例,鞍前型5例。
1.5 手术方式 所有患者术前3 d左氧氟沙星滴鼻液滴鼻,术前2 h剪除鼻毛,行常规气管内插管全身麻醉。双侧鼻腔内以肾上腺素棉片填塞7 min收缩鼻腔黏膜,取出棉片后填入碘伏棉片清洁鼻腔。采用0°和30° STORZ神经内镜系统,以及配套影像显示、采集系统,双极电凝、高速气钻(Medtronic)、内镜专用手术器械。术中患者取仰卧位,头部略后仰10°~15°,先从右侧鼻孔进入,将中鼻甲推向外侧,确认蝶窦开口后,从蝶窦开口向蝶窦前壁和鼻中隔的筛骨垂直板上做弧形切口;将鼻黏膜成瓣后翻向后鼻孔,充分暴露蝶窦前壁及鼻中隔,使用金刚磨砂钻磨除蝶窦前壁骨质,暴露蝶窦后清除蝶窦内壁黏膜;打开鞍底骨质暴露鞍底硬膜,确认术区无活动出血后,电凝鞍底硬膜并十字切开,暴露肿瘤;使用取瘤钳镊取肿瘤组织留做病理检查,然后使用环形刮匙及吸引器切除肿瘤,更换30°神经内镜切除鞍上及海绵窦内肿瘤。切除肿瘤后无术中脑脊液漏,则鞍内使用流体明胶填塞,并使用人工硬脑膜、生物胶修复鞍底。本组病例中有3例出现术中脑脊液漏,术中取自体脂肪、人工硬脑膜及自体鼻黏膜行鞍底重建,使用油纱条填塞双侧鼻腔,术后3~5 d拔除纱条。所有切除标本送病理科。
1.6 术后评估 术后立即复查血常规、血生化、凝血常规、尿常规,行24 h动态尿量监测;术后24 h行头颅CT了解颅内有无出血;术后48~72 h复查垂体核磁共振评估手术切除效果,行内分泌学检查评估激素水平及视觉功能评估术后视觉功能改善情况;随访患者临床症状改善情况,定期复查垂体核磁共振评估肿瘤复发率,术后3个月随访视觉功能。
2 结 果
2.1 手术疗效 肿瘤全部切除43例(95.6%),次全切除1例(2.2%),部分切除1例(2.2%),平均术中出血(102.67±53.49)mL,平均手术时间(85.64±34.66)min,平均住院时间(9.0±5.3)d。术后内分泌复查:PRL恢复正常4例,无明显变化1例,TSH恢复正常2例,GH恢复正常 1例,LH无明显变化1例,T3无明显变化2例,T4无明显变化2例;术后新增TSH水平降低6例,术后新增PRL水平降低4例。术后出现1例肾上腺功能减退(2.2%),为血清皮质醇(cortisol,COR)及促肾上腺皮质激素(adrenocorticotropin,ACTH)均低于正常范围下限,其余激素水平正常,行氢化可的松30 mg/d替代治疗,随访3个月复查血清COR及ATCH水平恢复至正常范围后停药,且无肾上腺功能减退的不适症状;暂时性尿崩症3例(6.7%),经补液及口服醋酸去氨加压素0.1 mg/次,2~3 d恢复,无永久性尿崩症出现;脑脊液鼻漏1例(2.2%),为双侧鼻孔持续低流量流出清亮液体,行抗生素抗感染并保守治疗2周后,对患者进行腰大池引流,控制脑脊液引流速度200~300 mL/d,持续至患者脑脊液鼻漏停止,两次脑脊液检查正常后进行拔管。
2.2 随访 45例术后平均随访时间(22.2±11.9)个月。随访期间1例(2.2%)复发,为次全切除患者。1例部分切除患者于外院行放射性治疗后未复发。头痛症状术后缓解18例,缓解率90%;视觉障碍24例术后平均视觉损害评分VIS(21.13±21.77)分,术前VIS与术后VIS差异有统计学意义(P=0.002,P<0.05),无术后视觉障碍恶化病例。
2.3 典型病例 患者,女,63岁,头痛1个月,3.0 T核磁平扫及增强提示垂体腺瘤,大小约1.6 cm×1.7 cm×1.2 cm。术前视力视野检查正常,内分泌检查正常,诊断为NFPAs。完善相关检查,排除手术禁忌,在神经内镜下行经鼻-蝶垂体腺瘤切除。术后2周复查垂体3.0 T核磁平扫及增强,影像学肿瘤全部切除,术后病理提示NFPAs,术后无并发症发生,随访3年肿瘤未复发。
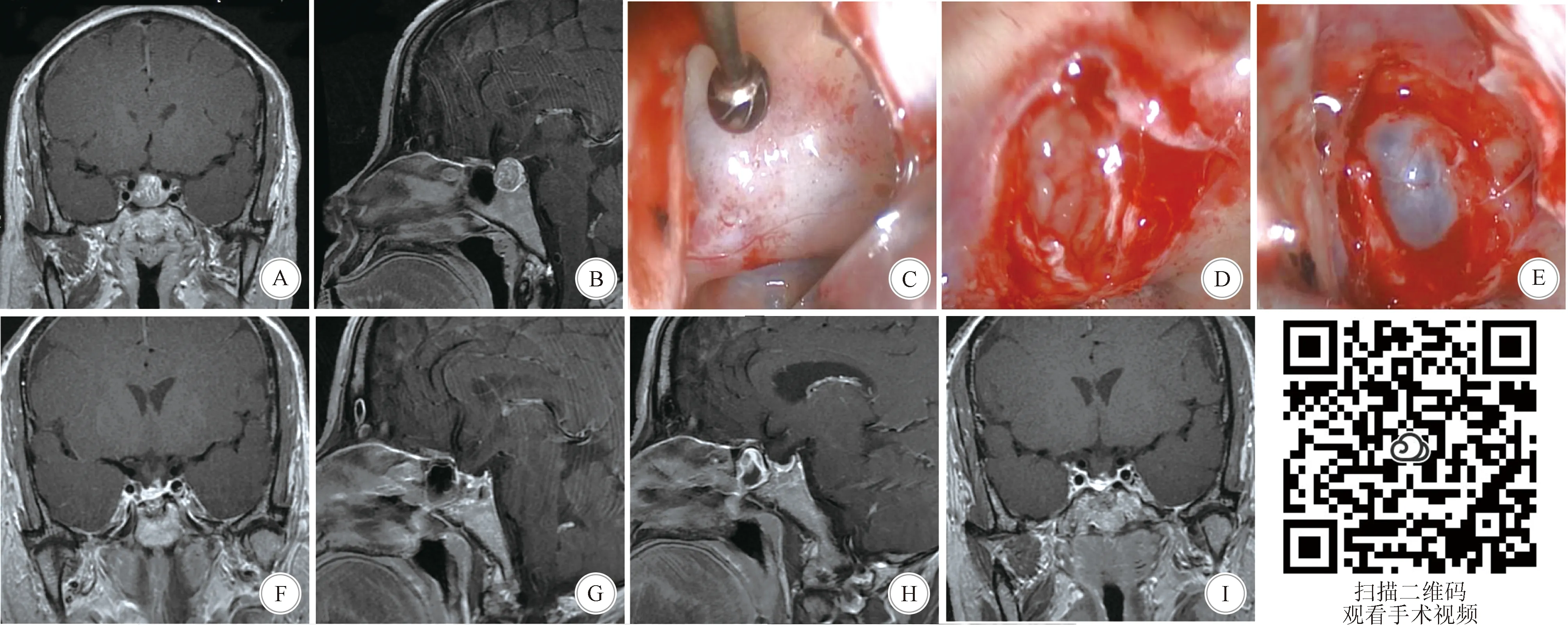
A、B:患者术前垂体3.0 T MRI(冠、矢状位片)提示垂体腺瘤,考虑垂体大腺瘤; C:术中蝶窦打开后见鞍底; D:术中硬膜打开中后见灰红色肿瘤组织; E:术中肿瘤切除后显露鞍隔; F、G:患者术后复查垂体3.0 T MRI(冠、矢状位片)可见肿瘤影像学全切; H、I:术后第三年患者复查垂体3.0 T MRI(冠、矢状位片)提示肿瘤未复发
3 讨 论
NFPAs治疗方式主要有手术治疗、药物治疗和放射治疗[10]。Hardy在1969年首次通过口鼻蝶入路行显微镜下垂体腺瘤切除术,后发展为经典的垂体腺瘤术式。但是显微镜下手术视野限制容易造成肿瘤残余,成为术后临床效果改善不明显及后期肿瘤复发的危险因素。Jankowski于1992年首次使用神经内镜经鼻蝶入路切除垂体腺瘤,神经内镜拥有相对较大的操作空间,深部光源照明,多角度直视下操作等优势[11-12]。与显微镜手术比较,神经内镜手术拥有更高的肿瘤全切除率及更低的并发症发生率。MameLak等[13]研究指出了传统双人四手内镜操作与气动固定支架手术无疗效差异,但是较显微镜操作手术疗效优势大。近年来,由于神经内镜手术创伤小、并发症少、术后恢复快等优点,在国内众多神经外科中心受到推广。本研究就内镜下经鼻蝶NFPAs切除的手术疗效展开讨论。
所有患者均顺利完成神经内镜手术,肿瘤的全切率达到95.6%,高于73%的神经内镜总体肿瘤全切率,对比已有的显微镜下全切率60%存在较大优势[14],且随访至今复发率2.2%,优于显微镜手术[15]。本研究认为本组患者肿瘤切除率高于平均水平的原因有下:(1)术区的彻底暴露,本研究中的3例复发性垂体腺瘤,2例在术中发现前次手术暴露不充分,主要为蝶窦前壁及鞍底骨质暴露不彻底,原则上鞍底骨质需要充分磨除,即鞍底两侧暴露达海绵窦内侧,前上达前海绵间窦,后下达后海绵间窦,实现“blue to blue”[16],暴露不彻底导致存在视野盲区及操作空间狭小等缺点。术中在未扩大鞍底骨质情况下,即使更换30°镜仍存在视野盲区,且内镜器械无法到达鞍膈海绵窦夹角等位置,通过扩大鞍底骨质后,完成肿瘤全切,充分暴露有利于术中操作及内镜下观察,利于肿瘤全切;(2)Knosp分级Ⅲ、Ⅳ级的高度侵袭垂体腺瘤,极大地阻碍了手术入路与切除。Knosp分级Ⅲ级的垂体腺瘤,根据肿瘤的位置及对海绵窦的侵袭程度,术前进行完善的准备,通常采用标准的内镜下入路可实现肿瘤的完全切除。在Knosp分级Ⅳ级的垂体腺瘤中,肿瘤外侧侵袭生长,包绕海绵窦内颈内动脉,以及视野盲区出现,增加了手术过程中对神经、重要血管及组织损伤的几率,同时易残余肿瘤。本组Knosp分级Ⅳ级的患者,均在术前行三维计算机断层扫描(3D-CT)术前造模[17],可以在术前为术者提供可靠的解剖学指导。阳吉虎等[18]认为根据肿瘤的体积大小及侵袭位置不同选择不同的手术入路,可以最大限度地暴露肿瘤。本研究中,术者通过选择不同角度的神经内镜镜头,亦可扩大术区视野,采用不同曲度的吸引器、取瘤钳及刮匙,在标准鼻碟入路下也可达到较好的切除效果;(3)本组患者术前均行蝶鞍区CT薄层扫描,可以直观了解蝶窦解剖结构及其与周围结构相邻的关系,施术者在术前对于蝶窦和后组筛窦气化的情况、蝶窦内分隔的位置、鞍底的形态、视神经管和海绵窦内颈内动脉的位置及空间关系有充分了解,这大大提高了术中的安全性、有效性及肿瘤切除率[19]。
NFPAs的临床症状主要与肿瘤直接压迫有关,头痛常出现于NFPAs早期,其主要原因系肿瘤直接刺激或鞍内压力增高引起垂体硬膜囊及鞍膈受压所致。当垂体腺瘤生长到突破鞍膈后,鞍内压常降低,头痛可减轻或者消失。晚期垂体腺瘤继续生长侵袭颅底硬膜血管,压迫三叉神经,或者突入第三脑室引起脑积水时,头痛可再次加重。本组18例患者术后头痛不同程度缓解,缓解率达90%,显微镜与内镜均可在垂体腺瘤切除后达到鞍内减压效果,两者不存在明显差异。视力减退及视野缺损是垂体腺瘤的另一常见表现[20],是垂体腺瘤压迫视交叉所致,典型表现为双眼颞侧偏盲。术后视觉功能改善率在已发表的研究中有所不同,但平均缓解率约80%[21];本研究18例获得术后视觉障碍改善,改善率75%,略低于平均值,但对比术前术后VIS,手术治疗效果确切。对于大多数患者来说,有效地切除垂体腺瘤可以改善视力视野情况,神经内镜相较显微镜对于视交叉直视更为清楚。Muskens等[21]表明视觉症状的改善与肿瘤全切率无关,术前视觉症状的持续时间和严重程度与术后改善情况关系更为密切,手术前症状持续时间较长(≥1年)的患者在切除后的视力结果明显较差。神经内镜可以在较深的视野,近距离地观察病变,为深部提供良好的观察质量,将神经外科医师的“眼睛”带到手术区域,有利于精细手术。近年的研究发现,内镜术后患者的临床症状与内分泌改善效果普遍优于显微镜。
术后的尿崩症与垂体功能低下、垂体柄及垂体组织受损有关,神经外科医师在术中对于肿瘤组织与正常垂体组织的辨认极为重要,因尽可能减少对于正常垂体组织及垂体柄的干扰[22]。神经内镜的操作特性,术者可以在术中清楚辨认正常垂体与肿瘤,严格坚持瘤内操作,可以最大限度地降低对垂体柄的干扰,减少术后并发症的风险。垂体术后24~48 h内有18%~31%的患者发生尿崩症[23],本研究中3例(6.7%)患者术后出现暂时性尿崩症,治疗策略为醋酸去氨加压素0.1 mg/次。术后有1.4%~19.8%患者可能出现垂体功能减退[22],本研究中出现术后肾上腺功能不全1例(2.2%),治疗策略为氢化可的松替代治疗,并在术后定期随访评估肾上腺功能,自身激素水平恢复正常后停止替代治疗。垂体术后脑脊液漏发生率为0.5%~14%[24],术后出现脑脊液鼻漏1例(2.2%),垂体术后脑脊液漏发生多考虑与术中操作有关,术中的熟练操作可有效降低并发症发生。熟悉鞍区的解剖,熟练使用内镜下手术器械,减少对于鞍内血管、神经及垂体柄等的牵拉,轻柔操作可有效降低鞍膈内蛛网膜破裂概率。对于术中发现脑脊液漏的患者,完善的鞍底重建可以有效地降低术后相应并发症发生率[25]。研究表明显微镜下手术并发症发生的危险度为内镜下手术的1.9倍[26]。
综上所述,神经内镜凭借其优秀的操作空间,深部的光源照射以及多角度地直视操作等优势,相比于显微镜手术,保留骨性鼻中隔的内镜手术拥有更小的创伤,术中更清晰的解剖位置及对于正常组织的保护减少了手术并发症,更高的肿瘤全切率使得术后临床症状缓解明显。证明了神经内镜下经鼻碟切除NFPAs手术相较于显微镜具有更好的安全性及有效性。
利益冲突:所有作者均声明不存在利益冲突。

