不同泵控速度对维持性血液透析动静脉内瘘患者透析相关指标及心功能的影响
莫梅山,沈 敏,吴玉珍
1 青海省第五人民医院肾内科,青海 西宁 810000
2 青海省第五人民医院普外科,青海 西宁 810000
肾病会引发诸多并发症,与高血压、糖尿病等慢性疾病和终末期肾病关联尤其紧密[1]。终末期肾病并发高血压、糖尿病时均可能因肾功能长期受损,不能维持正常生理功能活动,进而引起全身脏器功能紊乱导致一系列临床症状。根据全国横断面流行病学调查结果显示,中国慢性肾病患者约为1.5亿[2]。慢性肾病若未获得有效干预,随着疾病进展为终末期肾病,终末期肾病又称为尿毒症[3],尿毒症的治疗方式只有维持性血液或肾脏移植。由于肾脏移植术较为困难,多数尿毒症患者采用维持性血液透析(maintenance hemodialysis,MHD)的治疗方式[4]。动静脉内瘘(arteriovenous fistula,AVF)也是MHD的一种,其具有感染率低、通畅率高、使用寿命长的优点,是目前透析患者最佳的血管通路,也是MHD患者的生命线[5-6]。但AVF也存在缺点,尤其对心血管系统产生的影响较大。目前AVF仪器说明书中要求内瘘血流量为600~1800 ml/min,低于这一范围易发生血栓和阻塞;高于这一范围,易出现心功能障碍,如左右心室、心房舒张收缩功能病变及心力衰竭等[7]。目前临床上对高流量AVF界定尚无明确规定[8],正常血管通路可以保证血液流速为250~300 ml/min,然而实际工作中透析患者由于自身动脉粥样硬化等原因,血管弹性及韧性减弱,易出现血流量不足、内瘘闭塞的情况。除此以外,因担忧对心血管系统造成不良影响,患者在临床治疗时常要求医务人员降低泵控速度,但较低血流量的MHD对患者并无益处,长期低泵控血流量的透析会使患者的生活质量下降,增加并发症的发生率。因此,本研究旨在探讨不同泵控速度对MHD的AVF患者透析相关指标及心功能的影响,以期为临床医护人员调节泵控速度提供依据,现报道如下。
1 资料与方法
1.1 一般资料
收集2016年12月至2019年12月青海省第五人民医院收治的MHD中使用AVF患者的临床资料。纳入标准:(1)年龄18~80岁;(2)MHD中使用AVF持续3个月及以上,每周至少3次;(3)纽约心脏病协会(New York Heart Association,NYHA)心力衰竭分级Ⅰ~Ⅲ级;(4)接受MHD后,初次透析充分性均达标,尿素清除指数(透析器的尿素清除率×透析时间/尿素在体内的分布容积)≥1.2[9]。排除标准:(1)AVF发生不良反应;(2)伴慢性阻塞性肺疾病、肺栓塞、肺动脉高压、严重心脏瓣膜病;(3)伴急性心肌梗死、心力衰竭、感染。根据纳入与排除标准,最终纳入106例患者,按照患者泵控血流量中位数进行分组,≤275 ml/min为低流量组,>275 ml/min为高流量组,各53例。两组患者的性别、年龄、透析时间等临床特征比较,差异均无统计学意义(P>0.05,表1),具有可比性。

表1 两组患者的临床特征
1.2 方法
低流量组患者泵控初始速度为275 ml/min及以下,穿刺点距动静脉吻合口3~5 m,针尖斜面向上,以30°~40°角度快速进皮后改为20°角度迅速刺入静脉中。开始时血流初始速度为150 ml/min,之后每10~15分钟提升血液流速20~30 ml/min,直至达到所需血液流速250 ml/min。
高流量组患者穿刺方法同低流量组,最终使血泵流量初始速度为275~300 ml/min,充分告知患者透析相关知识并尊重患者意愿。注意患者是否发生血管塌陷、皮下瘀血等不良情况。
两组患者均在进行透析时测量患者体重,再使其平躺10 min同时计算体重超滤量,做好各项评估。透析液为碳酸氢盐,温度37 ℃,时间4 h,在透析开始后0.5 h及结束前1 h使用美国TrasonicHD02 Monitor对所有患者进行血管内瘘血流量测定。首先将患者动脉端及静脉端在同一根血管上进行血液透析,测定血管内瘘血流量时将患者的动、静脉管路反接,设置血泵流量,随及在Transonic HD02 Moni tor操作菜单中选择内瘘血流量测定,同时注意关闭血液透析超滤,等待3~6 s后将备好的氯化钠溶液10 ml注入静脉壶中,读取并记录测定内瘘血流量。根据AVF仪器说明书,600~1800 ml/min为内瘘血流量适宜;<600 ml/min为内瘘血流量过低,应进一步检查血管是否有栓塞;>1800 ml/min为内瘘血流量过高,应及时检查患者的心功能。
1.3 观察指标及评价标准
比较两组患者的心功能指标、初级通畅率、透析效能、炎症因子水平、并发症发生率、高危事件及内瘘功能。心功能指标为AVF术后3个月时由2名有经验、技术熟练的超声医师采用彩色多普勒超声心动仪进行检查,探头频率为2.5~3.0 MHz,血管超声检查时超声探头频率设定为8~12 MHz,将带有多普勒探头及M型超声探头的食道导管经口插入食道,根据显示屏上的主动脉壁、血流波形调整探头位置直至获得满意的信号,记录患者的心排血量(cardiac output,CO)、心脏指数(cardiac index,CI)、射血分数(ejection fraction,EF)。随访1年后,由相同的医师采用同样的方式对患者再次检查。美国血管外科协会委员会发布的动静脉瘘透析通路(arteriovenous graft,AVG)[9]中的初级通畅率=观察时间点未经干预仍保持通畅的AVG患者例数/总例数×100%。透析1年后评估透析效能,包括血管通路血流量、尿素氮清除指数(透析器的尿素清除率×透析时间/尿素在体内的分布容积)、尿素氮下降率(透析前血尿素浓度/透析后血尿素浓度)。透析3、12个月后,于MHD上针前常规真空抽取内瘘动脉端血液进行炎症因子检测,包括超敏C反应蛋白(hypersensitive C reactive protein,hs-CRP)、白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、β2微 球 蛋 白(β2-microglobulin,β2-MG)。并发症包括血管栓塞、临时静脉置管感染、肿胀、假性动脉瘤。根据美国纽约心脏病学会分级方案判定高危事件[10],若患者心功能>Ⅲ级,或在调查期间曾因心血管并发症住院则计入高危事件一次。内瘘功能检查为瘘侧触及细震颤、闻及血管杂音,若触及不到则为内瘘失功,每次血液透析前医师根据AVF搏动、震颤和杂音特点进行内屡功能判定,记录每次检查情况。
1.4 统计学方法
采用SPSS 20.0软件对数据进行统计分析,符合正态分布且方差齐性的计量资料以()表示,组间比较采用两独立样本t检验;计数资料以n(%)表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 初级通畅率的比较
所有患者均随访12个月,期间无死亡病例。随访结束后,低流量组患者初级通畅率为77.36%(41/53),略高于高流量组患者的75.47%(40/53),差异无统计学意义(P>0.05)。
2.2 心功能指标的比较
透析12个月后,两组患者的CO、CI、EF均高于透析3个月后,差异均有统计学意义(P<0.05)。透析3、12个月后,两组患者的心功能指标比较,差异均无统计学意义(P>0.05)。(表2)
表2 透析3、12个月后两组患者的心功能指标()
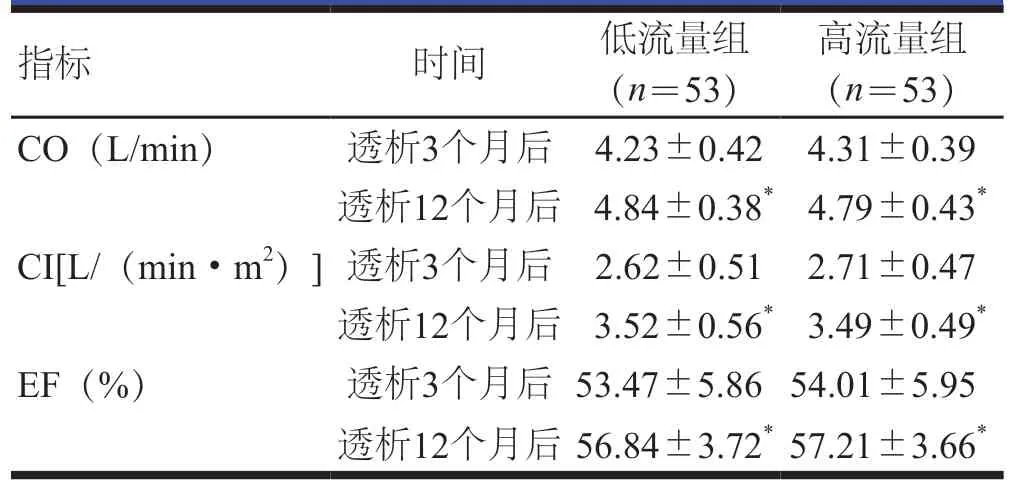
表2 透析3、12个月后两组患者的心功能指标()
注:与本组透析3个月后比较,*P<0.05
高流量组(n=53)CO(L/min) 透析3个月后 4.23±0.42 4.31±0.39透析12个月后 4.84±0.38* 4.79±0.43*CI[L/(min·m2)]透析3个月后 2.62±0.51 2.71±0.47透析12个月后 3.52±0.56* 3.49±0.49*EF(%) 透析3个月后 53.47±5.86 54.01±5.95透析12个月后 56.84±3.72* 57.21±3.66*指标 时间 低流量组(n=53)
2.3 透析效能的比较
低流量组患者血管通路血流量低于高流量组患者,差异有统计学意义(P<0.05);两组患者尿素氮清除指数、尿素氮下降率比较,差异均无统计学意义(P>0.05)。(表3)
表3 两组患者透析效能的比较()
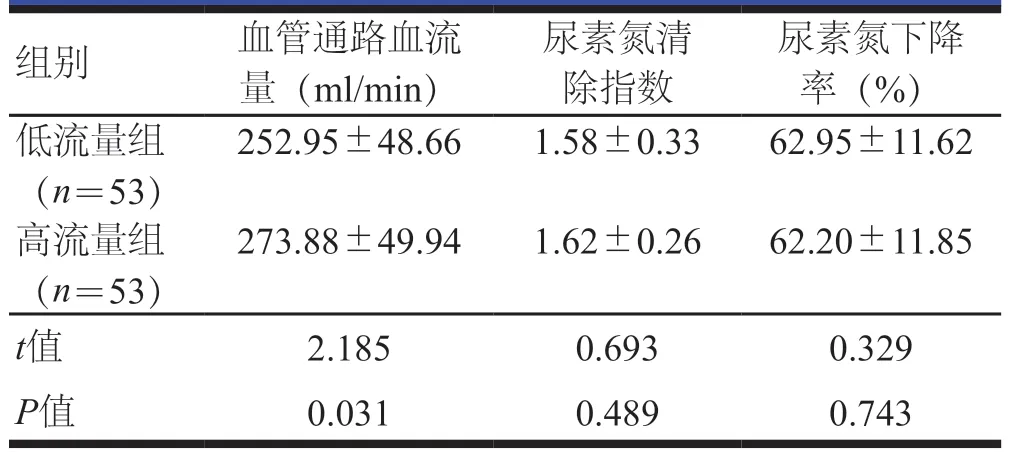
表3 两组患者透析效能的比较()
组别 血管通路血流量(ml/min)尿素氮清除指数尿素氮下降率(%)低流量组(n=53)252.95±48.66 1.58±0.33 62.95±11.62高流量组(n=53)273.88±49.94 1.62±0.26 62.20±11.85 t值 2.185 0.693 0.329 P值 0.031 0.489 0.743
2.4 炎症因子水平的比较
透析3个月后,两组患者的hs-CRP、IL-6、TNF-α、β2-MG水平比较,差异均无统计学意义(P>0.05)。透析12个月后,两组患者血清hs-CRP、IL-6、TNF-α、β2-MG水平均低于透析3个月后,差异均有统计学意义(P<0.05);但两组患者血清hs-CRP、IL-6、TNF-α、β2-MG水平比较,差异均无统计学意义(P>0.05)。(表4)
表4 透析3、12个月后两组患者的炎症因子水平()
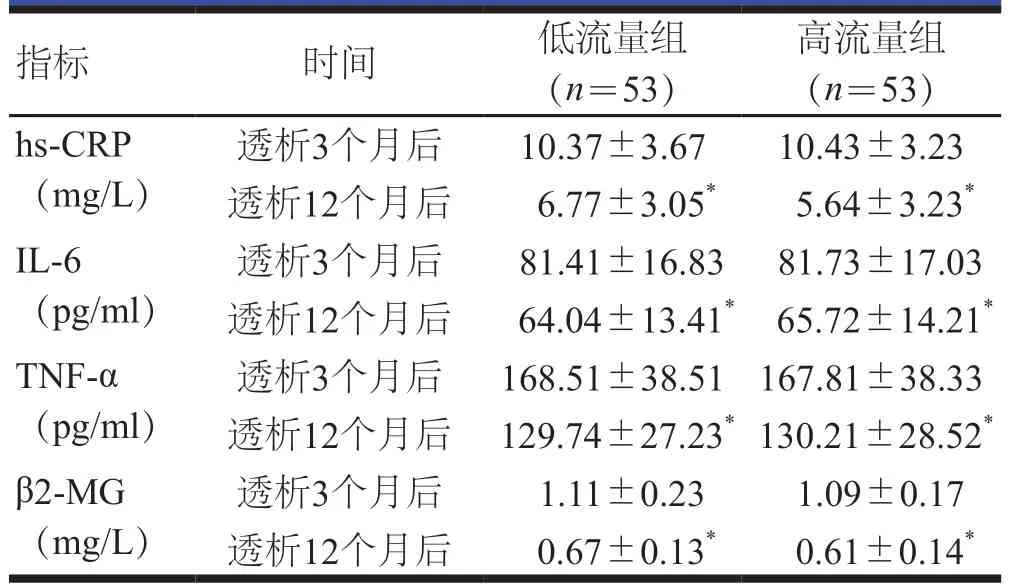
表4 透析3、12个月后两组患者的炎症因子水平()
注:与本组透析3个月后比较,*P<0.05
指标 时间 低流量组(n=53)高流量组(n=53)hs-CRP(mg/L)透析3个月后 10.37±3.67 10.43±3.23透析12个月后 6.77±3.05* 5.64±3.23*IL-6(pg/ml)透析3个月后 81.41±16.83 81.73±17.03透析12个月后 64.04±13.41* 65.72±14.21*TNF-α(pg/ml)透析3个月后 1.11±0.23 1.09±0.17透析12个月后 0.67±0.13* 0.61±0.14*透析3个月后 168.51±38.51 167.81±38.33透析12个月后 129.74±27.23* 130.21±28.52*β2-MG(mg/L)
2.5 并发症、高危事件、内瘘失功发生情况的比较
随访1年后,两组患者并发症、高危事件和内瘘失功发生率比较,差异均无统计学意义(P>0.05)。(表5)

表5 两组患者并发症、高危事件、内瘘失功的发生情况[n(%)]
3 讨论
终末期肾脏疾病的患者都需要持续长时间的MHD来维持治疗,除此以外,多种并发症也是困扰终末期肾脏疾病患者的难题[11]。本研究结果显示,低流量组患者血管通路血流量低于高流量组,而两组患者尿素氮清除指数、尿素氮下降率均无差异;透析12个月后,两组患者的CO、CI、EF均高于透析3个月后,而透析3、12个月后,两组患者的心功能指标均无差异。林金秤等[13]的报道中也指出MHD中AVF的使用可能与患者术后CO和肺动脉压力增加有关,会增加罹患心血管疾病的风险[13]。Dinoto等[14]则报道了AVF血管通路的建立与患者术后左心室肥大有关,不加以干预其后续可能发展或恶化为心力衰竭。上述研究都指出动静脉内瘘血流量和心衰发生可能有直接的联系。然而实际上,过高的动静脉内瘘血流量才是导致患者心功能指标异常的主要影响因素[15]。吴述洪等[16]的研究结果显示,动静脉内瘘血流量应控制在600~2000 ml/min,动静脉内瘘血流量小于600 ml/min时对心功能指标无影响;当动静脉内瘘血流量>2000 ml/min时,才会影响患者的心功能指标。本研究中高流量组患者动静脉内瘘血流量并未超过上述研究范围,低流量组、高流量组患者的炎症因子水平、并发症发生率、高危事件和内瘘失功均无差异,说明高流量组透析并不会影响患者的炎症因子水平、并发症发生率、高危事件和内瘘失功,表明合理且规范地按照医嘱进行透析,高、低流量对中国患者的心功能指标影响不大。有关研究显示,在发达国家中,与利用人体自身的腹膜作为透析膜的透析方式相比,体外治疗心血管并发症的发生率更高,如AVF、血液透析滤过、腹膜透析等[17]。
Charisis等[18]团队的研究,AVF对心脏氧供应/氧消耗的影响是通过影响回心血量来完成的。AVF能够显著增加患者的回心血量,进而通过影响心脏前负荷的增加,长期的高血流量AVF致使心肌纤维代偿性拉长,来满足回心血量增加造成的负荷[18],改变的心肌结构又造成右心室扩大,最终导致心力衰竭,威胁患者的生命健康。而影响AVF血流量的因素除了泵控血流速度外,也与患者自身的动静脉血管直径有关。Major等[20]团队的研究报道,患者自身的血压、有效血容量、贫血与否及血管通路的血流量是影响透析患者心功能变化的因素,与AVF的建立没有关系,这四种因素并不是独立作用的,他们之间相互影响、相互联系。
临床上需要专业且熟练的超声医师使用AVF仪器测量数据,由于患者无法实时获取数据以及不了解研究内容等因素,使其对泵控速度存在一定的顾虑,从而影响了透析效果。虽然有关报道指出,较高的泵控初始速度会使患者发生血管塌陷、皮下淤血等,但不同泵控速度对长时间接受透析患者的心功能是否有直接影响的研究很少[21]。
Dinoto等[22]团队研究采用超声稀释法在透析过程中实时监测不同泵控速度、内瘘流量对患者心脏功能的影响,结果显示,在透析开始的前半小时,动静脉内瘘血流量对心脏没有直接影响,在透析结束前的半小时,高流量组患者的CO、CI开始有变化,但是均在正常范围内[23],表明合理且规范地使用AVF,患者无需担心AVF对心功能造成不良影响,与本研究结果相一致。
临床实际工作中,部分患者仍要求在规定范围内降低透析时的泵控血流速度,给临床医护人员造成了不少困扰,也对患者的透析效果造成了无法预估的影响。目前,临床上尚无公认的金标准指导临床医务人员调节泵控速度,本研究结果可为临床医务人员提供参考,根据患者的具体情况选择合适的泵控速度,消除患者的顾虑以达到充分透析,从而提高患者的生存质量。
综上所述,在AVF仪器要求的内瘘血流量600~1800 ml/min范围内,不同泵控速度对患者的透析相关指标及心功能的影响较小,临床医务人员应根据患者的具体情况选择合适的泵控速度,以达到充分透析,从而提高患者的生活质量。

