白细胞介素-4 通过上调蛋白质精氨酸甲基转移酶1的表达水平引起对氧磷酶2的精氨酸甲基化修饰*
杨万勇, 马丽, 任家骏, 杨旭东△
1东莞市水乡中心医院检验科(广东东莞 523130); 2西安交通大学医学部基础医学院生物化学与分子生物学系(陕西西安 710061)
支气管哮喘是一种过敏性气道炎症性疾病,气道炎症进而导致哮喘患者气道高反应性,引发气道通气障碍,哮喘长期反复发作会导致气道重塑[1]。呼吸道上皮细胞是机体和外部环境之间的屏障,是机体抵抗病原微生物、有害气体和过敏原侵害的第一道防线[2]。近来许多研究发现,上皮细胞在哮喘发病进程中发挥了重要的作用,它可通过分泌多种细胞因子启动并加强气道炎症,并导致气道高反应性[3]。蛋白质精氨酸甲基转移酶1(PRMT1)是Ⅰ型的蛋白质精氨酸甲基转移酶(PRMTs)家族的成员,它可以催化蛋白质精氨酸残基发生非对称二甲基化修饰[4],这是一种调节蛋白质功能的重要方式。根据我们课题组的前期实验研究发现,在卵清蛋白诱导的E3大鼠急性哮喘模型(AIPI)中,肺上皮PRMT1 的表达明显升高,白细胞介素-4(IL-4)可以上调肺上皮细胞中PRMT1的表达水平。这些都提示PRMT1与哮喘气道炎症的发生密切相关[4]。但是在哮喘发病的进程中,PRMT1是如何发挥作用的,它修饰的下游靶分子有哪些尚不清楚。为了阐明PRMT1在哮喘中的作用,2018年1月至2021年3月我们采用免疫沉淀的方法对肺上皮细胞中PRMT1修饰的靶蛋白进行了筛选,并对筛选出的对氧磷酶-2(PON2)的甲基化修饰做了进一步的验证。
1 材料与方法
1.1 材料 卵清白蛋白(OVA)(美国Sigma公司)、KAl(SO4)2·12H2O(美国Sigma公司)、小鼠IgE检测试剂盒(上海西塘生物)、RevertAcid 第一链 cDNA合成试剂盒(Thermo Fisher Scientific, USA)、2×SYBR® Prime mix(Roche)、ECL 发光液(BIO-RAD)、重组人IL-4(易飞生物)、兔抗PRMT1 多克隆抗体(英国Abcam 公司)、兔抗PON 2 多克隆抗体(英国Abcam 公司)、兔抗不对称精氨酸甲基化多克隆抗体(英国Abcam 公司)、兔同型IgG(英国Abcam 公司)、兔抗 β-actin 单克隆抗体(北京博奥森生物技术有限公司)、鼠抗GAPDH多克隆抗体(Santa)、MS023(MCE)、Protein A+G磁珠(碧云天生物技术有限公司)、银染试剂盒(碧云天生物技术有限公司)。
本研究已获西安交通大学伦理委员会审批(审批号为2017-693)。
1.2 筛选在IL-4刺激下发生精氨酸非对称性二甲基化修饰的蛋白 A549 细胞购于上海中科院细胞库,用含10% FBS的1640培养基,在37℃,5% CO2的环境下培养。把细胞种于10 cm的平皿,用50 ng/μL IL-4的刺激A549细胞24 h,用中等强度的RIPA细胞裂解液在冰上裂解细胞,提取总蛋白;对照组的细胞用PBS刺激24 h提取总蛋白。用BCA试剂盒测定样品的浓度。
用Protein A+G磁珠吸附同型兔IgG后,与3 mg新鲜的蛋白样品混合,去除非特异性结合的蛋白,分离上清溶液。随后用Protein A+G磁珠吸附抗不对称精氨酸甲基化多克隆抗体,与去除了非特异性结合蛋白后的蛋白样品混合,在摇床上4℃孵育过夜。弃掉上清液,用PBS清洗磁珠。加入SDS-PAGE上样缓冲液,并在95℃加热5 min,以洗脱磁珠结合的蛋白和抗体。把洗脱的上清液保存在-80℃冰箱备用。
制作中型变性梯度聚丙烯酰胺凝胶,浓度梯度的范围为5%~20%。把从磁珠上洗脱的蛋白在中型变性梯度聚丙烯酰胺凝胶上电泳。电泳结束后,用银染法对凝胶进行染色,显示电泳的条带。割取对照样品泳道与IL-4刺激样品泳道的差异性条带。用胰酶进行胶内酶解20 h,随后抽提酶解肽段进行ESI质谱鉴定。
1.3 PON2精氨酸甲基化修饰的水平的验证 把A549细胞接种到6孔板培养,分为2种不同的处理组:IL-4刺激组和对照组。用50 ng/μL IL-4的刺激24 h,对照孔用PBS刺激细胞。用RIPA裂解细胞,提取蛋白,用BCA法测定蛋白浓度。从对照样品及IL-4处理样品中各取400 μg,用免疫沉淀法检测PON2的甲基化。具体过程如下:把抗PON2的抗体与蛋白样品混合,在4℃缓慢摇动过夜,用兔IgG做同型对照;把孵育好的样品与Protein A+G磁珠混匀,在室温孵育1 h;用PBST洗涤磁珠3次后,用SDS电泳上样缓冲液洗脱磁珠捕获的蛋白,用抗精氨酸非对称性二级甲基化修饰的抗体做Western blot,检测PON2的甲基化修饰水平。
1.4 IL-4对PON2和PRMT1表达的影响 把A549细胞接种到6孔板培养,分析PON2和PRMT1表达对IL-4的浓度依赖性。分别用0、25、50、100、200 ng/mL的IL-4刺激细胞,刺激24 h后,用RIPA裂解细胞,提取蛋白。用BCA法测定蛋白浓度。用Western blot检测PON2和PRMT1的表达水平,用GADPH做内参。
并且用50 ng/mL的IL-4分别刺激细胞0、6、12、24、48 h,用RIPA裂解细胞,提取蛋白。用BCA法测定蛋白浓度。用Western blot检测PON2和PRMT1的表达水平,用GADPH做内参,分析PON2和PRMT1表达对IL-4的时间依赖性。
1.5 分析PON2与PRMT1的相互作用 把A549细胞接种到6孔板培养,分为2种不同的处理组:IL-4刺激组和对照组。用50 ng/μL IL-4的刺激24 h,对照孔用PBS刺激细胞。用RIPA裂解细胞,提取蛋白,用BCA法测定蛋白浓度。从对照样品及IL-4处理样品中各取400 μg,用免疫共沉淀法检测PON2与PRMT1的相互作用。把抗PRMT1的抗体与蛋白样品混合,在4℃缓慢摇动过夜,用兔IgG做同型对照;把孵育好的样品与Protein A+G磁珠混匀,在室温孵育1 h;用PBST洗涤磁珠3次后,用SDS电泳上样缓冲液洗脱磁珠捕获的蛋白,用抗PON2的抗体做western blotting,检测沉淀下来的PON2的水平。
进而用PRMT1抑制剂MS023处理细胞,检测PON2的甲基化水平。把A549细胞接种到6孔板培养,分为3种不同的处理组:IL-4刺激组、对照组、IL-4+MS023组和MS023组。用50 ng/μL IL-4的刺激24 h,对照孔用PBS刺激细胞,MS023的终浓度为4.76 μmol/mL。用RIPA裂解细胞,提取蛋白,用BCA法测定蛋白浓度。从对照样品及IL-4处理样品中各取400 μg。用免疫沉淀法检测PON2甲基化的水平,用抗精氨酸非对称性二级甲基化修饰的抗体做western blotting,检测PON2的甲基化修饰水平。具体方法同1.3。
1.6 急性哮喘模型的诱导 24只7~8周的雌性Balb/c小鼠,均购自西安交通大学动物实验中心。适应1周,自由摄取水食,昼/夜12 h循环灯光。饲养环境温度维持在(25±3)℃,相对湿度维持在(40±5)%。1周后随机分为对照组和哮喘模型组。
在第0天,给哮喘模型组小鼠腹腔注射卵清蛋白-氢氧化铝混悬液[0.1% OVA,5% Al(OH)3]0.1 mL进行致敏;在第7天再次注射卵清蛋白-氢氧化铝混悬液以加强免疫。给对照组小鼠腹腔注射等量PBS。在第14 天开始哮喘组小鼠用40μL 2.5 mg/mL OVA 溶液滴鼻,1次/d,连续7 d,对照组小鼠用PBS滴鼻。在第21天拔眼取血处死小鼠,分离血清备用。分离出完整的肺连同气管,用1 mL PBS进行肺泡灌洗,共灌洗3次,1 000 r/min离心10 min,分离肺泡灌洗液中的细胞,300 μL的PBS悬浮细胞。吸取30 μL细胞悬液涂到载玻片上制备肺泡灌洗液涂片,等涂片干燥后用甲醇固定细胞。分离出左肺第三叶,用4%多聚甲醛固后,在石蜡中包埋。剩余的肺组织用液氮速冻后保存到-80℃冰箱。
用吉姆萨染液对细胞涂片进行染色,检测肺泡灌洗液中嗜酸性粒细胞的水平。石蜡切片用HE染色,观察肺组织的病理改变。用PON2抗体做免疫组化检测肺组织中PON2表达的组织细胞类型。用ELISA法检测小鼠血清中总IgE的水平。
用RIPA裂解肺组织,提取组织蛋白,用western blotting检测肺组织中PON2和PRMT1的表达水平。
1.7 统计学方法 数据用均数±标准差表示,采用Mann Whitney检验分析进行两两比较。采用One way ANOVA中的Newman-Keuls 多组检验来进行多组比较,P<0.05为差异有统计意义。所有统计采用统计软件 GraphPad Prism5完成。
2 结果
2.1 质谱筛查结果显示PON2精氨酸残基可发生非对称性二甲基化修饰 分别从IL-4刺激的A549细胞以及对照组细胞中提取蛋白质,用免疫沉淀法捕获其中发生了精氨酸残基非对称性二甲基化修饰的蛋白,并采用变性梯度聚丙烯酰胺胶来显示甲基化水平发生改变的蛋白。经银染后显示,在40 KD左右的位置,在IL-4处理组的泳道有2个差异明显的条带(图1-A)。我们割取了这两个差异比较明显的蛋白条带,进行ESI质谱鉴定。第一个胶条,蛋白的分子量范围约为40 KD;第二个胶条蛋白的分子量范围约为35 KD。第一个胶条的质谱图显示有一个较强的质谱峰(图1-B)。对获得多肽序列进行评价,以Delta CN(≥0.1)和具备恰当cross-correlation scores的序列为鉴定成功的序列,又从中选择肽段数≥2的肽段来做搜库。最终获得159个候选蛋白。第二个胶条的质谱图也显示有一个较强的质谱峰(图1-C),搜库后找到152个候选蛋白。

注:A:变性梯度聚丙烯酰胺电泳显示抗甲基化抗体免疫性沉淀捕获的蛋白;B:在45 KD处的差异性条带的质谱分析图;C:在35 KD处的差异性条带的质谱分析图
PON2为第一个胶条所筛选出的159个蛋白中之一。Polonikov等[5]在采用关联分析及多因素维数降维分析等方法分析抗氧化酶的基因多态性与成人哮喘发病的相关性时,发现PON2可能是哮喘的易感基因。因此,我们选择PON2作为进一步研究的对象。
2.2 IL-4可以促进PON2发生非对称性二甲基化修饰 为了进一步验证质谱分析的结果,我们采用免疫沉淀的方法检测了IL-4刺激的肺上皮细胞株A549中PON2的非对称性二甲基化修饰水平。发现IL-4刺激可导致肺上皮细胞株中PON2的甲基化非对称性二甲基化修饰水平升高(图2)。

图2 免疫沉淀显示 IL-4上调A549细胞中PON2的甲基化水平
2.3 IL-4上调PRMT1的表达,但不改变PON2的表达水平 PRMT1是催化蛋白质发生精氨酸残基非对称性甲基化的酶。为了进一步阐明IL-4促进PON2甲基化水平升高的机制,我们分析了不同的IL-4剂量,以及刺激不同的时间对PRMT1和PON2表达水平的影响。结果显示,随IL-4浓度的升高,PRMT1的蛋白水平不断升高,但是PON2的蛋白水平不会随IL-4浓度的升高而改变(图3-A);在不同浓度IL-4刺激下PRMT1和PON2的相对表达见表1。同时在IL-4刺激12 h时,PRMT1的蛋白水平开始显著升高,随着IL-4刺激时间的延长,PRMT1的水平会继续升高;随着IL-4刺激时间从0~48 h,PON2的蛋白水平均无明显的变化(图3-B);在IL-4刺激不同时间后PRMT1和PON2的相对表达见表2。由此可以得出结论,IL-4对PRMT1的表达水平的影响呈时间依赖性和剂量依赖性,但是对PON2的表达水平无显著的影响。

表1 IL-4刺激24 h后PRMT1和PON2的相对表达

表2 50 ng/mL IL-4刺激不同时间后PRMT1和PON2的相对表达
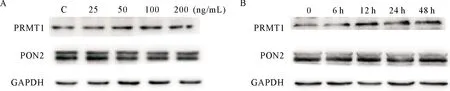
注:A:随IL-4浓度从0~200 ng/mL不断升高,PRMT1的蛋白水平升高,而PON2的表达水平不变;B:随IL-4浓度从0~200 ng/mL不断升高,PRMT1蛋白的相对表达水平升高
2.4 PON2为PRMT1的底物分子 为了验证PON2是PRMT1的底物蛋白,我们通过免疫共沉淀(Co-IP)实验来检测PRMT1和PON2 的相互作用。Co-IP实验结果表明,用抗PON2 抗体沉淀后,再用抗PRMT1 抗体进行Western blotting 检测,可以发现IL-4 刺激组PRMT1的水平显著高于对照组(图4-A)。这说明PON2与PRMT1在细胞内有相互作用,并且随着IL-4刺激,与PON2结合的PRMT1增多。这说明PON2为PRMT1的底物蛋白。因为IL-4不会上调PON2的表达水平,所以我们可以确定是因为PRMT1的表达升高,所以有更多的PON2被PRMT1所识别和结合,从而提高了PON2的甲基化水平。为了进一步验证这一结论,我们使用了Ⅰ型PRMT的抑制剂MS023,可以看到IL-4可以上调PON2蛋白精氨酸残基非对称性二甲基化水平,但是当PRMT1的活性被抑制后,IL-4上调PON2甲基化的效应立即减弱了(图4-B)。这进一步说明PON2是PRMT1的底物蛋白。

注:A:用抗PON2抗体做免疫共沉淀,可以拉下PRMT1蛋白,这说明PON2与PRMT1相结合。并且IL-4处理组PRMT1与PON2的结合增强。B:用免疫沉淀法检测PON2蛋白的甲基化修饰水平,IL-4可增强PON2蛋白的甲基化修饰水平,但当MS023抑制PRMT1活性后,IL-4对PON2蛋白甲基化修饰的促进作用也削弱了
2.5 小鼠哮喘模型气道上皮细胞中PON2的表达水平无明显变化 为了了解哮喘动物模型中PON2的表达情况,我们诱导了小鼠的急性哮喘模型。我们哮喘组和对照组小鼠的肺组织切片进行了HE染色:和对照组相比,哮喘模型组小鼠在气道壁周围均有大量炎症细胞浸润(图5)。与对照组相比,哮喘模型组小鼠肺泡灌洗液中嗜酸性粒细胞的比例显著升高(P<0.01)。并且,哮喘模型组血清中总IgE水平也显著高于对照组(P<0.01),见表3。这些都说明急性哮喘模型诱导成功。

表3 肺泡灌洗液中嗜酸性粒细胞的水平及血清总IgE的水平

注:A:对照组小鼠肺组织的组织图片;B:哮喘模型组小鼠肺组织的组织图片
随后,我们检测了小鼠肺组织中PON2的表达。我们发现,小鼠肺组织中PON2主要表达于气道上皮细胞(图6-A、B);并且与对照组相比,哮喘模型组小鼠的PON2的表达水平无明显变化,但是PRMT1的表达水平显著升高(图6-C)。这与细胞模型相吻合。见表4。由此,我们推测在哮喘发生过程中,PON2的精氨酸残基非对称性二甲基化修饰水平应该与细胞模型中所观察的一样,会显著升高。

表4 小鼠哮喘模型肺组织PRMT1和PON2的相对表达

注:A:对照组小鼠肺组织PON2主要在气道上皮细胞中表达;B:哮喘模型组小鼠肺组织中PON2主要在气道上皮细胞中表达;C:与对照组相比,哮喘模型组小鼠PRMT1的表达水平显著升高,PON2的表达水平无明显变化
3 讨论
在本研究中,我们筛选了肺上皮细胞中PRMT1的底物蛋白,并发现PON2为PRMT1的底物蛋白,IL-4可以促进PON2发生非对称性的二甲基化修饰。
气道上皮是隔绝机体内环境与外界环境的屏障[6],并且可通过分泌多种细胞因子等多种细胞因子来调介导先天性免疫和继发性免疫,在维持维持机体内环境稳定方面具有重要的意义。而哮喘的发生、发展与气道上皮损伤有密切关系[7-8]。一般认为,哮喘导致的气道上皮损伤与氧化应激以及内质网应激有密切的关系。哮喘可导致肺组织中氧化-抗氧化平衡的破坏[9-11],造成氧化应激。氧化应激可导致支气管上皮损伤[12-14]。同时,与气道过敏性炎症有密切关系的IL-4可通过诱导气道上皮细胞发生氧化应激,进而导致气道上皮损伤[15]。氧化应激造成的脂质过氧化会向气道招募的炎症细胞促进TGF-β和VEGF释放,进一步增强气道炎症,并引发气道重塑[16]。而且ROS的积累不仅破坏细胞结构,还可激活线粒体凋亡通路,造成气道上皮细胞过度凋亡[17-19]。因此,抗氧化也成为哮喘治疗的一个重要研究方向。
PON2是对氧磷酶家族中最古老的成员,它在多种组织细胞中广泛表达,并且分布于细胞膜、胞浆、内质网、线粒体和胞核等多个亚细胞部位。PON2具有钙依赖的内酯、酶、芳基酯酶活性和抗氧化活性[20],在抗病原菌感染发挥重要的作用[21];同时它也是抗氧化系统的重要组成部分[22],可保护线粒体免受氧化应激的损伤,并减少氧化应激诱导的凋亡[23];PON2还表现出抗内质网应激的能力[24]。Polonikov等[5]在采用关联分析及多因素维数降维分析等方法分析抗氧化酶的基因多态性与成人哮喘发病的相关性时,发现PON2可能是哮喘的易感基因。在从PON2表现出的抗氧化和抗内质网应激能力来看,它对细胞有保护性的作用。通过我们的实验显示,在小鼠哮喘模型中,PON2主要表达于气道上皮细胞,并且与对照组相比,小鼠哮喘模型肺组织中PON2的表达水平无明显的改变。结合在哮喘发生过程中气道上皮会发生氧化应激和内质网应激这一情况来看,在PON2蛋白表达水平不变的情况下,它的保护功能应该是通过蛋白的修饰,或活性调节等方式来进行调整,以适应生理状态的变化。
在筛选肺上皮细胞中PRMT1底物时,我们发现PON2为PRMT1底物,可发生精氨酸非对称的二甲基化修饰,并且IL-4可促进PON2发生非对称的二甲基化修饰,但是不改变PON2的蛋白表达水平。我们前期的工作已证实PRMT1在哮喘发生中起重要作用,IL-4可以上调肺上皮细胞中PRMT1表达[4],随着PRMT1的升高可促使上皮细胞产生趋化因子[5],改变miRNA的表达谱[25]。在气道上皮细胞中,PRMT1发挥作用的机制尚不清楚。而且有研究显示,ROS可促进PRMT1活性的升高[26]。蛋白质的精氨酸残基发生非对称的二甲基化修饰通常会改变蛋白的功能,PON2已被证实可发生泛素化以及谷胱甘肽化等修饰形式,而且这些修饰也会改变PON2的功能。因此,PRMT1催化PON2发生非对称的二甲基化修饰很可能也改变PON2的抗氧化及抗内质网应激活性,从而参与哮喘的发病过程中去。
在本研究中,我们确定了PON2是PRMT1的底物蛋白,并且在IL-4刺激下其精氨酸残基可发生非对称性的二甲基化修饰。这为我们理解PRMT1参与哮喘气道上皮炎症发生的过程提供了一个新的视角,也为我们理解哮喘发病过程中氧化-抗氧化失衡的机制提供了一个新的研究方向。
利益相关声明:文章所有作者共同认可文章无相关利益冲突。
作者贡献说明:研究设计为杨旭东,研究方案执行与实施为杨万勇、马丽、任家骏,数据整理为马丽,统计撰写论文为杨万勇,论文审阅为杨旭东。

