苯磺酸瑞马唑仑对宫腔镜手术患者麻醉苏醒质量和认知功能的影响
吴娜 王昭敏 储惠君 王敦亮
(1 青岛大学医学部,山东 青岛 266071; 2 菏泽市妇幼保健院; 3 青岛大学附属青岛妇女儿童医院麻醉科)
宫腔镜手术是通过子宫内置窥镜辅助完成的微创手术,具有创伤小、患者恢复快等优势,其在妇科疾病的应用日渐广泛[1-2]。研究表明,宫腔镜手术因操作复杂,易使患者产生应激反应,引起苏醒期躁动及认功能障碍[2-3],因而选择合适的麻醉药物以改善麻醉效果,降低患者术后不良反应十分必要。丙泊酚作为一种常见的麻醉诱导药物,其具有起效迅速、苏醒快、可控性强等优点[4]。瑞芬太尼常用于患者全麻诱导和术中维持镇痛,具有起效快、镇痛作用强、体内蓄积少等特点,与丙泊酚联用具有协同作用[5]。苯磺酸瑞马唑仑是一种新型苯二氮类药物,主要用于全身麻醉,具有起效快、维持和恢复时间短、蓄积少、无严重副作用等特点,同时具备了咪达唑仑的安全性与丙泊酚的有效性,临床应用前景较好,然其对患者术后认知功能影响的研究报道较少[6]。本研究拟探讨苯磺酸瑞马唑仑与瑞芬太尼联用对宫腔镜全麻手术患者的麻醉效果及对术后认知功能的影响。
1 对象与方法
1.1 研究对象
选取2021年1-3月于我院拟行宫腔镜手术的患者112例为研究对象。纳入标准:①符合美国麻醉医师协会(ASA)分级Ⅰ~Ⅱ级;②符合宫腔镜手术治疗指征;③年龄18~55岁。排除标准:①合并严重高血压及心、肝、肾等疾病者;②有精神疾病或认知功能障碍者;③对本研究药物过敏者。按照随机数字表法将患者分为试验组和对照组,每组各56例。两组患者一般临床资料比较,差异均无显著性(P>0.05)。见表1。本研究两组例数均>51例,符合最低样本量要求。

表1 两组患者一般资料比较(n=56)
1.2 方法
1.2.1术前准备 所有患者术前6~8 h开始禁食、禁饮。术前30 min注射阿托品0.5 mg及苯巴比妥钠0.1 g。入手术室后,常规建立外周静脉通路,并输注乳酸钠林格注射液2 mL/(kg·h),面罩吸氧3~4 L/min。并采用多功能监护仪M193719(北京中西远大科技)持续监测患者心率(HR)、平均动脉压(MAP)、血氧饱和度(SpO2)。
1.2.2术中麻醉 ①麻醉诱导:对照组经静脉通路给予2 mg/kg丙泊酚(江苏恩华药业,国药准字号H20123138),试验组给予0.4 mg/kg苯磺酸瑞马唑仑(宜昌人福药业,批准文号H2020006),两组患者均联合1 μg/kg瑞芬太尼(宜昌人福药业,国药准字号H20030198)进行麻醉诱导。待患者睫毛反射及咽喉反射消失后,置入合适型号的喉罩行机械通气。②麻醉维持:手术中对照组采用经静脉泵注丙泊酚4 mg/(kg·h)及瑞芬太尼0.20~0.30 μg/(kg·min)维持麻醉,试验组采用静脉泵注1 mg/(kg·h)苯磺酸瑞马唑仑及0.20~0.30 μg/(kg·min)瑞芬太尼维持麻醉。术中维持麻醉深度监测(BIS)值40~60,根据BIS值调整麻醉药用量,如果发现麻醉过浅,则两组患者分别在原泵注药剂量的基础上静脉推注丙泊酚(0.25 mg/kg)或者苯磺酸瑞马唑仑(0.20 mg/kg);若麻醉过深,则在原泵注药剂量基础上减少相应药物10%的用量。
手术结束后停止用药,观察患者反应,待患者呼吸恢复后拔除喉罩,继续面罩吸氧,继续观察患者直至意识、定向力等恢复,确定无异常反应后送至麻醉恢复室苏醒。
1.3 观察指标
①血流动力学指标:对比两组患者麻醉诱导前(T0)、插管前(T1)、插管后10 min(T2)、手术结束时(T3)、拔管后10 min(T4)的HR、MAP、SpO2。②麻醉苏醒质量:比较两组患者麻醉诱导时间、手术时间、舒芬太尼用量、呼吸恢复时间、定向力恢复时间、拔管时间、睁眼时间。③镇痛效果:分别于手术后3、6、24、48 h采用视觉模拟评分法(VAS)来进行评估。④认知功能:分别采用警觉-镇静评分量表(OAAS)[7]和精神状态评价量表(MMSE)[8]于术前及术后3、6、24、48 h进行评估。⑤围手术期不良事件:统计两组患者围手术期不良事件发生情况,并计算总发生率。
1.4 统计学方法

2 结 果
2.1 血流动力学指标变化比较
重复测量设计方差分析结果显示,组别对HR、SpO2均具有显著的影响(F组别=3.213、2.871,P<0.05),而对MAP没有明显影响(P>0.05);时间对HR、MAP、SpO2均具有显著的影响(F组别=6.539~299.955,P<0.05);时间与组别交互作用对HR、MAP、SpO2均无明显影响(P>0.05)。单独效应结果显示,与T0时间点相比较,两组患者T1~T4时HR的水平均显著升高(F=166.362、121.458,P<0.05),MAP水平均显著降低(F=24.785、22.952,P<0.05);与对照组比较,试验组患者在术后T3、T4时间点的HR、SpO2均明显降低(F=2.240~4.917,P<0.05)。见表2。
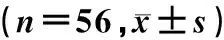
表2 两组患者血流动力学指标变化比较
2.2 镇痛效果比较
重复测量设计方差分析结果显示,组别、时间、时间与组别交互作用对VAS评分均具有显著影响(F组别=20.572,F时间=225.883,F时间*组别=2.838,P<0.05);单独效应结果显示,与术后3 h相比,两组患者术后6、24 h VAS评分均升高(F=129.123、77.323,P<0.05);与对照组相比,试验组患者术后6、24 h时VAS评分均明显降低(F=4.316、2.130,P<0.05)。见表3。

表3 两组患者术后VAS评分比较(分,
2.3 麻醉苏醒质量比较
两组患者的手术时间比较,差异无统计学意义(P>0.05);试验组麻醉诱导时间、瑞芬太尼用量、呼吸恢复时间、拔管时间、睁眼时间、定向力恢复时间均显著小于对照组(t=-11.581~-4.139,P<0.05)。见表4。
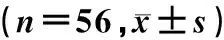
表4 两组患者麻醉苏醒质量比较
2.4 认知功能比较
重复测量设计方差分析结果显示,组别、时间、时间与组别交互作用对OAAS、MMSE评分均具有显著影响(F组别=42.699、32.714,F时间=156.778、975.900,F时间*组别=4.208、6.898,P<0.05);单独效应结果显示,与术后3 h进行比较,两组患者术后6、24、48 h时的OAAS评分均显著升高,差异具有显著性(F=72.425、86.773,P<0.05);与术前相比较,两组患者术后3、6、24 h时MMSE评分均显著降低,差异具有显著意义(F=417.960、297.237,P<0.05);与对照组进行比较,试验组术后3、6、24 h时OAAS、MMSE评分均明显升高,差异具有显著性(F=2.132~5.065,P<0.05)。见表5。
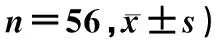
表5 两组患者OAAS及MMSE评分比较(分,
2.5 围手术期不良事件比较
试验组围手术期不良事件总发生率为10.71%,对照组为19.64%,两组患者比较差异无统计学意义(P>0.05)。见表6。

表6 两组患者围手术期不良事件发生比较[n=56,例(χ/%)]
3 讨 论
麻醉手术中,丙泊酚作为弱酸性乳制剂,可通过增加氯离子传导,降低γ-氨基丁酸(GABA)受体的敏感性,继而达到抑制中枢神经兴奋的作用,该药起效迅速、蓄积少,但其镇痛效果较弱,临床上常搭配其他药物联用[9-12]。瑞芬太尼是μ型阿片受体激动剂,注射后可迅速达到血-脑平衡,故而起效及代谢较快,体内蓄积少,常用于全麻术中维持镇痛[13]。何懿等[14]研究表明,相较于舒芬太尼,丙泊酚联合瑞芬太尼麻醉可显著减少丙泊酚用量,提示丙泊酚与瑞芬太尼联合应用具有药物协同作用,可更好地维持术中麻醉,减少患者的不良反应。本研究采用丙泊酚联合瑞芬太尼进行手术麻醉诱导及术中麻醉维持,发现血液动力学指标HR、MAP、SpO2均较为稳定,且患者麻醉苏醒及术后镇痛效果维持均较好,与以上研究结果相一致。
本研究中,两组患者术后24 h内的镇痛效果比较显示,试验组患者术后6、24 h时的VAS评分均显著低于对照组,提示苯磺酸瑞马唑仑与瑞芬太尼联用的镇痛效果更佳。可能是由于苯磺酸瑞马唑仑受体亲和力更强,可同时作用于GABA受体的4个亚型,加快氯离子内流,从而可以更快达到神经抑制的效果[18-19]。
术后认知功能障碍是全麻手术后常见中枢神经系统并发症,患者可能会出现记忆受损、精神错乱、焦虑等表现,影响患者预后,增加死亡风险,延长住院时间[20-22]。研究显示,内镜检查和(或)治疗后,患者亦可能出现认知功能障碍[9,23],在包括内镜检查和(或)治疗在内的非心脏手术患者中,术后认知功能障碍发生率约为12%[24-25]。本研究对患者认知功能进行评估,结果显示,试验组患者术后认知功能恢复更快,与之前的研究结果一致[8-20]。分析原因为,一方面,苯磺酸瑞马唑仑对α1亚型GABA受体具有较高的选择性,该亚型受体在镇静、抗惊厥方面等具有优势,能更快达到神经抑制的效果[25];另一方面,还与苯磺酸瑞马唑仑镇痛效果好、镇静速度快、镇静时间短、术中血压波动幅度低以及苏醒时间短等有关系[25-26]。本研究观察两组患者麻醉不良反应发现,苯磺酸瑞马唑仑可导致患者短暂的心肺功能抑制,主要体现在低血压、HR增加及SpO2下降,但与既往研究不同的是[8-20],本研究结果显示两组患者的不良反应发生率未见明显差异。这可能与本研究纳入的患者均为非老年患者,体能状况较好及心血管基础疾病较少有关[27]。
综上所述,与丙泊酚联合瑞芬太尼相比,苯磺酸瑞马唑仑联合瑞芬太尼诱导麻醉,可提高患者麻醉苏醒质量,而对患者认知功能影响较小,值得在临床上推广应用。
利益冲突声明:所有作者声明不存在利益冲突。
ConflictsofInterest: All authors disclose no relevant conflicts of interest.
伦理批准和知情同意:本研究涉及的所有试验均已通过青岛大学附属青岛妇女儿童医院科学伦理委员会的审核批准(文件号QFELL-KY-2021-03)。所有试验过程均遵照《涉及人的生物医学研究伦理审查办法》(2016)的条例进行。受试对象或其亲属已经签署知情同意书。
EthicsApprovalandPatientConsent: All experimental protocols in this study were reviewed and approved by The Scientific Ethics Committee of Qingdao Women’s and Children’s Hospital Affiliated to Qingdao University (Approval Letter No.QFELL-KY-2021-03), and all experimental protocols were carried out by following Mea-sures for the Ethical Review of Biomedical Research Involving Hu-mans (2016). Consent letters had been signed by the research parti-cipants or their relatives.
作者贡献:吴娜、王敦亮参与了研究设计;吴娜、王昭敏、储惠君、王敦亮参与了论文的写作和修改。所有作者均阅读并同意发表该论文。
Contributions: The study was designed byWUNaandWANGDunliang. The manuscript was drafted and revised byWUNa,WANGZhaomin,CHUHuijun, andWANGDunliang.All the authors have read the last version of the paper and consented submission.

