小鼠腮腺分割小剂量放射损伤的模型研究 *
高彦晨,关 云,张 兴
(广州中医药大学第二附属医院/广东省中医院,广东 广州 510120)
在头颈癌患者的治疗中,大约80%的患者都会接受放射治疗[1]。伴随着放射治疗手段方面取得了巨大进步,但仍有大量患者出现放疗后相关并发症,尤其是颌面部的涎腺组织更容易受到放射损伤,损伤后的腺体唾液分泌变少,引起口腔干燥的临床症状[2-4]。
动物疾病模型的建立是研究放射损伤疾病发病机制和防治的基础,从而建立一个合理的放射损伤动物疾病模型对于本病发病机理的研究和预防有重要意义。现有大量实验研究都是通过直接照射涎腺组织,且照射剂量与照射方式都不相同,实验动物包括小鼠、大鼠及小型猪等,来建立不同的放射损伤动物模型[5-9]。头颈部肿瘤患者在放射过程中,肿瘤是主要放射目标,涎腺组织间接在放射过程中受到损伤。因此,如何更好地模拟涎腺的损伤成为一个难题。本实验通过建立涎腺放射损伤小鼠动物模型,通过唾液流量、腮腺组织HE染色及水通道蛋白1(aquaporin1,AQP1)的检测来评估涎腺组织功能[4,10],为初步探索涎腺放射损伤治疗方法的改进奠定实验基础。
1 材料与方法
1.1 动物与试剂
30只健康雌性小鼠,体重(30±2)g,7~8周龄。三溴乙醇(美国Sigma公司),毛果芸香碱(北京索莱宝科技有限公司),HE染色试剂盒(北京索莱宝科技有限公司),兔多克隆抗体AQP1(Abcam,美国),辣根过氧化酶标记的山羊抗兔Ⅱ抗(北京鼎国生物科技有限公司),β-Actin兔单克隆抗体(Abcam,美国)
1.2 实验方法
将30只小鼠随机分成两组:对照组(5只)、放射组(25只;其中照射8d 8只,照射15d 8只,照射22d 9只)。称重,根据小鼠的体重腹腔注射相应的1.25%三溴乙醇(15μL/g)麻醉小鼠,以60Co γ射线为放射源,于自制固定罩内俯卧固定,照射小鼠头颈部,照射视野大小2cm×3cm,照射源与小鼠距离80cm,照射参数为1 250cGy/min,仅暴露小鼠的头颈部,其余部位用铅块遮挡。放射组小鼠分次放射,1次/d,2Gy/次,每周连续照射5d,休息2d,累计照射30Gy。对照组模拟放射组,照射剂量为0Gy。
1.3 唾液收集
分别于照射后第8、15、22d测量各组小鼠的腮腺唾液,待麻醉完全后经颈部皮下注射毛果芸香碱(1.3μL/10g),参照Coppes法[11]采集唾液,采集时间30min。
1.4 组织学观察
各时间点采集完唾液后处死小鼠,将其腮腺组织暴露,分离取出,立即固定于4%多聚甲醛中,制成蜡块,常规HE染色,封片。
1.5 Western blot实验
取小鼠腮腺组织,BCA蛋白定量试剂盒(碧云天)测量蛋白含量。以10%多聚丙酰胺凝聚(SDS-PAGE电泳分离),半干电转移法转移,取出PVDF膜,PBS缓冲液与脱脂奶粉配置成5%封闭液进行室温封闭1h。根据Marker标志切取目的条带,加入一抗(1∶1 000稀释),于4℃孵育过夜,用对应的辣根过氧化物酶标记二抗,室温孵育振荡1h。ECL发光液发光显色,使用Odyssey红外扫膜仪显影并分析结果;β-Actin作为内参照。
1.6 统计学方法
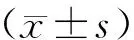
2 结 果
2.1 小鼠全身情况
放射后第1周各组小鼠饮食、体重及精神状态无明显变化,放射第2周后放射组小鼠饮食、饮水量减少,活动度及精神状态不佳,颈部毛发光泽度下降。
2.2 放射对小鼠腮腺唾液流量的影响
放射后第8、15、22d对小鼠腮腺唾液流量进行收集(表1)。与对照组相比,放射后第8、15d小鼠腮腺唾液流量没有明显差别(P>0.05);而放射后第22d小鼠腮腺唾液流量明显减少,差异有统计学意义(P<0.05)。
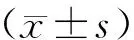
表1 小鼠放射后唾液流量
2.3 照射后腮腺组织学改变
腮腺组织形态学改变如图1所示,对照组腮腺组织结构完整清晰,腺叶间有纤维组织间隔,腺泡呈球状,排列规则紧密,泡核大且无皱缩。放射第8d腮腺组织结构无明显变化,而第15d少许腺泡出现收缩、变型。放射第22d组腮腺组织腺泡数量变少、萎缩且腺泡形状不规则,腺叶间纤维化间隙变大,胞浆浓缩,染色加深。

A:对照组;B:放射第8d;C:放射第15d;D:放射第22d
2.4 Western blot法观察照射后腮腺组织AQP1的表达变化
如图2所示,相比于对照组、放射第8d和15d,放射第22d腮腺组织AQP1的蛋白表达水平降低,结果具有统计学意义(P<0.05)。
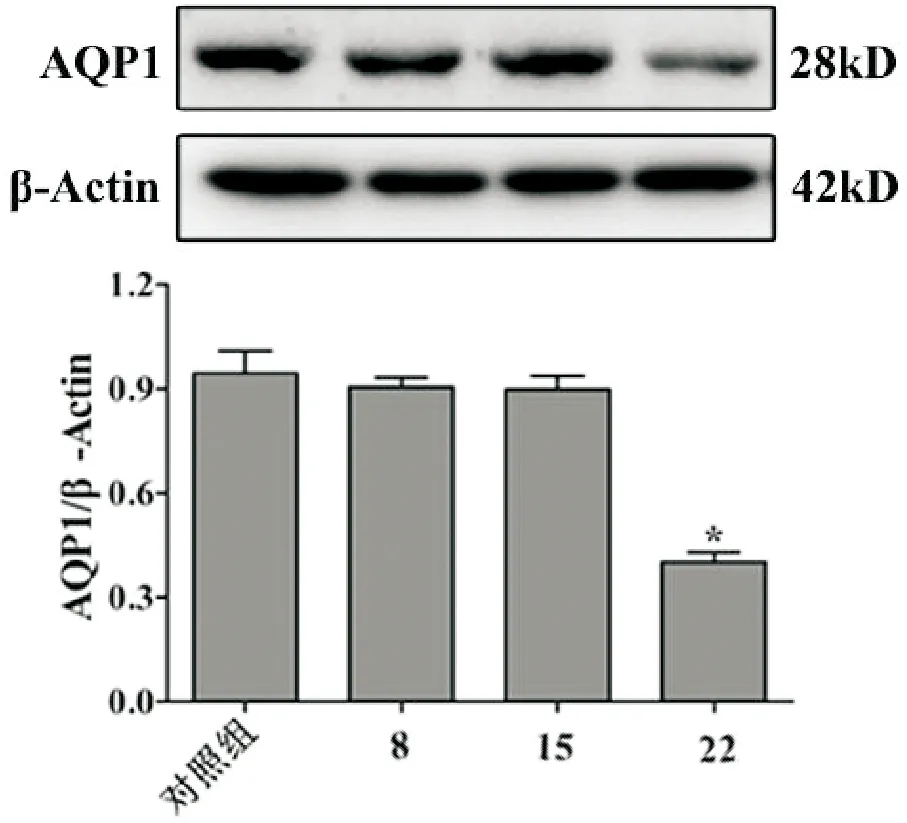
与其他3组比较,*P<0.01
3 讨 论
头颈癌患者的放射治疗过程中通常会有唾液腺腺体损伤的继发性副作用,这些副作用一般包括口干症、口腔黏膜炎和牙周病等,可导致患者的生活质量下降[12-14]。因此,需建立一个合适的放射损伤模型,来探讨放射引起腺体损伤的机制,为临床医生选择最佳的放射治疗方案提供实验基础。
涎腺的放射损伤程度与放射剂量密切相关,放射剂量越大,涎腺放射损伤程度越严重。目前大部分损伤模型都是选择大剂量单次直接照射或分次连续小剂量直接照射建立涎腺放射损伤模型[6-7,15]。涎腺是外分泌腺,通过产生和分泌唾液经导管系统排入口腔内,而腮腺是涎腺中最大的腺体,我们通过收集放射治疗后腮腺唾液流量来判断涎腺的损伤程度。在本实验中,在照射早期,放射组的唾液流量有所下降,但放射后第8d和15d小鼠唾液量较对照组相比无明显统计学意义(P>0.05);而放射后第22d收集到的小鼠唾液流量明显减少,与对照组、第8d组和第15d组相比,具有统计学意义(P<0.05)。通过腮腺唾液流量实验,我们发现分割小剂量的放射照射到达一定放射剂量后也会引起腺体的损伤,导致腮腺的唾液分泌量下降,这与Coppes等[11]的研究放射后前两期(0~60d)唾液流量持续降低基本相符。
为了进一步揭示小鼠腮腺唾液流量的变化,我们观察腺体、腺泡及导管在腮腺区的形态学改变。通过对各组小鼠微观结构的观察,发现当放射第22d,腺泡数量变少,腺泡细胞部分萎缩、消失,导管扩张,间质纤维化,染色加深。HE结果进一步揭示了放射引起腮腺腺泡数量的减少及腺泡细胞的变性和萎缩导致小鼠腮腺唾液流量减少。
AQP1是完整的膜通道蛋白,在水的转移中起重要作用,在体内不同组织和细胞中表达不同[16]。其中AQP1是一种水跨膜运输蛋白,主要参与水从血管通过基底外侧膜向腺泡细胞的转运过程[10]。建模22d后,我们通过Western blot检测发现放射组腮腺组织AQP1的蛋白表达水平降低,提示放射照射影响了AQP1的表达,继而腮腺组织的分泌功能受到影响,但本实验并未对放射照射后小鼠腮腺的损伤程度进行长时间的观察,且其机制有待进一步研究。
模拟头颈部肿瘤直接照射,分割小剂量的放射照射能引起小鼠腮腺功能及形态学明显变化,小鼠腮腺分割小剂量放射损伤的模型为临床中放射治疗技术的改进提供了一定的理论基础,而放疗技术的改进能更好地提高头颈癌患者放射治疗后的生活质量。

