Cu-OMS-2中氧化铜掺杂位置对催化氧化邻二甲苯性能的影响
张丽蕊,邢一帆,颜文秀,庞 欣,吴银素
(河北师范大学 化学与材料科学学院,河北 石家庄 050024)
挥发性有机化合物(VOCs)的排放对环境有严重危害,因此处理这些污染物成为重要的研究课题[1-2].其中,催化氧化法被认为是处理苯系物(VOCs的重要成分)最为有效的方法[3].由于非贵金属氧化物具有价格低廉、低温高活性吸附氧和高温高活性晶格氧且热稳定性高的特点,因此常被用于催化氧化苯系物[4-8].
隐钾锰矿八面体分子筛(OMS-2)是一种多孔、疏水且含有多价态Mn物种的催化剂,常被用于催化氧化VOCs[9-12].过渡金属的引入通常会显著提升OMS-2的活性.Martín-martín等[13]通过掺杂氧化铈研究发现,掺入杂原子可以有效提高催化剂催化氧化污染物的能力.其中,大量研究围绕着铜掺杂MnO2展开,这是由于铜氧化物与锰氧化物可以产生较强的相互作用.在催化氧化过程中,MnO2提供氧物种参与氧化,同时,再将铜氧化物(CuO-Cu2O)与气态氧发生氧化还原过程中产生的活性氧补充到MnO2的氧空位上,从而加速整个催化氧化过程,提高催化氧化能力.Yu等[14]采用水热氧化还原沉淀法制备了含有大量氧空位的层状铜锰氧化物,从而提高了催化剂催化氧化CO和VOCs的活性,但有关铜物种掺杂量对催化剂活性的影响并未见深入的研究.Dong等[15]通过掺杂氧化铜制备了含有不同氧空位浓度的MnO2,通过对甲苯催化氧化的研究发现,氧空位浓度适中有利于中间产物的氧化,但CuO掺杂的位置对催化氧化苯系物的影响未见报道.
OMS-2类催化剂在催化氧化VOCs时遵循Mar-van Krevelen机理[16-19],因此,对于晶格氧的流动性以及分子氧的插入能力有着较高的要求.本文中,笔者采用同步氧化还原法制备铜掺杂的Cu-OMS-2催化剂,考察不同Cu/Mn摩尔比对氧化铜的掺杂位置进而对催化剂结构和性能的影响.通过各种表征方法对催化剂的结构进行分析,利用程序升温吸脱附实验考察所得催化剂晶格氧的流动性和分子氧的插入能力,最后对催化剂的构效关系进行分析.
1 实验部分
1.1 催化剂制备
1.1.1 斐林试剂的制备
取一定量的Cu(NO3)2·2H2O溶于蒸馏水中配成0.05 mol/L的Cu(NO3)2溶液,即为斐林试剂甲溶液.取一定量的C4H4O6KNa溶于蒸馏水中配成0.2 mol/L的C4H4O6KNa溶液;取一定量的KOH溶于蒸馏水中配成0.2 mol/L的KOH溶液.将C4H4O6KNa溶液和KOH溶液等体积混合得到斐林试剂乙溶液.将斐林试剂甲溶液与斐林试剂乙溶液按体积比1∶2混合配成所需的斐林试剂.
1.1.2xCu-OMS-2的制备
① 取0.02 mol(3.16 g)KMnO4溶于50 mL蒸馏水中,配成高锰酸钾溶液;
② 取0.005 mol(0.5 mL)的丙醛,分别滴加到12,30,60 mL的斐林试剂中;
③ 将得到的溶液②滴加到①中,再向①中滴加0.02 mol(1.46 mL)的丙醛;
④ 得到的溶液③放入35 ℃水浴锅中搅拌24 h,过滤、洗涤,110 ℃干燥12 h,400 ℃焙烧6 h,最终得到样品.将其表示为xCu-OMS-2(x代表Cu/Mn摩尔比分别为0.01,0.025,0.05).
反应方程式如下:
2KMnO4+3CH3CH2CHO=2MnO2↓+CH3CH2COOH+2CH3CH2COOK+H2O,
(1)
CH3CH2CHO+Cu(OH)2+KOH=Cu2O↓+CH3CH2COOK+3H2O.
(2)
为了对比,用高锰酸钾和丙醛制备了不含铜氧化物的OMS-2催化剂.
1.2 催化剂的活性评价
催化活性测试在4 mm的石英管式反应器中进行.将0.5 g催化剂(0.3~4.5 mm)混合均匀后放入石英管内,并通过模拟的空气(V(N2)∶V(O2)=4∶1)携带体积分数为0.05 %的邻二甲苯进入石英管,在石英管内发生气固反应,通过FID检测器与填充柱、转化炉检测催化氧化反应后CO2的浓度.
1.3 催化剂的表征
采用德国Bruker公司的AXS-D8-ADVANCE型XRD确定催化剂的晶相;采用Hitachi S-4800型扫描电子显微镜(SEM)和能谱分析仪(EDX)分析其形貌和化学组成;采用Quantachrome NOVA 4000e型仪器进行N2吸附-解吸测试;采用FTR-8900型傅里叶红外光谱仪和TANFO 3-Desktop型拉曼光谱仪分析催化剂的精细结构及晶体缺陷.利用MS-5000型电子顺磁共振光谱仪对催化剂的氧空位含量进行测试;利用Builder PCA-1200型化学吸附仪对催化剂的性能进行测试.H2程序升温还原反应(H2-TPR)是取40 mg催化剂进行的.首先,在300 ℃Ar氛围下预处理1 h.其次,在10 %H2/Ar2(体积分数)氛围下以10 ℃/min的升温速率升温至600 ℃.氧气程序升温氧化(TPR-TPO)是在H2-TPR测试之后,在5 %O2/He(体积分数)氛围下以10 ℃/min的升温速率升温至600 ℃[20].
2 结果与讨论
2.1 催化剂活性测试
图1a给出了不同Cu/Mn摩尔比的Cu-OMS-2催化剂催化氧化邻二甲苯时CO2产率随温度的变换规律.n(Cu)/n(Mn)=0.01~0.025时,Cu-OMS-2较OMS-2的活性均有所提高.其中,0.025Cu-OMS-2表现出最好的活性,其T100,T50,T20分别为180,158,145 ℃,较OMS-2分别降低了20,13,12 ℃(T100,T50,T20分别对应CO2产率为100 %,50 %,20 %的温度).同时,为了测试0.025Cu-OMS-2的稳定性,在180 ℃下连续催化氧化邻二甲苯60 h.由图1b可知,CO2产率在99 %附近浮动,说明0.025Cu-OMS-2有很好的稳定性.
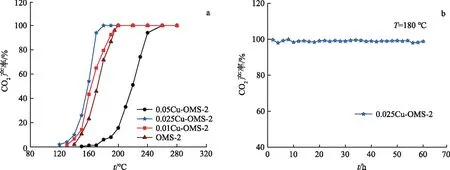
图1 xCu-OMS-2和OMS-2催化氧化邻二甲苯的CO2产率(a)和0.025Cu-OMS-2的稳定性测试结果(b)Fig.1 CO2 Yield over the xCu-OMS-2 and OMS-2(a) and Stability Test of 0.025Cu-OMS-2(b)
2.2 催化剂的结构与性质
催化剂的XRD谱见图2.由图2a可以看出,纯锰氧化物在2θ=12.8 °,18.1 °,28.8 °,37.7 °,42.0 °,49.7 °,56.1 °,60.2 °,65.4 °,69.4 °处出现了衍射峰,可归属于OMS-2的衍射峰(JCDPS 44-0141)[21].而0.025Cu-OMS-2的图谱中并未出现这些衍射峰,为了观察其晶型,分别在450,500 ℃进行焙烧,结晶度随着焙烧温度的升高逐渐出现OMS-2的衍射峰(图2b),说明0.025Cu-OMS-2为微晶态的OMS-2结构.与此同时,铜氧化物的峰一直没有显示,可能铜氧化物高度分散到了OMS-2的结构中.由0.01Cu-OMS-2的XRD谱中可以观察到OMS-2的特征峰,但衍射峰强度减弱,说明少量铜的掺入影响了OMS-2的结构.0.05Cu-OMS-2的图谱中没有明显的衍射峰,说明大量铜氧化物的掺杂降低了它的结晶度,但该催化剂的活性并没有提高.因此,对催化剂进行BET,SEM和EDX测试,从结构和元素含量进一步分析不同催化剂活性变化的原因.
BET的测试结果(表1)显示,与OMS-2相比,0.025Cu-OMS-2的比表面积增加了57.60 m2/g.说明铜氧化物的掺杂影响了OMS-2的结构,使其比表面积明显增大.同时,比较催化剂面积比速率发现,0.025Cu-OMS-2的面积比速率最大,说明0.025Cu-OMS-2催化活性的提高并不是由比表面积增大引起的.
SEM 测试结果见图3a~d.结果显示,OMS-2和0.01Cu-OMS-2均为纳米棒状结构,粒径约为80 nm,而0.025Cu-OMS-2和0.05Cu-OMS-2为颗粒状结构,说明铜氧化物的引入显著改变了OMS-2的形貌.图3a′~d′给出了EDX测试结果.分析表明,0.025Cu-OMS-2显示了铜元素的含量,结合XRD可以看出0.025Cu-OMS-2中铜氧化物高度分散在OMS-2中.根据EDX谱图计算Cu/Mn和K/Mn原子含量比(表1)发现,0.05Cu-OMS-2中Cu/Mn原子比较0.025Cu-OMS-2增大,而K/Mn原子比明显减小.因为Cu2+的半径为0.073 nm,K+的半径为0.138 nm,所以当铜含量过大时,过量的铜可能进入到催化剂的隧道中,代替隧道中的K+[22].因为OMS-2中K+的存在可以提高苯系物的被氧化能力[23],所以0.05Cu-OMS-2中的K+减少可能是其催化活性降低的原因.
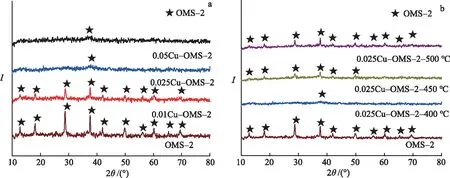
a.xCu-OMS-2和OMS-2(400 ℃); b.0.025 Cu-OMS-2(450,500 ℃).图2 催化剂的XRD谱Fig.2 XRD Spectra of the Catalysts

表1 xCu-OMS-2和OMS-2的面积比速率及元素组成Tab.1 Area Ratio Rate and Element Composition of xCu-OMS-2 and OMS-2
比表面积;c,d.K/Mn,Cu/Mn原子比通过EDX分析获得.
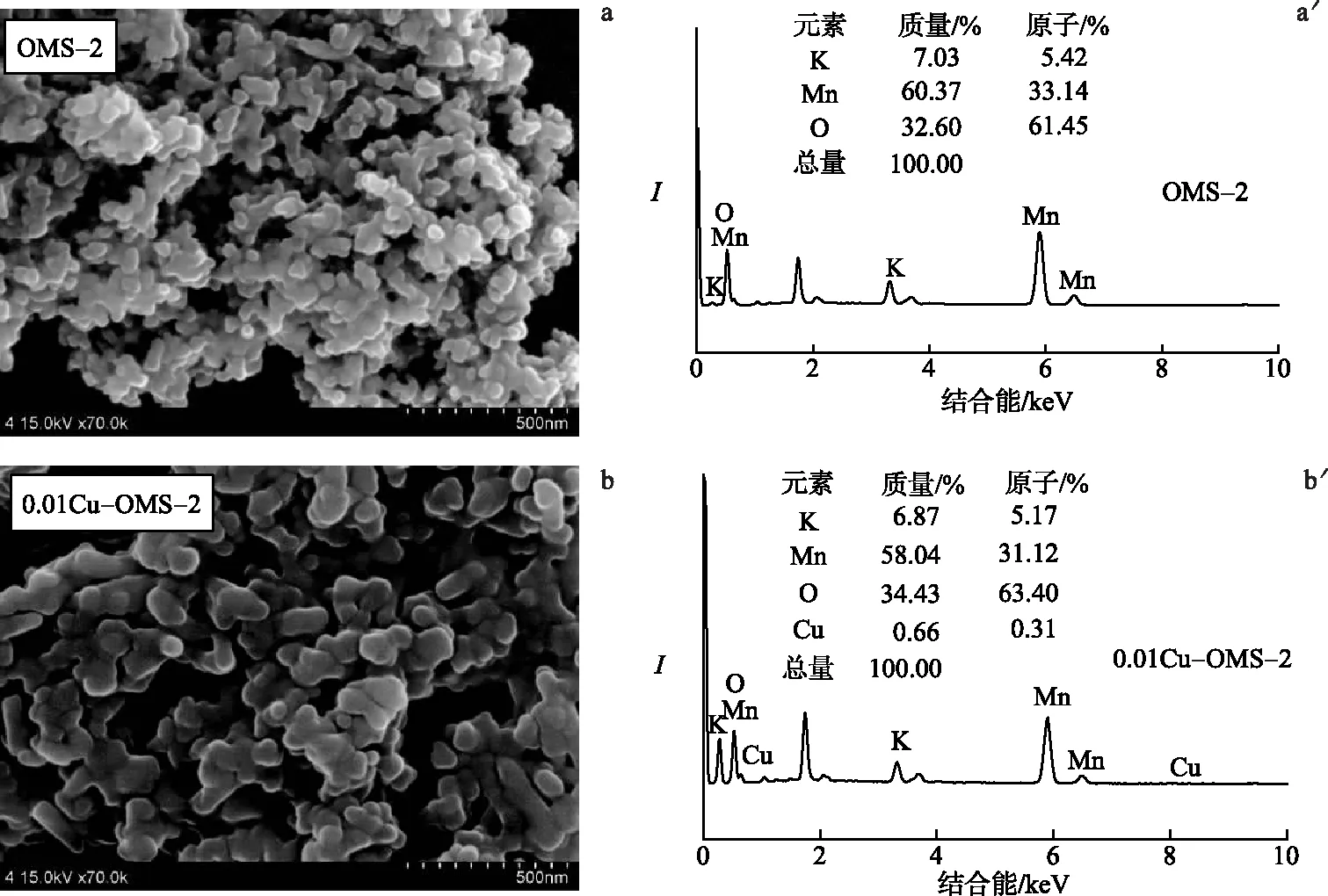
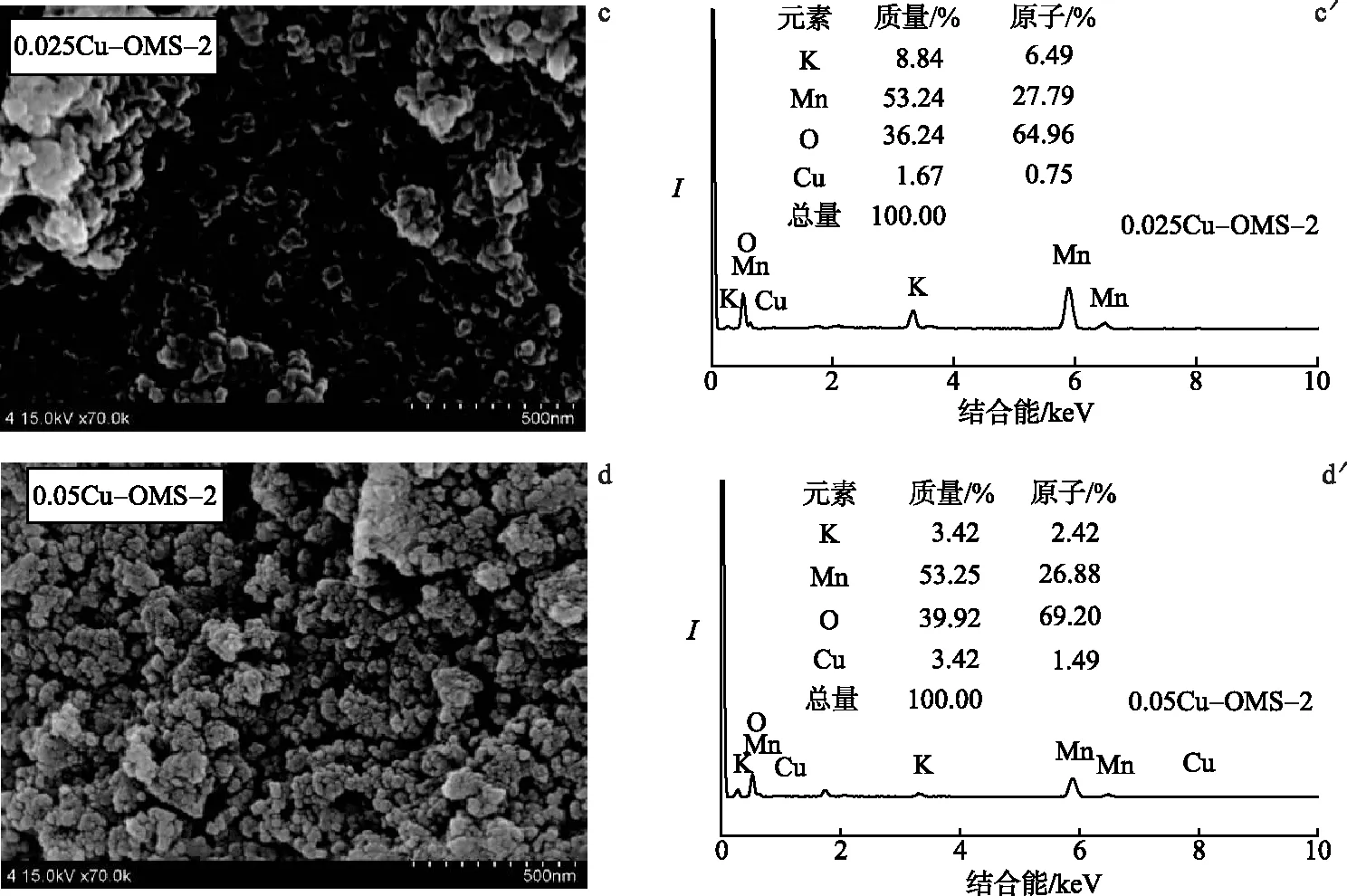
图3 xCu-OMS-2和OMS-2的SEM(左)和EDX(右)谱图Fig.3 SEM(Left) and EDX(Right) Profiles of xCu-OMS-2 and OMS-2 Catalysts
FT-IR测试结果如图4a所示,706,587,528,471 cm-1处的峰为OMS-2中[MnO6]八面体的Mn—O晶格振动峰,0.01Cu-OMS-2谱图中也可以观察到这些特征峰.然而,0.025Cu-OMS-2的Mn—O键强度较OMS-2明显减弱,说明铜氧化物的掺杂影响了催化剂的结构.图4b为催化剂的Raman光谱图,其中187 cm-1处的峰为Mn—O—Mn的变形振动;581,629 cm-1处的峰为Mn—O的晶格伸缩振动,同时也是2×2隧道的标志[22];503 cm-1处的峰为[MnO6]八面体的Mn—O弯曲振动[24].0.025Cu-OMS-2的Raman特征峰较OMS-2减弱,同时在581 cm-1的峰发生了位移.根据胡克定律计算,该催化剂Mn—O键的力常数减弱,容易产生晶格畸变,使氧物种更容易脱出.
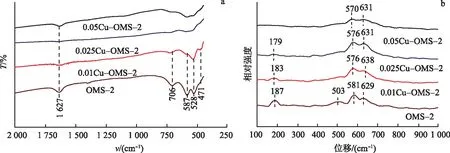
图4 xCu-OMS-2和OMS-2的FT-IR谱图(a)和Raman谱图(b)Fig.4 FT-IR(a) and Raman(b) Spectra of xCu-OMS-2 and OMS-2
图5给出了EPR测试的结果,显示0.025Cu-OMS-2在g=2.007处出现了强的对称的EPR信号峰.催化剂所产生的信号是由氧空位产生的未配对电子被捕捉到而形成,信号强度反映了氧空位的浓度,信号越强,说明催化剂的氧空位含量越多[3].而0.01Cu-OMS-2的信号与OMS-2几乎一致,并未有很明显的EPR信号峰,0.05Cu-OMS-2的信号强度也较0.025Cu-OMS-2的弱,说明0.025Cu-OMS-2的氧空位含量最多.进一步说明了0.025Cu-OMS-2的催化剂的活性较其余几种催化剂的活性高.
2.3 催化剂的性能测试
图6为催化剂的H2-TPR谱图.以H2为探针,测试催化剂的氧化能力.OMS-2在300 ℃附近有2个还原峰,分别归属于MnO2-Mn3O4和Mn3O4-MnO的耗氢峰.而0.025Cu-OMS-2只有1个还原峰,同时还原峰温度较OMS-2降低了38 ℃,说明铜氧化物的引入使催化剂的晶格氧流动性增强,锰氧化物直接被还原为MnO.同样,0.01Cu-OMS-2也只有1个还原峰,还原峰温度降低的较少(31 ℃),而0.05Cu-OMS-2谱图中出现了2个还原峰,说明H2不能将它一步还原.结果表明,0.025Cu-OMS-2的氧化能力增强.
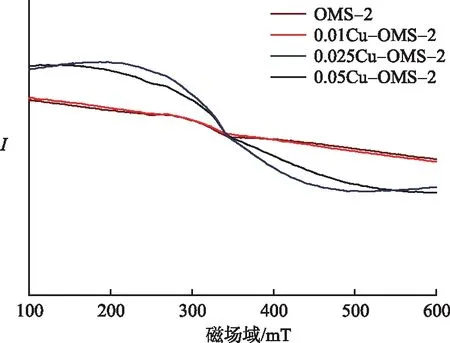
图5 xCu-OMS-2和OMS-2的EPR谱图Fig.5 EPR Spectra of xCu-OMS-2 and OMS-2
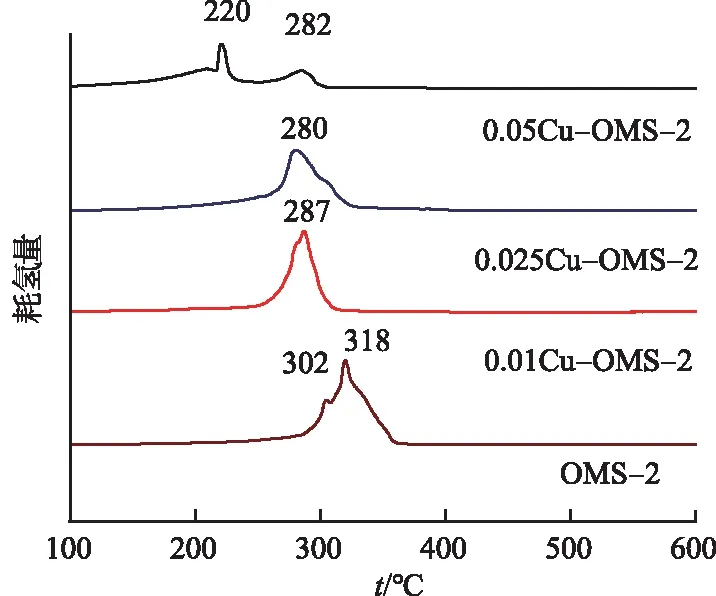
图6 xCu-OMS-2和OMS-2的H2-TPR谱图Fig.6 H2-TPR Spectra of xCu-OMS-2 and OMS-2
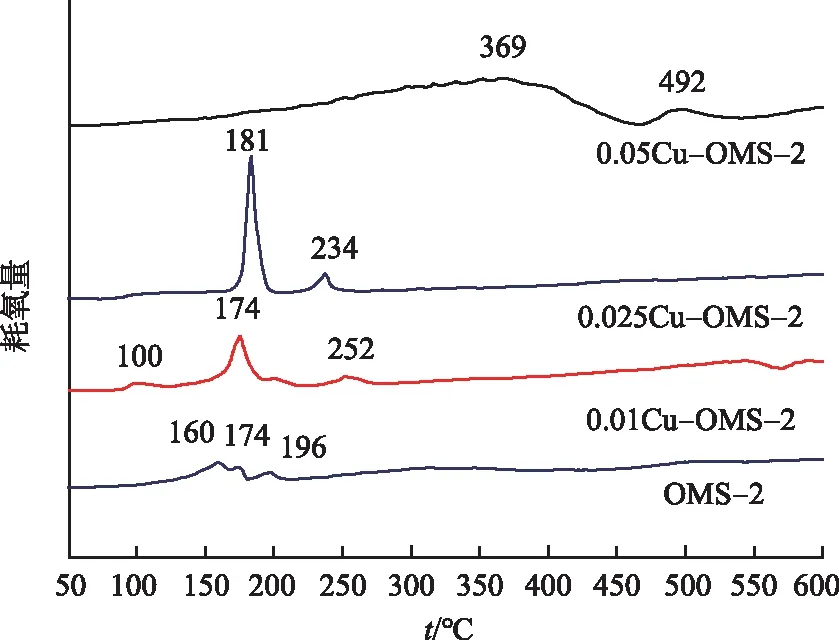
图7 xCu-OMS-2和OMS-2的TPR-TPO测试结果Fig.7 TPR-TPO Profiles of xCu-OMS-2 and OMS-2
为了测试催化剂中的分子氧的插入能力,进行了TPR-TPO测试,结果如图7所示.OMS-2分别在160,174,196 ℃有3个弱峰,说明还原后的OMS-2分3步被氧化为MnO2.值得注意的是,0.025Cu-OMS-2只有1个主要氧化峰,其氧化峰温度在181 ℃,且峰面积较OMS-2和0.01Cu-OMS-2的大.而0.05Cu-OMS-2的氧化峰的温度明显高移,峰强度明显减弱.结果表明,0.025Cu-OMS-2比其他催化剂有更强的再氧化能力.过量的铜掺杂到OMS-2中,会抑制氧的交换能力,使得催化剂很难实现氧的循环,从而使催化剂的活性减弱.
3 结 论
采用同步氧化还原法制备了0.025Cu-OMS-2催化剂,得到较高的催化活性.通过活性测试发现,0.025 Cu-OMS-2催化剂的T100,T50,T20分别比OMS-2降低了20,13,12 ℃.XRD和SEM的表征结果显示,当Cu/Mn原子比为0.025时,所得的催化剂是微晶态结构,铜氧化物高度分散到了OMS-2的晶格中.由FT-IR和Raman谱图发现,0.025Cu-OMS-2的Mn—O键强度明显减弱,说明铜氧化物的掺杂影响了OMS-2的结构,产生了结构缺陷.通过EPR发现,0.025Cu-OMS-2催化剂的EPR信号最强.根据H2-TPR和TPR-TPO谱图可知,0.025Cu-OMS-2的还原峰温度降低,再氧化峰温度低且峰面积较大,说明该催化剂的氧空位含量最多,且晶格氧的流动性最强,氧的交换能力最强.通过结构和性能表征发现,少量的铜掺杂对催化剂的活性并未起到显著作用.但0.05Cu-OMS-2的活性明显降低,推测原因可能是过量的铜进入了催化剂的隧道中,代替了隧道中的K+,使催化剂活性降低.

