低氧条件下巨噬细胞分泌CCL22促进三阴乳腺癌转移
陈 敏, 胡绍勇, 何成思, 邹争志*
(1. 广州医科大学附属第四医院影像科, 广州 511300; 2. 南方医科大学第三附属医院影像科, 广州 510630; 3. 华南师范大学生物光子学研究院激光生命科学研究所暨激光生命科学教育部重点实验室, 广州 510631)
乳腺癌是女性中最常见的恶性肿瘤,其死亡率和发病率每年持续上升,近年来已上升至女性肿瘤中的第一位。诱发乳腺癌发生发展的原因很多,有遗传因素、环境因素、原癌基因和抑癌基因的突变等,其中环境因素可能是乳腺癌发病率上升的重要因素。根据癌组织免疫组织化学检查结果,乳腺癌分为4种临床病理亚型:Luminal-A型、Luminal-B型、三阴乳腺癌 (Triple Negative Breast Cancer,TNBC)和Her-2型,其中Her-2型又分为HR阴性型和HR阳性型。TNBC是指雌激素受体(ER)、孕激素受体(PR)和Her-2均为阴性的乳腺癌,占所有乳腺癌病理类型的10%~20.8%,具有特殊的病理特征,表现为高侵袭和远处转移性、预后较差、5年复发率较高、病人整体5年生存率较低。然而,与Luminal型肿瘤相比较,其对化疗药更敏感。因此,临床上常联合手术或放疗联合化疗药物治疗TNBC。
乳腺癌发生远处转移是导致病人死亡的一个重要原因,因此,针对肿瘤转移的干预治疗能显著提高乳腺癌患者的生存时间。TNBC在临床上的表现多为远处肺转移和脑转移。TNBC发生转移的因素十分复杂,有肿瘤细胞内在的因素,也有肿瘤细胞周围微环境的因素,甚至远处靶器官的微环境也是重要的因素。肿瘤细胞内在的因素主要包括促肿瘤转移相关基因的激活和抑肿瘤转移相关基因的失活,如BRAC1/2基因突变激活和TP53基因失活。肿瘤细胞周围微环境的成分主要包括肿瘤细胞周围免疫细胞(如巨噬细胞)、肿瘤相关成纤维细胞以及细胞因子,这些因素对肿瘤细胞迁移、侵袭及凋亡有重要的影响[1-2]。肿瘤细胞能否在远处靶器官驻留增殖完全依赖于靶器官提供的生长因子微环境。已有研究表明乳腺癌微环境中巨噬细胞通过分泌CCL18促进TNBC细胞转移[3-4]。实体肿瘤中由于微小血管的缺陷不能提供足够的氧分子,因而表现为低氧的微环境。已有研究发现低氧微环境能够促进肿瘤细胞发生转移[5],然而低氧微环境对TAM的促肿瘤转移功能是否存在潜在影响,目前尚未见研究报导。本研究旨在探讨肿瘤相关巨噬细胞(Tumor-Associated Macrophages,TAM)在低氧环境下对TNBC细胞转移能力的影响,以期为临床TNBC转移的干预治疗提供新的理论依据。
1 材料与方法
1.1 试剂
佛波醇12-十四酸酯13-乙酸酯(Phorbol 12-myristate 13-aceteat,PMA)购自Sigma公司,货号:P1585,细胞培养液的质量浓度:20 ng/mL;DAPI和DMSO购自Sigma公司;胰蛋白酶消化液购自Thermo Scientific公司;CCL18试剂盒购自R&D Systems公司;IL-10试剂盒购自eBiosciences公司;CCL17和CCL22试剂盒购自Ray Biotech公司,TRIzolTM试剂购自Thermo Fisher公司,RT-PCR试剂盒购自Thermo Fisher公司。
1.2 细胞培养
三阴乳腺癌细胞MDA-MB-231和BT-549(购自ATCC)置于含φ=10%的胎牛血清(Gbico)的DMEM培养基中,人源单核细胞THP-1(购自中科院上海细胞库)置于含φ=10%的胎牛血清的1640培养基中。常氧培养条件为:37 ℃、φ=5%的CO2、饱和湿度的细胞培养箱;低氧培养条件为:置于37 ℃恒温箱内,持续通入V(N2)∶V(CO2)∶V(O2)=94∶5∶1的混合气体,维持饱和湿度;所有细胞经检测无支原体污染。
1.3 THP-1诱导分化为巨噬细胞
将1×106个THP-1接种于6孔板,每孔添加PMA,使其终质量浓度为20 ng/mL,培养72 h后去除未贴壁细胞,贴壁细胞即为M0巨噬细胞。
1.4 Transwell法检测肿瘤细胞迁移
对数生长期乳腺癌细胞经过巨噬细胞条件培养液培养48 h,然后经胰酶消化,用无血清RMPI-1640培养液按照每孔200 μL细胞悬液含10 000个细胞的密度接种于Transwell上室。下室为500 μL肿瘤细胞的生长培养液。置于培养箱培养18 h后,取上室于φ=75%的酒精中固定20 min,经过PBS清洗3次,用棉签搽除小室内侧细胞,最后经过10 μg/mL的DAPI染色后,在显微镜下观察并统计迁移的细胞数量。
1.5 RT-PCR检测
对数生长期MDA-MB-231细胞经过巨噬细胞条件培养液培养48 h后,用TRIzolTM试剂提取总RNA,用SuperScript IV 一步法RT-PCR试剂盒逆转录成cDNA,然后完成RT-PCR检测。检测基因引物如下:E-cadherin:5-TTGCTACTGGAACAGGGACA-3(正向),5-GTATTGGGAGGAAGGTCTGC-3(反向);Vimentin:5-GAAGAGAACTTTGCCGTTGA-3(正向),5-CGAAGGTGACGAGCCATT-3(反向);SNAIL1:5-TTACCTTCCAGCAGCCCTAC-3(正向),5-GACAGAGTCCCAGATGAGCA-3(反向);内参基因:GAPDH 5-AGGTCGGTGTGAACGGATTTG-3(正向),5-GTAGACCATGTAGTTGAGGTCA-3(反向)。
1.6 肿瘤转移CT扫描
THP1诱导而来的TAM,经过低氧培养后,收集TAM条件培养液处理MDA-MB-231细胞48 h。MDA-MB-231细胞经过胰酶消化后,用无血清RMPI-1640培养液按照100 μL含100 000个细胞的密度,经过尾静脉注射移植于裸鼠体内。裸鼠经过饲养45 d后,通过CT扫描拍照。CT仪器为东芝64排多层螺旋CT,型号:TSX-101A。扫描方法:将小鼠固定四肢放置在CT扫描床中间,扫描范围从小鼠头部至小鼠尾部,包完整只小鼠。扫描完成后,以横断位肺窗及软组织窗为主参数,重建工作站, 用1 mm薄层重建出全胸图片后选取图像,统计转移灶。
1.7 ELISA法检测细胞因子浓度
将TAM条件培养液按一定比例稀释。在对应96孔的ELISA板的每个孔中加入100 μL上述条件培养液,置于4 ℃冰箱过夜。倒空液体,用纸巾吸干表面,并拍干残留液体,用300 μL洗涤液清洗2次。然后加300 μL封闭液于每个孔中,室温孵育1 h,倒掉残余液体(方法同上)。每个孔中加100 μL羊抗小鼠二抗,室温孵育1 h,倒掉残余液体(方法同上)。每个孔中加满洗涤液,倒空液体并拍干残留液体,重复3次。用洗涤液浸泡5 min,拍干残留液体,每个孔中加100 μL底物,显色30 min后,立即在酶标仪(Tecan)上检测,波长为405~410 nm。
1.8 分析乳腺癌组织CCR4表达
通过在线软件TCGA(https:∥www.aclbi.com/static/index.html#/tcga),分析数据库中乳腺癌组织和癌旁正常组织CCR4的表达。
1.9 统计学分析

2 结果与分析
2.1 巨噬细胞在低氧条件下促进三阴乳腺癌细胞迁移
为了评估低氧是否激活了TAM的促三阴乳腺癌细胞的转移功能,本研究选取了BT-549细胞和MDA-MB-231细胞进行迁移实验。首先,分别收集M0巨噬细胞、TAM和低氧培养的TAM的条件培养液(Condition Media,CM);然后,用以上收集的3种CM处理BT-549细胞和MDA-MB-231细胞48 h后完成迁移实验。结果(图1)表明:相对于M0巨噬细胞CM处理的TNBC细胞,经过TAM的CM处理的TNBC细胞具有更强的迁移能力;与正常培养的TAM相比,低氧培养的TAM进一步促进了肿瘤细胞迁移,且差异具有统计学意义(P<0.01)。
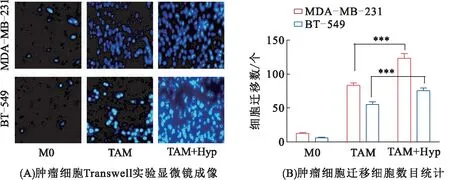
图1 3种CM处理的三阴乳腺癌细胞Transwell实验
上皮-间质转化(Epithelial-mesenchymal Transition,EMT)是肿瘤发生转移过程中的一个重要特征。为了进一步验证肿瘤细胞的转移能力,通过RT-PCR检测了EMT标志物基因(E-cadherin、ZEB1、SNAIL1)的mRNA表达水平。结果(图2)表明:相对于常氧培养的肿瘤相关巨噬细胞,低氧处理的肿瘤相关巨噬细胞更能显著地诱导MDA-MB-231细胞的EMT转化,表现为上皮型标志基因E-cadherin表达下降和间质型标志基因ZEB1、SNAIL1表达上升。

图2 RT-PCR检测3种CM处理的MDA-MB-231细胞迁移相关基因表达
2.2 巨噬细胞促进三阴乳腺癌细胞肺转移
以上体外实验表明TAM在低氧条件下能够促进TNBC细胞迁移,接下来探讨低氧培养的TAM是否能够促进TNBC在体内的转移。MDA-MB-231细胞分别经过TAM的CM和低氧培养的TAM的CM处理72 h后,经尾静脉注入裸鼠体内。饲养4周后,经过CT扫描观察肺部。结果(图3)表明低氧处理的TAM显著诱导了MDA-MB-231细胞的肺转移:低氧处理的TAM诱导肿瘤细胞在肺部的肿瘤转移灶数目显著高于常氧培养的TAM。

图3 CT扫描检测三阴乳腺癌细胞肺转移灶
2.3 低氧诱导巨噬细胞分泌CCL22
已有研究[6]报导TAM能分泌CCL18、CCL17、CCL22和IL-10等促肿瘤转移因子。因此,本研究通过ELISA实验,将CCL18、CCL17、CCL22和IL-10因子分别在低氧、常氧培养的TAM条件培养液中进行检测,以探讨低氧是否刺激TAM表达这4种转移因子。检测结果(图4)表明CCL22可能是低氧TAM刺激TNBC转移的重要因子:CCL18在TAM中表达最高,而CCL22和IL-10表达相对较低;低氧能够显著刺激CCL22表达的上升,而对其他3个细胞因子表达无显著影响。
2.4 CCL22促进三阴乳腺癌迁移
为了进一步证明CCL22是否促进了TNBC的转移,TNBC细胞MDA-MB-231和BT-549经0、5、10 ng/mL的CCL22处理48 h,然后进行Transwell实验。结果(图5)显示:5、10 ng/mL的CCL22能够显著地促进MDA-MB-231、BT-549细胞的迁移。

图4 通过ELISA方法检测巨噬细胞分泌细胞因子的质量浓度

图5 不同质量浓度的CCL22诱导的三阴乳腺癌细胞Transwell实验
2.5 CCR4介导低氧条件下巨噬细胞促进三阴乳腺癌细胞迁移
已有报道[6]表明CCL22通过与其受体CCR4结合来激活细胞的下游信号,从而促进细胞的运动与迁移。接下来,本研究探讨CCR4基因是否在肿瘤细胞中存在高表达,从而促进TNBC细胞的迁移。通过TCGA在线数据库分析CCR1至CCR5基因的表达,结果(表1)表明CCL22与CCR4的结合在促进乳腺癌转移中起了重要作用:相对于正常组织,CCR3、CCR4和CCR5在肿瘤组织中表达显著升高,其中,CCR4升高最显著。

表1 CCR家族基因在乳腺癌组织与正常组织中表达的差异与比值Table 1 The expression and ratio of CCR family members in breast cancer tissue and normal tissue
3 讨论
TNBC占乳腺癌病例的10%~20%。由于雌激素受体、孕激素受体和Her-2均为阴性,目前缺乏特异性针对TNBC的抗激素疗法。目前,除了传统的化疗外,仅有少数的靶向治疗方法应用于临床的TNBC治疗。TNBC是高转移性的乳腺癌,其转移机制十分复杂。已有研究发现,TNBC的高转移与肿瘤细胞自身癌基因信号通路的激活及抑癌基因信号通路的失活有关,如:PI3K/AKT和WNT/β-catenin信号通路的激活[7-8]。尽管已有针对这些信号通路的靶向抑制剂,然而并没有在临床上应用。实体肿瘤常处于缺氧环境,有研究发现缺氧能够诱导肿瘤细胞发生转移[9],机制研究表明缺氧激活了HIFα信号通路,从而促进了肿瘤细胞的迁移能力[10]。肿瘤微环境存在大量的免疫细胞,其中TAM与乳腺癌细胞的转移密切相关。目前的观点认为,TAM主要分为M1型和M2型,其中M1型主要起抗肿瘤作用,而M2型起促肿瘤作用[11]。 如:邹争志等[12]发现M2型TAM能够增强宫颈癌对化疗药的抵抗,证明了M2型TAM具有促肿瘤发展的作用;在乳腺癌的研究中,CHEN等[3]发现TNBC细胞促进TAM转化成M2型,M2型TAM通过分泌CCL18反过来促进TNBC细胞的转移;TU等[13]发现M2型TAM分泌IRF7调节因子和促进miR-1587在乳腺癌细胞中的表达,从而诱导乳腺癌细胞转移;ALLEN等[14]发现TAM通过激活炎性乳腺癌细胞RhoC-GTPase信号通路来促进癌细胞转移。本研究发现TAM能够显著促进TNBC细胞的转移,该研究结果与已有研究结果[13]是一致的。更重要的是,本研究发现低氧能够更进一步地增强TAM促进乳腺癌细胞转移的能力。
尽管有一些研究报道低氧能直接促进肿瘤细胞的转移[15]、TAM增强了TNBC细胞的转移潜能[16]。然而,关于TAM在低氧状态下的促肿瘤转移能力是否增强尚未见文献报道。本研究通过小鼠体内实验和体外细胞实验,证明了缺氧能够激活TAM的促肿瘤转移功能。机制上的研究[17]也表明:低氧刺激了TAM细胞CCL22表达的上调,CCL22通过分泌到肿瘤微环境来促进TNBC细胞的迁移;CCL22是一个促肿瘤转移的重要趋化因子,其表达受到多个信号通路的调节;IL4和IL13通过激活STAT3信号通路来促进CCL22的表达,而IFN-γ抑制CCL22的表达。本研究指出低氧促进巨噬细胞表达CCL22,这意味着低氧有可能激活了促进CCL22表达的信号通路,或抑制了下调CCL22表达的信号通路。低氧是否激活IL4和IL13信号或抑制IFN-γ信号,需要进一步的研究。有研究[18]报道低氧能够激活STAT3,STAT3进一步上调HIFα的表达。HIFα作为一个转录因子能够调节许多基因的表达,然而至今尚未有研究报道HIFα调节CCL22的表达。本研究通过TCGA在线数据库分析CCR家族基因在乳腺癌中的表达,发现相对于正常组织,CCR4在乳腺癌组织表达升高最显著。CCR家族下游存在许多与肿瘤转移相关的信号通路,如PKC、JNK、AKT、MAPK等信号通路[19]。CCL22通过激活CCR4来促进TNBC转移是否与上面这几条信号通路有关,在本研究中并没有阐明清楚,需要进一步的验证。
4 结论
本研究发现TAM在低氧条件下促进三阴乳腺癌细胞迁移,并进一步在小鼠体内模型中验证了TAM促进三阴乳腺癌细胞肺转移。通过机制研究,发现低氧诱导巨噬细胞分泌CCL22,CCL22在促进三阴乳腺癌迁移中起了重要作用;通过TCGA在线数据库,进一步证明CCL22受体CCR4和肿瘤的发展密切相关。

