安石榴苷与焦磷酸钠对肌原纤维蛋白氧化稳定性及凝胶性能的影响
韩馨蕊,李 颖,刘苗苗,范 鑫,冯 莉,曹云刚*
(陕西科技大学食品与生物工程学院,陕西 西安 710021)
肉及肉制品中含有丰富的蛋白质、脂肪、维生素、矿物质等营养成分,是人体摄入能量和营养的重要来源,深受大众喜爱[1]。肉蛋白,尤其是肌原纤维蛋白(myofibrillar protein,MP),能够形成热诱导凝胶,从而赋予肉类制品良好的质地和口感[2]。然而由于宰后肌肉体系中抗氧化系统的崩溃以及铁离子等过渡金属离子的存在等,肉蛋白在加工及贮藏过程中极易受到自由基或非自由基攻击而发生氧化,主要表现为蛋白溶解性和凝胶性等劣变,最终影响肉制品的品质[3-5]。因此有效抑制肉蛋白氧化或提高氧化损伤肉蛋白的凝胶性能具有重要的理论意义与应用价值。
近年来,天然植物源抗氧化剂由于具有来源广泛、种类多、安全性高等优点,在肉制品中的应用逐渐引起肉品企业和科研工作者的关注。诸如迷迭香提取物[6]、花椒叶提取物[7]和茶多酚等多种天然抗氧化剂已被证明可以在一定程度上抑制蛋白氧化、提高肉品品质。此外,多酚类物质在富含蛋白的体系中还可以通过共价和非共价反应与蛋白的官能团相互作用,从而影响蛋白质的交联聚集和凝胶性能[8]。安石榴苷是石榴皮中的重要活性成分,具有抗氧化、抗菌、抗病毒、抗炎等多种生理功效,在医疗、保健和功能性食品等领域具有良好的应用前景[9],但安石榴苷作为天然抗氧化剂对肉蛋白氧化稳定性及凝胶性能的影响尚鲜见报道。
多聚磷酸盐是肉制品加工中应用最广泛的一种食品改良剂,可以引起活性氨基酸残基及蛋白质构象发生变化,促进加工过程中MP的凝胶化作用[10]。肉制品加工过程中允许使用的多聚磷酸盐主要有焦磷酸钠(sodium pyrophosphate,SPP)、三聚磷酸钠(sodium tripolyphosphate,STPP)和六偏磷酸钠等[11]。SPP是ATP的结构类似物,当适宜浓度(生理水平)Mg2+存在时,PP可以与肌球蛋白头部S1结合,引起肌动球蛋白解离[10],在肉制品加工中应用最为广泛。SPP提高肉制品保水性的作用机制主要包括提高pH值、提高离子强度、螯合金属离子、解离肌动球蛋白[10]。可见,SPP除具有提高肉制品保水性的功能外,还具有优良的金属离子螯合能力,因而也具有一定的抗氧化性能[12]。然而目前关于SPP作为抗氧化剂对肉蛋白氧化稳定性的影响以及SPP作为品质改良剂对氧化损伤肉蛋白凝胶性能的影响等鲜有研究,安石榴苷与SPP复配对肉蛋白氧化稳定性和凝胶性能的影响研究尚未见报道。
因此,本实验以MP为研究对象,在羟自由基氧化体系下探究安石榴苷(自由基清除剂)和SPP(金属离子螯合剂和保水剂)对MP氨基酸侧链基团、构象、凝胶行为和凝胶微观结构的影响,以期为天然抗氧化剂在肉制品中的科学合理应用提供一定的理论依据和参考。
1 材料与方法
1.1 材料与试剂
猪背最长肌购于当地大型超市,置于冰盒运回实验室,剔除可见脂肪及结缔组织,分装,每袋约100 g,于-18 ℃冷冻贮藏备用。
安石榴苷(纯度>95%,CAS:65995-63-3)成都普思生物科技股份有限公司;水溶性VE(Trolox)、2,4,6-三硝基苯磺酸 美国Ark Pharm公司;哌嗪-1,4-二乙磺酸(piperazine-1,4-bisethanesulfonic acid,PIPES)、2,4-二硝基苯肼 生工生物工程(上海)股份有限公司;三氯乙酸、石油醚、抗坏血酸、盐酸胍 天津科密欧化学试剂有限公司;所用试剂均为分析纯。
1.2 仪器与设备
HR/T20M立式冷冻离心机 湖南赫西仪器装备有限公司;PHS-25数显pH计 上海仪电科学仪器股份有限公司;CM-5分光测色计 柯尼卡-美能达(中国)投资有限公司;UV2900紫外-可见分光光度计 上海舜宇恒平科学仪器有限公司;TA.XT Plus物性测试仪 英国Stable Micro System公司;Haake mars 60型流变仪 美国赛默飞世尔科技公司;Chirascan-plus 101圆二色光谱仪 英国Applied Photophysics公司;Mastersizer 2000激光粒度分析仪 英国马尔文仪器公司;FEI Q45+EDAX Octane Prime型扫描电子显微镜 美国FEI公司;Spectrofluorometer FS5荧光光谱仪 英国爱丁堡公司。
1.3 方法
1.3.1 MP的提取
参照Cao Yungang等[12]的方法:将冷冻贮藏的备用肉流水解冻,切成小块置于组织捣碎机中,加入4 倍体积的僵直液(含0.1 mol/L NaCl、10 mmol/L磷酸钠、2 mmol/L MgCl2、1 mmol/L乙二醇双(2-氨基乙基醚)四乙酸,pH 7.0),低速档搅拌1 min后离心(4 ℃、1 500hg,15 min)取上清液,重复提取3次,所得沉淀加入4 倍体积0.1 mol/L NaCl溶液,搅拌均匀并经纱布过滤去除结缔组织,调节pH值至6.25,离心,所得沉淀即为MP。采用双缩脲法测定蛋白质量浓度。
1.3.2 MP的氧化处理
将MP膏用15 mmol/L PIPES缓冲液(含0.6 mol/L NaCl,pH 6.25)稀释至所需质量浓度,分别加入新鲜配置的安石榴苷(记作P)、SPP及二者组合(P+SPP)溶液,搅拌均匀后在4 ℃下于Fenton氧化体系(10 μmol/L FeCl3、100 μmol/L抗坏血酸、3 mmol/L H2O2)氧化12 h,添加Trolox终止氧化反应。最终体系蛋白质量浓度为30 mg/mL,安石榴苷添加量为50 mg/kg,SPP浓度为2 mmol/L(添加0.2 mmol/L MgCl2辅助SPP发挥作用)。同时制备未添加抗氧化剂的未氧化(Control)和氧化(Ox)对照组。
1.3.3 MP的化学和结构变化分析
1.3.3.1 氨基酸侧链修饰
羰基含量的测定:参照李保玲等[13]的方法,采用2,4-二硝基苯肼法测定蛋白羰基含量,结果以每毫克蛋白所含羰基含量表示,单位nmol/mg。
总巯基含量的测定:参照李颖等[14]的方法,将MP用PIPES缓冲液稀释至2 mg/mL,用5,5’-二硫代双(2-硝基苯甲酸)(5,5’-dithiobis-(2-nitrobenzoic acid),DTNB)法测定蛋白总巯基含量,结果以每毫克蛋白所含巯基含量表示,单位nmol/mg。
自由氨基含量的测定:参照Benjakul等[15]的方法测定蛋白自由氨基含量,并以L-亮氨酸作标准曲线(y=0.230 7x+0.005 8),样品中自由氨基含量通过标准曲线计算确定。
1.3.3.2 蛋白的构象变化
二级结构:参照曹云刚[16]的方法通过圆二色光谱仪分析蛋白的二级结构。各组蛋白溶液用PIPES缓冲液稀释至0.2 mg/mL,扫描范围为200~260 nm,并扣除溶剂背景。
三级结构:采用荧光光谱仪分析,各组蛋白溶液用PIPES缓冲液稀释至0.4 mg/mL,激发波长283 nm,发射光谱290~400 nm,激发和发射狭缝宽度均为3.50 nm,同样扣除溶剂背景[17]。
粒径测定:采用激光粒度分析仪测定,各组蛋白溶液(2 mg/mL)分散于蒸馏水中,添加样品时遮光度需达到10%~13%,以避免多次散射。设置MP颗粒折射率为1.570,分散剂折射率为1.330,吸收指数为0.001。
1.3.4 溶解度测定
参照Cao Yungang等[8]的方法,将各组蛋白溶液(30 mg/mL)用PIPES缓冲液稀释至2 mg/mL,于4 ℃、5 000hg条件下离心15 min,采用双缩脲法测定上清液中蛋白质量浓度,按式(1)计算蛋白溶解度:

1.3.5 MP的流变学行为表征
参照Li Chunqiang等[18]的方法,将各组蛋白溶液(30 mg/mL)于4 ℃、1 000hg条件下离心1 min去除气泡。在振荡模式下平衡3 min后,以1 ℃/min升温速率由20 ℃加热至80 ℃,振荡频率0.1 Hz,最大应力0.02,结果以弹性模量(G’)为评价指标进行分析。
1.3.6 MP的热诱导凝胶性能测定
1.3.6.1 热诱导凝胶制备
称取约5 g MP溶胶于制胶小瓶中,轻轻振荡均匀,盖好木塞,水浴加热,以1 ℃/min的升温速率由20 ℃加热至75 ℃后并保温10 min,将凝胶取出置于冰水浴冷却30 min,4 ℃冰箱过夜保存。凝胶性能的测定前蛋白凝胶需从冰箱取出平衡2 h。
1.3.6.2 蒸煮损失和凝胶白度测定
蒸煮损失:将蛋白凝胶与制胶小瓶的瓶壁分离,在滤纸上倒置20 min,待蒸煮汁液完全流尽后称质量。按式(2)计算蒸煮损失率:

凝胶白度:参照Xia Xiufang等[19]的方法,采用CM-5分光测色计经自检及零点、白板校正后,测定各组凝胶样品亮度值(L*)、红度值(a*)和黄度值(b*),并根据式(3)计算凝胶白度:
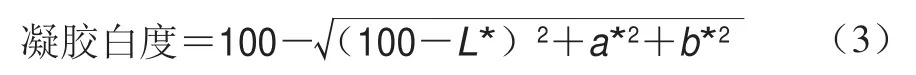
1.3.6.3 热诱导凝胶质构测定
参照王耀松等[20]的方法并稍作修改,采用物性测试仪测定各组蛋白凝胶的硬度、内聚性、弹性、咀嚼性、黏聚性。用不锈钢小铲轻轻将蛋白凝胶与制胶小瓶分离并取出,置于质构仪平板上进行质构测定。探头型号P/75,下压比30%,触发力10 g,测前速率2 mm/min,测中速率2 mm/min,测后速率50 mm/s。
1.3.6.4 凝胶的微观结构表征
参照Zhao Yinyun等[21]的方法并稍作修改,用小刀片将蛋白凝胶切成适宜大小,将样品用体积分数2.5%戊二醛溶液固定4 h后,用pH 7.4磷酸盐缓冲液清洗3次,然后依次用体积分数50%、70%、90%、95%、100%的乙醇浸泡30 min脱水,样品经冷冻干燥后喷金,用扫描电子显微镜观察凝胶样品微观结构。设置加速电压15 kV,放大倍数5 000。
1.4 数据处理与分析
所有实验均重复2~3次,每次重复3个平行。采用Microsoft Excel软件进行数据处理,采用Statistix 9软件进行差异显著性分析(P<0.05)和方差分析,采用Sigmaplot 12.5软件进行绘图。
2 结果与分析
2.1 不同处理对MP氨基酸侧链修饰程度的影响
2.1.1 蛋白羰基含量
蛋白质氨基酸侧链含有许多官能团,容易被氧化产生羰基化衍生物,所以羰基含量可作为评价蛋白氧化程度的重要指标[22]。如表1所示,Control组MP的羰基含量为1.54 nmol/mg,而氧化12 h后Ox组MP的羰基含量迅速升高至3.15 nmol/mg,安石榴苷和SPP的添加能有效抑制氧化导致的蛋白羰基含量上升,抑制效率均达35%,且二者复配效果更好。这可能是由于安石榴苷具有较强自由基清除能力[23],SPP具有良好的金属离子螯合能力[24],二者复配使用时可以更有效地抑制氧化反应。与本研究结果类似,相关研究发现SPP添加能有效抑制蛋白羰基的生成,SPP与儿茶素复合在抑制蛋白羰基生成方面具有协同作用[8]。但值得注意的是,植物多酚对蛋白羰基生成的影响与多酚种类、浓度及实验条件等有关[12]。

表1 不同处理对MP氨基酸侧链修饰的影响Table 1 Effects of different treatments on the modification of amino acid side chains of MP nmol/mg
2.1.2 总巯基含量
MP主要由肌球蛋白和肌动蛋白组成,这两种蛋白中均含有巯基且不含二硫键,其中肌球蛋白中巯基含量较高[19],巯基易遭受羟自由基攻击形成二硫键使蛋白质发生交联聚合反应。如表1所示,Control组MP的巯基含量为83.75 nmol/mg,而氧化12 h后Ox组MP的巯基含量降低至77.57 nmol/mg,添加安石榴苷和SPP在一定程度上抑制了巯基的损失,但效果并不显著(P>0.05)。这可能是由于一方面SPP可以螯合金属离子降低氧化反应的发生,但另一方面SPP可以促进肌动球蛋白解离、提高MP的溶解度,这提高了羟自由基攻击MP的几率[25];同时安石榴苷作为自由基清除剂可以抑制氧化反应,但是安石榴苷自身被氧化为半醌或醌类物质,后者又可以与蛋白巯基发生加成反应,导致巯基含量降低[26]。因而,本实验中抗氧化剂对蛋白巯基含量的影响是多种因素综合作用的结果。
2.1.3 自由氨基含量
蛋白质中赖氨酸侧链的ε-NH2基团易遭受自由基攻击,经脱氨基过程生成羰基,后者又可以与NH2发生共价结合,使自由氨基含量进一步降低[2]。如表1所示,Control组MP的自由氨基含量为98.83 nmol/mg,氧化12 h后,Ox组MP自由氨基含量降低至92.69 nmol/mg,降低了6.2%,安石榴苷和SPP的存在减缓了自由氨基含量的降低幅度,这与抑制蛋白羰基含量变化趋势相似。综合蛋白羰基、总巯基和自由氨基含量实验结果可知,安石榴苷和SPP的添加对于抑制氧化诱导的蛋白氨基酸侧链功能基团修饰具有积极作用,且二者具有一定协同抑制效果。
2.2 不同处理对MP构象的影响
2.2.1 蛋白二级结构变化
如图1所示,Control组MP的圆二色光谱曲线在222 nm处出现负峰,这是由于MP中肌球蛋白尾部含有大量的α-螺旋结构,Ox组MP在222 nm处峰值降低,说明α-螺旋结构遭到破坏,与此同时形成更多的β-折叠和无规卷曲结构[27]。添加安石榴苷和SPP进一步加剧了α-螺旋结构的损失,这可能是由于安石榴苷结构中含有大量羟基,会影响维持α-螺旋结构稳定氢键的稳定性[28],导致α-螺旋解旋;此外,Kang Juan等[28]研究发现绿原酸与大豆蛋白发生共价结合,导致蛋白α-螺旋结构降低、无规卷曲结构增加。因此安石榴苷氧化产物与MP中氨基酸侧链基团的共价结合也可能导致α-螺旋降低[29]。SPP的存在可以与肌球蛋白活性部位结合,使肌球蛋白空间结构发生变化,导致α-螺旋结构部分丧失[30]。

图1 不同处理对MP二级结构的影响Fig.1 Effects of different treatments on the secondary structures of MP
2.2.2 蛋白三级结构变化
蛋白内源性色氨酸荧光特性通常被用于反映蛋白质三级结构的变化[31]。如图2所示,Control组MP在最大发射波长处荧光强度可达436h104cps,Ox组氧化12 h的MP荧光强度为409h104cps,明显低于Control组,说明氧化导致MP结构展开。SPP和安石榴苷添加进一步导致MP内源性色氨酸荧光强度降低,这说明SPP和安石榴苷添加促进了氧化条件下MP结构的展开,且安石榴苷的效应更加明显,这可能与两种抗氧化剂对MP空间构象的影响有关。

图2 不同处理对MP内源性色氨酸荧光的影响Fig.2 Effects of different treatments on the intrinsic tryptophan fluorescence spectrum of MP
2.2.3 MP粒径变化
如图3所示,与Control组MP相比,氧化应激使MP的平均粒径增大10.2%(P<0.05),这是由于氧化导致蛋白结构展开,并促进蛋白发生交联聚集,导致其分子粒径增大。安石榴苷添加明显抑制了氧化导致的MP平均粒径增大,抑制率达10.50%,其粒径与Control组相当。添加SPP显著降低了氧化MP的平均粒径,较Ox组降低17.65%,这是由于SPP可以解离肌动球蛋白为肌球蛋白和肌动蛋白,降低了MP溶胶体系的平均粒径[32]。安石榴苷与SPP复配组的粒径与SPP组基本一致,说明SPP对MP粒径的影响更大。

图3 不同处理对MP平均粒径的影响Fig.3 Effects of different treatments on the mean particle size of MP
2.3 不同处理对MP溶解度的影响
如图4所示,Control组MP的溶解度为47.53%,Ox组氧化12 h的MP溶解度为39.18%,相比Control组蛋白溶解度显著降低(P<0.05)。这是由于氧化导致蛋白结构展开,蛋白质内部疏水基团和巯基暴露,增强了蛋白分子间疏水作用和二硫键交联,引起蛋白聚集,导致其溶解度降低[33]。安石榴苷的存在不能阻止氧化导致的蛋白溶解度降低;而SPP及P+SPP添加均显著提高了氧化MP的溶解度,较Ox组分别提高了9.78%和20.42%,这主要是由于SPP具有解离肌动球蛋白、提高离子强度等作用[27]。

图4 不同处理对MP溶解度的影响Fig.4 Effects of different treatments on the solubility of MP
2.4 不同处理对MP流变学性能的影响
如图5所示,Control组MP在约52 ℃出现峰值,主要是由于肌球蛋白头部S1的变性和聚集引起[29]。Ox组MP峰值略有上升,且加热至80 ℃G’明显升高,说明加热前氧化诱导的蛋白结构展开促使加热过程中肌球蛋白头部-头部和尾部-尾部之间的相互作用增强[34]。安石榴苷添加对氧化MP的G’曲线基本没有影响,而SPP添加显著改变了加热过程中MP的G’,表现为热转变峰彻底消失,整个加热过程中G’明显降低,这可能与SPP诱导的肌动球蛋白解离及MP氧化稳定性变化有关[8]。安石榴苷与SPP复配对氧化条件MPG’的影响与SPP单独添加几乎一致。Cao Yungang等[12]研究发现绿原酸添加对氧化条件下MP流变特性的影响与其浓度密切相关,低浓度下绿原酸促进了G’的上升,而高浓度则会严重破坏MP的凝胶性能。贾娜等[35]研究发现没食子酸引起MPG’降低,认为这是由于多酚类物质与蛋白形成巯-醌结合物,封锁了巯基进而抑制蛋白分子间二硫键的生成。Cao Yungang等[12]发现SPP添加会显著改变MP的流变曲线(热转变峰消失)但会促进75 ℃时G’的升高。综上所述,植物多酚及多聚磷酸盐对氧化条件下MP流变行为的影响可能与多重因素有关。

图5 不同处理对MP G’的影响Fig.5 Effects of different treatments on the rheological properties (G’) of MP
2.5 不同处理对MP热诱导凝胶性能的影响
如表2所示,Control组MP的蒸煮损失为12.35%,而氧化12 h后MP的蒸煮损失升高至19.90%。抗氧化剂添加显著抑制了氧化诱导的凝胶蒸煮损失增大,与Ox组相比,安石榴苷、SPP及其组合处理组的蒸煮损失率分别下降了28.99%、42.56%及54.37%。这可能是由于:一方面,安石榴苷在一定程度上抑制了蛋白氧化,且自身含有多羟基结构,具有很好的亲水能力[26];另一方面,SPP不仅可以抑制氧化诱导的蛋白质氨基酸侧链修饰,而且可以引起肌动球蛋白解离、提高体系内离子强度,并通过影响分子的静电荷效应,增强水合作用,使蛋白质网络结构更加稳定,提高MP的持水性,从而降低蒸煮损失。类似地,叶浪等[36]发现STPP能明显降低猪MP热诱导成胶时的蒸煮损失率;Cao Yungang等[12]研究发现在氧化条件下SPP添加降低了MP热诱导凝胶的蒸煮损失、提高了其凝胶强度。相比Control组,氧化导致MP凝胶白度下降1.96%。SPP的添加对氧化后MP的凝胶白度无显著改善。添加安石榴苷组使氧化后MP的凝胶白度显著降低(P<0.05),这可能是由安石榴苷本身具有的颜色(黄色)所致。
如表2所示,与Control组相比,氧化后蛋白的质构性能变差,表现为硬度、内聚性、弹性、咀嚼性、黏性均降低,其中硬度降低了18.06%。这可能是由于氧化会导致蛋白表面疏水性增强、溶解度降低,使参与成胶的蛋白含量减少[37],从而导致MP的凝胶强度降低。安石榴苷添加明显改善了氧化诱导的蛋白凝胶质构性能的劣变,其MP凝胶的内聚性、弹性和咀嚼性恢复至Control组的水平,与Ox组相比,凝胶硬度和黏性分别提高了7.92%和13.92%。而SPP的添加显著降低了凝胶的硬度、内聚性、弹性、咀嚼性和黏聚性。与本研究结果类似,张典等[38]研究发现SPP和STPP处理降低了肌球蛋白热诱导凝胶的强度。与之相反,其他研究发现焦磷酸盐添加提高了肉蛋白的凝胶强度[8,10]。可见多聚磷酸盐对肉蛋白凝胶性能的影响复杂,受肌肉类型、磷酸盐种类及浓度、体系离子强度及pH值等多种因素的影响。

表2 不同处理对MP凝胶性能的影响Table 2 Effects of different treatments on the heat-induced gel properties of MP
2.6 不同处理对MP热诱导凝胶微观结构特征的影响
如图5所示,Control组蛋白凝胶呈连续致密的网状结构,且形状较规则、分布较均匀。氧化后的MP凝胶微观结构粗糙疏松、不规则,这是由于氧化导致加热前MP蛋白间交联聚集、分子粒径增大、溶解度降低,致使热诱导成胶过程中蛋白展开速率低于交联速率,参与蛋白交联的活性基团不能有序结合。安石榴苷添加能够在一定程度上改善氧化诱导造成的凝胶微观结构。添加SPP可以使蛋白凝胶结构较为均匀、光滑,可能是由于SPP降低了MP平均粒径、提高了蛋白溶解度。安石榴苷与SPP复合组凝胶的微观结构更加细腻,这可能与二者复配在抑制蛋白氧化方面具有协同效应有关。

图6 不同处理对MP热诱导凝胶微观结构特征的影响Fig.6 Effects of different treatments on the microstructure characteristics of heat-induced MP gels
3 结 论
安石榴苷、SPP及其组合P+SPP均可以有效抑制羟自由基诱导的蛋白羰基生成和自由氨基含量降低,且安石榴苷与SPP组合效果最好。但这些抗氧化剂添加均无法抑制氧化诱导的巯基含量降低及蛋白结构展开,相反在一定程度上促进了蛋白结构的展开。添加安石榴苷在一定程度上改善了氧化诱导的凝胶质构劣变和蒸煮损失增大。SPP处理降低了蛋白粒径、提高了其溶解度,显著改善了凝胶的蒸煮损失,但降低了凝胶的硬度、内聚性、弹性、咀嚼性和黏聚性。因此,安石榴苷和SPP可以在一定程度上抑制蛋白氧化,且对于MP的凝胶性能和持水性能具有显著调节作用。植物提取物与多聚磷酸盐复配在肉制品品质改善中具有很好的应用前景,但其在实际肉制品体系中的应用仍有待进一步研究。

