胃癌组织细胞程序性死亡配体1表达情况和CD8+肿瘤浸润T淋巴细胞密度及其与患者临床病理特征和预后的关系研究
张丽柯,马磊,史芳瑜,徐全晓
本研究价值:
目前,用于评估胃癌进展情况和患者预后的常用指标〔如国际妇产科联盟(FIGO)分期〕并未考虑患者整体免疫状态,而胃癌组织细胞程序性死亡配体1(PD-L1)表达情况和 CD8+肿瘤浸润T淋巴细胞(TILs)密度是否可用于评估胃癌患者预后尚不明确。本研究证实高水平PD-L1 mRNA、低密度CD8+TILs均是胃癌患者预后不良的独立危险因素,有望成为胃癌患者预后不良的生物标志物。
胃癌是全球范围内第五大常见恶性肿瘤,而在癌症相关死亡原因中,胃癌位居第三[1]。近年研究表明,多数胃癌与幽门螺杆菌、Epstein-Barr(EB)病毒感染及慢性炎症有关,而靶向免疫系统治疗是一种十分有应用前景的胃癌治疗方法[2-4];细胞程序性死亡配体1(programmed cell death ligand 1,PD-L1)与其受体细胞程序性死亡受体1(programmed cell death 1,PD-1)结合后可抑制T细胞迁移、增殖及细胞毒性递质分泌,最终通过减弱效应T细胞功能而限制其对肿瘤细胞的杀伤作用[5]。
PD-L1通常在免疫细胞(如巨噬细胞和树突状细胞)中表达,在多种肿瘤(如黑色素瘤、非小细胞肺癌、结肠癌)细胞中亦有表达[6-8]。研究表明,肿瘤细胞对PD-L1的调节机制主要包括内在免疫抵抗和适应性抵抗,肿瘤细胞中PD-L1表达上调并与肿瘤浸润T淋巴细胞(tumour-infiltrating lymphoeytes,TILs)表达的PD-1相互作用,从而负向调节免疫反应,造成肿瘤免疫逃逸[9]。因此,了解肿瘤细胞免疫状态对评估患者预后和免疫治疗的生物标志物筛选均有一定指导价值。本研究旨在分析胃癌组织PD-L1表达情况、CD8+TILs密度及其与患者临床病理特征和预后的关系。
1 对象与方法
1.1 研究对象 选择2016年1月至2018年3月在南阳市第一人民医院行手术治疗的胃癌患者125例,其中男76例、女49例;年龄40~65岁,平均年龄(57.1±8.2)岁。纳入标准:(1)经胃镜活检和术后病理检查确诊为胃癌;(2)行胃癌根治术;(3)术前未接受过新辅助化疗;(4)初次诊断。排除标准:(1)其他恶性肿瘤;(2)感染性疾病;(3)免疫系统疾病。本研究经南阳市第一人民医院伦理委员会审核批准(批准号:20210545),所有患者对本研究知情并签署知情同意书。
1.2 观察指标
1.2.1 临床病理特征 回顾性分析所有患者临床病理特征,包括年龄、性别、手术类型、分化程度、浸润深度、淋巴结转移情况、脉管侵犯情况、腹膜转移情况等。
1.2.2 预后 通过电话对所有患者进行随访以分析患者预后,随访起始时间为手术结束,终止时间为术后36个月,以患者死亡或失访为终点事件;以随访期间患者死亡为预后不良,随访36个月患者仍生存为预后良好。
1.2.3 PD-L1 mRNA相对表达量 收集所有患者胃癌组织标本并放置于-80 ℃冰箱中保存。采用实时荧光定量反转录聚合酶链反应(qRT-PCR)检测所有患者胃癌组织PD-L1 mRNA表达水平:(1)利用TRIZOL试剂提取总RNA,并采用紫外分光光度计检测样品浓度及纯度以确保样本合格;(2)将提取的RNA反转录为cDNA,并根据TaKaRa实时荧光定量PCR试剂盒说明书进行操作;(3)以管家基因U6 mRNA作为内参照(上游引物序列为5'-GGTT CTAGCTATGGTATCGCTTCAAT-3',下游引物序列为5'-GCGTCTGGTGATAGTCTGCAGAGT-3'),PD-L1上游引物序列为5'-TTGGGAAATGGAGGATAAGAACA-3',下游引物序列5'-TGTTGTATGGGGCATTGACT-3';(4)设置总反应体系为20 μl,反应条件:95 ℃预变性5 min,95 ℃变性 30 s,60 ℃退火 30 s,72 ℃延伸 30 s,40个循环;(5)采用2-ΔΔCt 法计算PD-L1 mRNA相对表达量,并以PD-L1 mRNA相对表达量的平均值为临界值,小于该临界值者归为低水平组,等于或大于该临界值者归为高水平组。
1.2.4 CD8+TILs密度 采用免疫组化方法检测所有患者胃癌组织CD8+TILs密度:(1)将胃癌组织石蜡标本制备成4 μm厚的连续切片并进行梯度脱蜡和水化处理,晾干后滴加3%过氧化氢溶液,室温放置10 min;(2)切片用磷酸盐(PBS)溶液冲洗后放置于柠檬酸盐缓冲液中浸泡,采用微波加热20 min以修复抗原,自然冷却后用PBS溶液冲洗并滴加一抗(兔抗人重组anti-CD8单克隆抗体,抗体终浓度为1∶50),4 ℃冰箱中孵育、过夜;(3)切片再次用PBS溶液冲洗后滴加抗兔的二抗,室温放置1 h后采用二氨基联苯胺(DAB)进行避光显色,采用光学显微镜观察切片,发现组织黄染时终止显色;(4)在癌巢区随机选取3个CD8+细胞丰富区域并计算CD8+TILs数量,并以癌巢内CD8+TILs数量的平均值作为临界值,小于该临界值者归为低密度组,等于或大于该临界值者归为高密度组。
1.3 统计学方法 采用SPSS 21.0软件进行数据分析。本研究计量资料均符合正态分布,以(±s)表示,两组间比较采用两独立样本t检验;计数资料以相对数表示,两组间比较采用χ2检验;胃癌组织PD-L1 mRNA相对表达量与CD8+TILs密度的相关性分析采用Pearson相关分析;绘制Kaplan-Meier曲线以进行生存分析,采用Log-rank检验;胃癌患者预后的影响因素分析采用单因素和多因素Cox回归分析。以P<0.05为差异有统计学意义。
2 结果
2.1 胃癌组织PD-L1 mRNA相对表达量、CD8+TILs密度 所有患者胃癌组织平均PD-L1 mRNA相对表达量为3.1,癌巢内平均CD8+TILs数量为36个,最终归为低水平组73例和高水平组52例,低密度组55例和高密度组70例。
2.2 胃癌组织PD-L1 mRNA相对表达量、CD8+TILs密度与患者临床病理特征的关系 低水平组与高水平组患者年龄、性别、手术类型、分化程度、浸润深度比较,差异无统计学意义(P>0.05),淋巴结转移、脉管侵犯、腹膜转移情况比较,差异有统计学意义(P<0.05);低密度组与高密度组患者年龄、性别、手术类型、分化程度比较,差异无统计学意义(P>0.05),浸润深度、淋巴结转移、脉管侵犯、腹膜转移情况比较,差异有统计学意义(P<0.05),见表1。
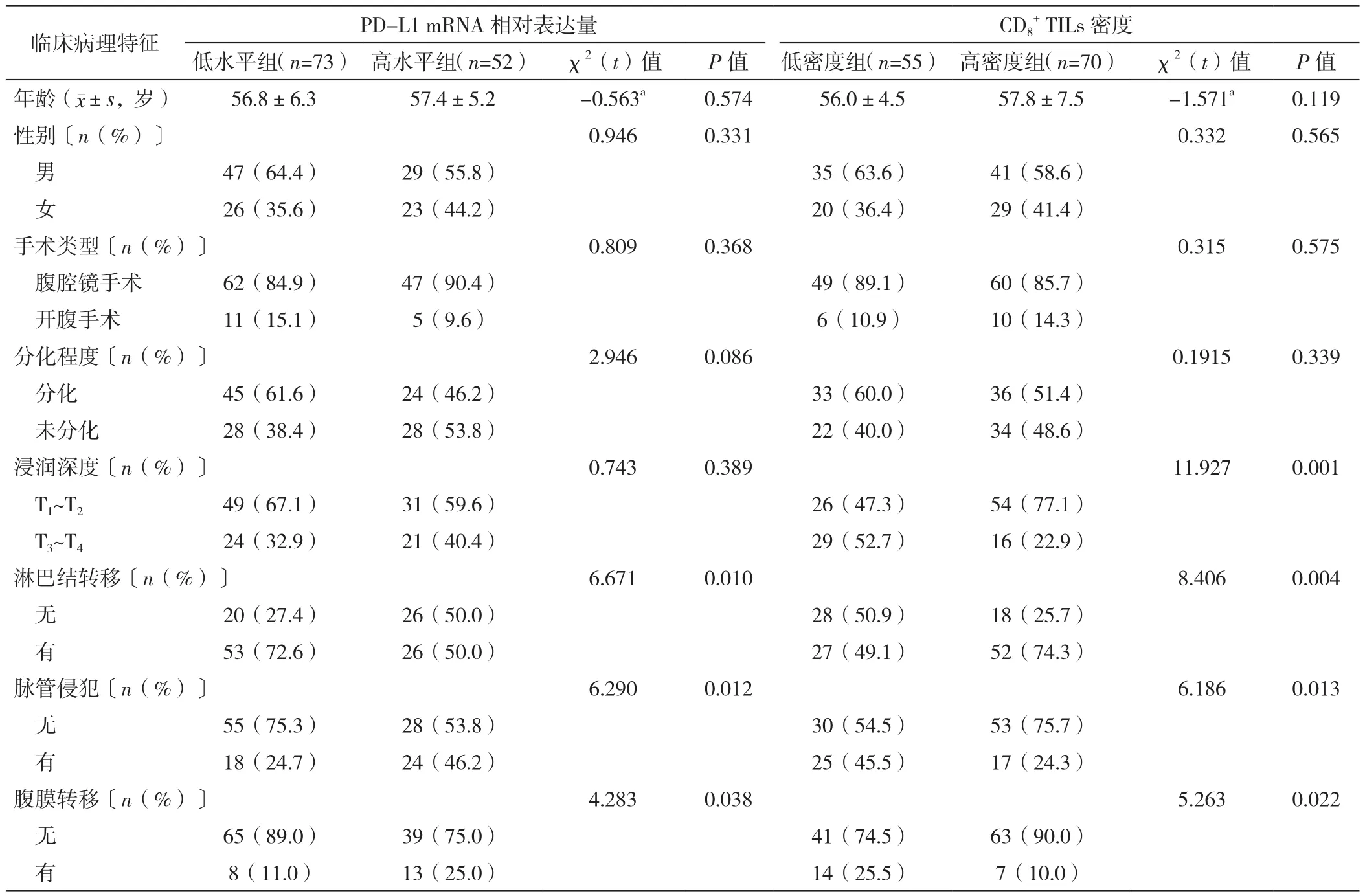
表1 胃癌组织PD-L1 mRNA相对表达量、CD8+ TILs密度与患者临床病理特征的关系Table 1 Relations of relative expression quantity of PD-L1 mRNA,density of CD8+ TILs in gastric cancer tissues with clinicopathological characteristics of patients with gastric cancer
2.3 相关性分析 Pearson相关分析结果显示,胃癌组织PD-L1 mRNA相对表达量与CD8+TILs密度呈负相关(r=-0.412,P<0.001)。
2.4 生存分析 所有患者随访2~36个月,中位随访时间为36.0个月;125例患者中预后不良37例,预后良好88例。低水平组与高水平组、低密度组与高密度组患者Kaplan-Meier曲线比较,差异均有统计学意义(χ2值分别为8.189、5.154,P值分别为0.004、0.023),见图1、2。

图1 不同PD-L1 mRNA相对表达量胃癌患者的Kaplan-Meier曲线Figure 1 Kaplan-Meier curve of gastric cancer patients with different relative expression quantity of PD-L1 mRNA
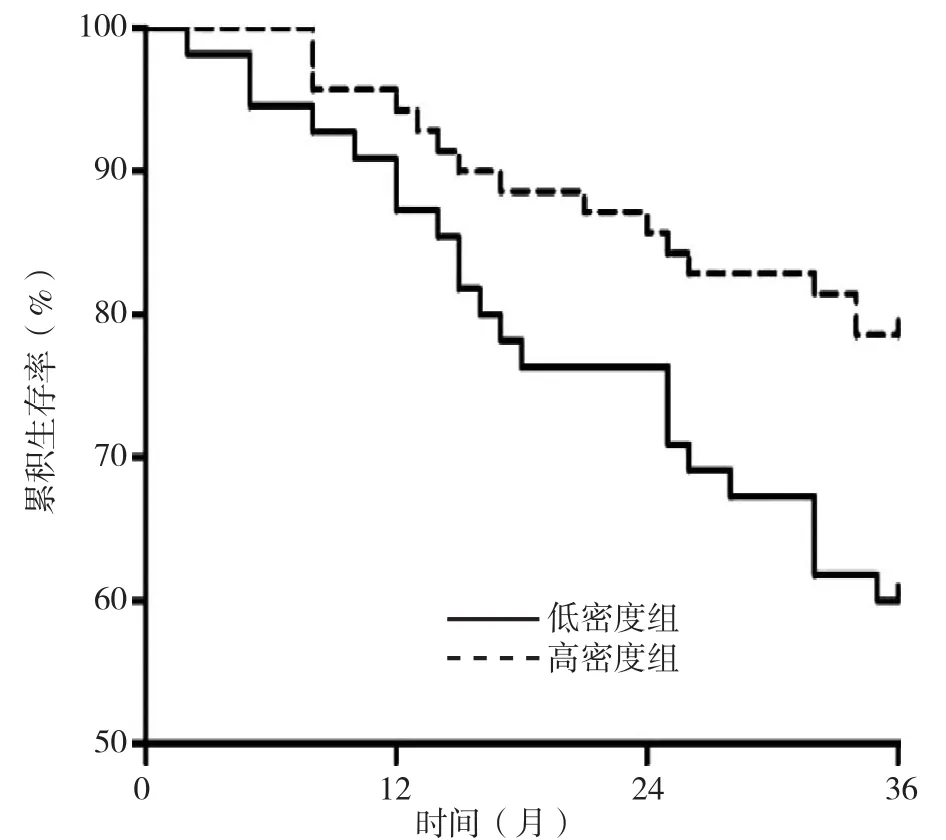
图2 不同CD8+ TILs密度胃癌患者的Kaplan-Meier曲线Figure 2 Kaplan-Meier curve of gastric cancer patients with different density of CD8+ TILs
2.5 单因素和多因素Cox回归分析 以临床病理特征为自变量,以预后为因变量进行单因素Cox回归分析(变量赋值见表2),结果显示,年龄、浸润深度、脉管侵犯、腹膜转移、高水平PD-L1 mRNA、低密度CD8+TILs是胃癌患者预后的影响因素(P<0.05),见表3;以单因素Cox回归分析结果中差异有统计学意义的指标为自变量,以预后为因变量进行多因素Cox回归分析(变量赋值同上),结果显示,浸润深度为T3~T4、脉管侵犯、腹膜转移、高水平PD-L1 mRNA、低密度CD8+TILs为胃癌患者预后不良的独立危险因素(P<0.05),见表3。

表2 胃癌患者预后影响因素单因素和多因素Cox回归分析的变量赋值Table 2 Variable assignment of univariate and multivariate Cox regression analysis of factors affecting prognosis of patients with gastric cancer
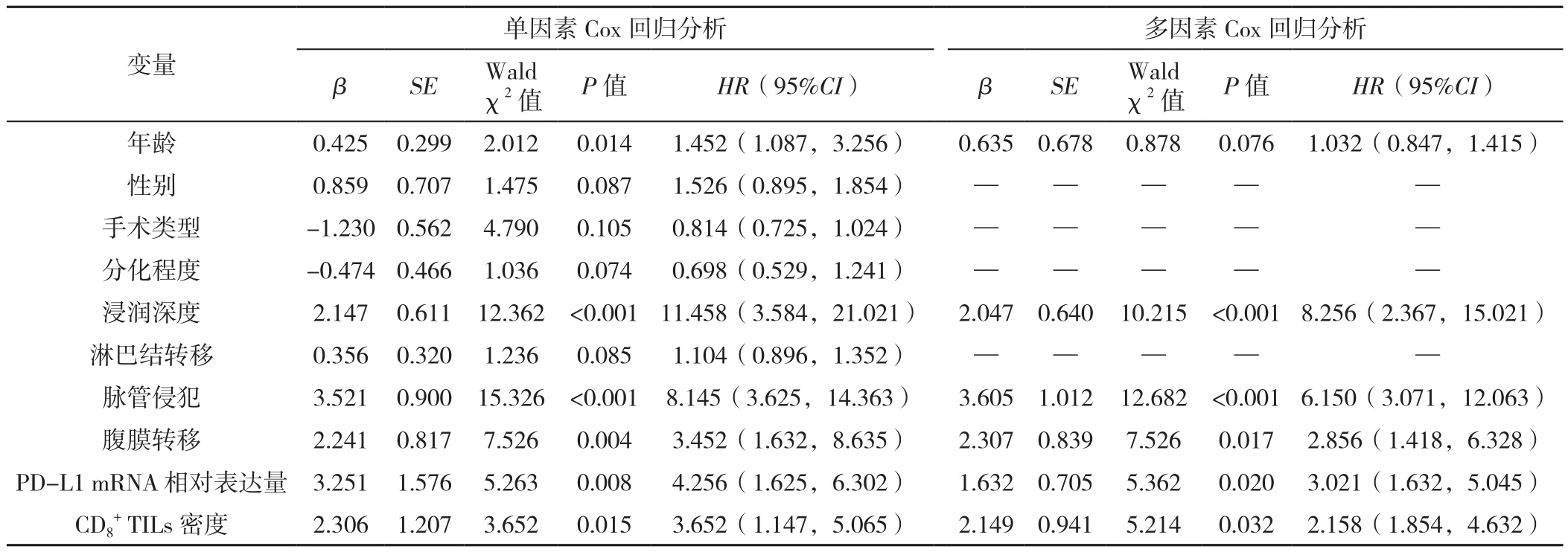
表3 胃癌患者预后影响因素的单因素和多因素Cox回归分析Table 3 Univariate and multivariate Cox regression analysis of factors affecting prognosis of patients with gastric cancer
3 讨论
胃癌细胞中PD-L1表达情况可能是抗PD-L1免疫治疗的有效生物标志物,检测胃癌组织PD-L1表达情况具有重要临床意义,但目前关于PD-L1表达情况对胃癌患者预后的影响尚存在争议:BÖGER等[10]研究认为肿瘤细胞PD-L1阳性的胃癌患者预后良好,但CHANG等[11]研究认为PD-L1高表达是胃癌患者预后不良的危险因素之一,KAWAZOE等[12]则研究认为PD-L1与胃癌患者预后无关。THOMPSON等[13]研究结果显示,胃癌患者癌组织PD-L1阳性表达率约为44.0%;本研究结果显示,41.6%(52/125)的胃癌患者癌组织PD-L1 mRNA呈高表达,与THOMPSON等[13]研究结果接近,进一步行多因素Cox回归分析发现,高水平PD-L1 mRNA为胃癌患者预后不良的独立危险因素之一。
研究表明,PD-L1在多种肿瘤(如黑色素瘤、非小细胞肺癌、结肠癌及胰腺癌)细胞中呈阳性表达,在正常组织中几乎不表达,肿瘤细胞PD-L1表达上调的机制可能与固有表达及适应性免疫抵抗有关[6-8,14],其中固有表达指肿瘤细胞通过癌基因上调PD-L1的表达并常在肿瘤细胞中呈弥漫性分布;适应性免疫抵抗指肿瘤细胞特异性抗原被T细胞识别时T细胞受体信号产生干扰素,进而诱导PD-L1的表达上调,此时PD-L1多在癌组织T细胞富集区表达,尤以肿瘤侵袭边缘为高[15-16]。
由于CD8+T淋巴细胞可诱导癌组织抑制性受体表达并导致CD8+T淋巴细胞功能障碍和凋亡,因为其也被称为耗竭的CD8+T淋巴细胞,而此耗竭过程会导致可杀死肿瘤细胞的CD8+T淋巴细胞数量不足,进而造成肿瘤快速进展,包括肿瘤细胞增殖、侵袭和转移等[17]。已有研究证实PD-1在耗竭的T细胞上表达,并是恶性肿瘤细胞用来逃避遭破坏的免疫逃逸的主要机制[18]。PD-L1通常被巨噬细胞、活化的淋巴细胞〔包括T淋巴细胞、B淋巴细胞、自然杀伤(NK)细胞〕、肿瘤细胞作为生理过程的一部分,可下调宿主免疫反应[19-20],CD8+T淋巴细胞直接参与肿瘤免疫反应并可直接杀伤表达肿瘤抗原的肿瘤细胞,因此PD-L1既是靶点又是免疫调节剂,可通过调节T细胞免疫功能发挥作用。
BURRACK等[21]通过结合癌组织PD-L1表达情况和CD8+TILs密度而评估宫颈癌患者免疫环境和预后,结果发现癌组织PD-L1表达水平和CD8+TILs密度呈负相关。本研究进行的Pearson相关分析结果显示,胃癌组织PD-L1 mRNA相对表达量与CD8+TILs密度呈负相关,提示胃癌组织PD-L1表达上调会抑制CD8+T淋巴细胞诱发宿主免疫反应。本研究结果还显示,低水平组与高水平组患者淋巴结转移、脉管侵犯、腹膜转移情况存在统计学差异,低密度组与高密度组患者浸润深度及淋巴结转移、脉管侵犯、腹膜转移情况亦存在统计学差异,提示PD-L1与CD8+TILs参与胃癌进展和转移;低水平组与高水平组、低密度组与高密度组患者Kaplan-Meier曲线间存在统计学差异,且多因素Cox回归分析结果显示高水平PD-L1 mRNA、低密度CD8+TILs为胃癌患者预后不良的独立危险因素。
目前,临床上常通过国际妇产科联盟(FIGO)分期判断恶性肿瘤进展情况及患者预后,但该分期并未考虑患者整体免疫状态及癌组织免疫特性,近年来已有研究机构试图在临床上推广免疫评分并将免疫评分整合入TNM分期[22]。本研究证实胃癌组织免疫微环境与患者预后密切相关,高水平PD-L1 mRNA和低密度CD+8TILs均是胃癌患者预后不良的独立危险因素,有望成为胃癌患者预后不良的生物标志物,因此,建议胃癌患者常规检测PD-L1表达情况和CD8+TILs密度,以更好地判断胃癌患者预后,但本研究为单中心研究且样本量较小,代表性有限,PD-L1表达情况和CD8+TILs密度用于评估胃癌患者预后的可行性、可靠性等仍需扩大样本量进一步验证。
作者贡献:张丽柯负责文献的检索、研究的设计及文章撰写;马磊、史芳瑜进行数据收集、采集、清洗和统计学分析,并负责制作图表;徐全晓对文章知识性内容进行批判性审阅并提供材料支持,进行文章质量控制和审校,对文章整体负责。所有作者确认了论文最终稿。
本文无利益冲突。

