深度理解《课程标准》,精准把握备考方向
——以2021年高考中催化剂的考查为例
河北 晏富强 文玉玲
2020年以后的高考化学试题是依据《普通高中化学课程标准(2017年版2020年修订)》(以下简称《课程标准》)学业要求进行命题,与曾经的高考考试大纲对比发现,对催化剂的考查要求有很大的改变,《普通高中化学课程标准(实验)版》高考考试大纲(2019年)要求的是了解反应活化能的概念,了解催化剂的重要作用;《课程标准》学业要求的是通过实验探究,了解温度、浓度、压强和催化剂对化学反应速率的影响。知道化学反应是有历程的,认识基元反应活化能对化学反应速率的影响。催化剂在现代化学工业中有极其重要的作用,近年的高考题都比较注重化学问题的情境设置,强调了化学与社会发展的重要联系,催化剂在高考中由边缘知识逐步变为重要考点,特别是2021年高考多道高考题对此进行了考查,其考查的知识面广,对考生的要求能力高。教师通过分析这些高考题启发学生深度思考,不仅可以夯实学生必备知识形成关键能力,还能提高学生化学学科核心素养。
一、从教材概念了解催化剂
在初中教材上催化剂是“在化学反应里能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质”。
在苏教版高中化学教材对催化剂有如下描述:“催化剂对化学反应速率有显著影响,是通过降低反应所需的活化能来增大反应速率的。”由此可知催化剂只改变了反应的途径没有改变反应的热效应。在可逆反应中催化剂可以改变化学反应速率但不会使平衡移动。催化剂是通过降低反应所需的活化能来增大反应速率的。没有催化剂的反应,活化能较大,则反应速率较小;而有催化剂参与的反应,活化能较小,则反应速率较大。
【例1】(2021·广东省选择性考试·19节选)一定条件下,CH4分解形成碳的反应历程如图1所示。该历程分________步进行,其中,第________步的正反应活化能最大。

图1
【参考答案】4;4
【解析】由图1可知,反应过程中能量变化出现了4个峰,即有4个过渡态出现了4次活化能,经历了4步反应;且从左往右看4次活化能吸收中,第4次对应的峰最高,即正反应方向第4步吸收的能量最多,对应的正反应活化能最大,活化能较大反应速率慢。
教师要让学生深度理解概念就需要让学生知道概念形成的理论依据,从反应历程和活化能的角度深度思考催化剂催化的机理,加深学生对催化剂的理解。
二、从反应历程认识催化剂和中间产物
《课程标准》学业要求学生要知道化学反应是有历程的,认识到催化剂(正催化剂)本身和反应物一起参加了化学反应,降低了反应所需要的活化能;也有些催化反应是由于形成了很容易发生反应的中间产物,反应时催化剂恢复了原来的化学组成。催化反应是一个复杂反应,要经过若干基元反应才能完成,这些基元反应描述了复杂反应所经过的途径,在化学动力学上称为反应历程。催化剂只能改变反应途径而不能改变反应发生的方向。
【例2】(2021·湖南省选择性考试·14)铁的配合物离子(用[L—Fe—H]+表示)催化某反应的一种反应机理和相对能量的变化情况如图2所示:
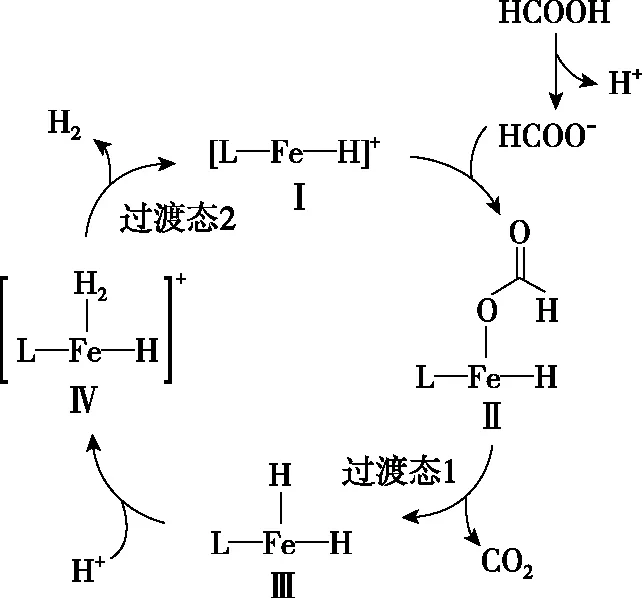
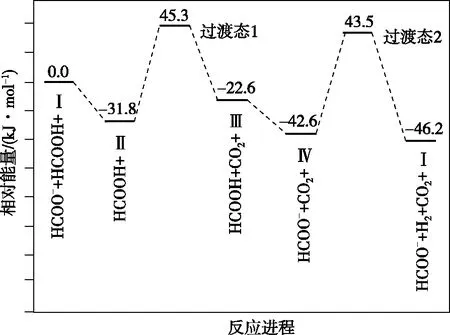
图2
下列说法错误的是
( )
B.H+浓度过大或者过小,均导致反应速率降低
C.该催化循环中Fe元素的化合价发生了变化
D.该过程的总反应速率由Ⅱ→Ⅲ步骤决定
【参考答案】CD

【深度思考】基元反应中[L—Fe—H]+参与反应,在反应前后的质量和化学性质不变,起催化剂的作用,H+和除了[L—Fe—H]+以外的铁的化合物起中间产物的作用。怎样判断催化剂和中间产物是学生答题时存在的问题,一般来说催化剂是前面一个基元反应的反应物,是最后一个基元反应的生成物,而且反应前后的质量和化学性质不变化,可以总结为“失而复得”。中间产物是前面一个基元反应的生成物,是后面某一个基元反应的反应物,不会在总反应的生成物中出现,中间产物往往不稳定,可以把中间产物总结为“自生自灭”。在能量图中除了反应物、生成物之外所有的“峰顶”就是过渡态,所有“谷底”就是中间体;过渡态能量比较高一定不太稳定,中间体能量相对较低相对比较稳定,有一定的存在时间。
三、从基元反应活化能理解催化剂对化学反应速率的影响
《课程标准》学业要求学生认识基元反应活化能对化学反应速率的影响。在苏教版高中教材对活化能是这样描述的,反应物转化为生成物的过程要经过能量较高的过渡态,过渡态的平均能量与反应物分子的平均能量的差为反应的活化能。如图3所示,Ea2是该反应无催化剂的活化能,Ea1和Ea3是该反应有催化剂后两个基元反应的活化能,Ea1逆是第一个基元反应的逆反应活化能。

图3
【例3】(2021·河北省选择性考试·16节选)在电解质水溶液中,三种不同催化剂(a、b、c)上CO2电还原为CO的反应进程中(H+电还原为H2的反应可同时发生),相对能量变化如图4。由此判断,CO2电还原为CO从易到难的顺序为________(用a、b、c字母排序)。
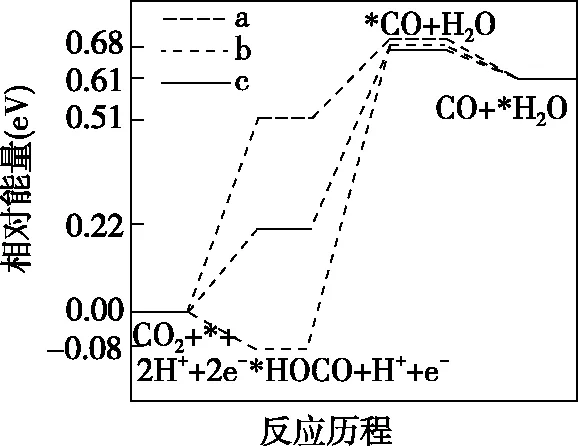
(a)CO2电还原为CO
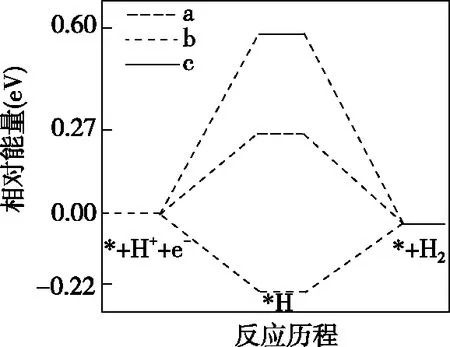
(b)H+电还原为H2
【参考答案】c、b、a
【解析】由图4可知,a催化剂条件下,H+电还原的活化能为0.27 eV,CO2电还原的活化能为0.51 eV,相比较H+电还原的活化能比CO2电还原的活化能小0.24 eV,发生H+电还原的可能性大于发生CO2电还原的可能性。b催化剂条件下,H+电还原的活化能为-0.22 eV,CO2电还原的活化能为-0.08 eV,相比较H+电还原的活化能比CO2电还原的活化能小0.14 eV,发生H+电还原的可能性大于发生CO2电还原的可能性,但和a催化剂条件下相比较,b催化剂条件下发生CO2电还原的可能性比a催化剂条件下大。c催化剂条件下,CO2电还原的活化能为0.22 eV,H+电还原的活化能为0.60 eV,更容易发生CO2的电还原。因此反应从易到难的顺序为c、b、a。

四、建构解题模型,形成关键能力
催化剂在化学工业广泛使用,将来催化剂在科学理论研究、氢能源的开发与利用,碳中和及环境的治理与保护方面都有极大的发展前景。今年高考中催化剂检测学生核心素养的功能更加突显,要求学生具备处理图像、表格等信息的能力,吸收信息能力,理解与辨析能力,基于证据进行分析、推理能力。在二轮复习中学生需依据教材和《课程标准》要求建构催化剂的知识模型,可以概括为“四能四不能”。
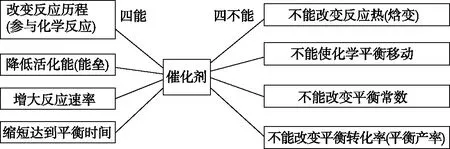
图5
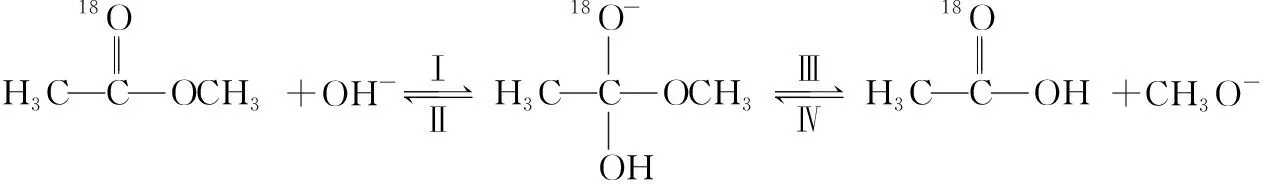
( )
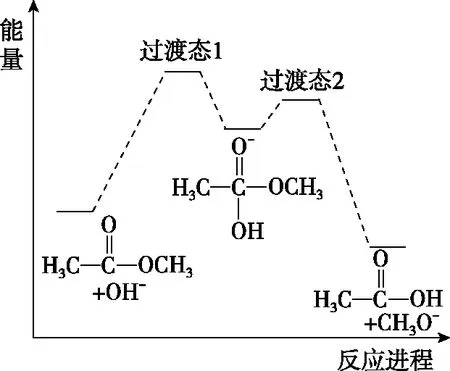
图6
A.反应Ⅱ、Ⅲ为决速步
B.反应结束后,溶液中存在18OH-
C.反应结束后,溶液中存在CH318OH
D.反应I与反应Ⅳ活化能的差值等于图示总反应的焓变
【参考答案】B

在以上必备知识的基础上,教师总结近几年高考题解题规律,发现有关催化剂的考查逐渐将定性问题变为定量化,结论性问题过程化,宏观性问题微观化等,试题通过图文、表格、流程、实验数据等多种信息呈现,注重对学生化学核心素养的考查。涉及催化剂原理的问题,可让学生形成如图7审题和思考此类题目的解题模型:

图7
【例5】[2019·全国卷Ⅰ·28(3)]我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图8所示,其中吸附在金催化剂表面上的物种用*标注。

图8
可知水煤气变换的ΔH________(填“大于”“等于”或“小于”)0。该历程中最大能垒(活化能)E正=________eV,写出该步骤的化学方程式:____________________。

【解析】提取关键信息:由题中图示可知水煤气变换时反应物的总相对能量0 eV,反应后生成物的总相对能量-0.72 eV,反应为放热反应,故ΔH小于零。



