模型认知在“水溶液中的离子反应与平衡”图像中的应用
广东
一、概述
《普通高中化学课程标准(2017年版2020年修订)》关于“证据推理与模型认知”素养的描述为:“知道可以通过分析、推理等方法认识研究对象的本质特征、构成要素及其相互关系,建立认知模型,并能运用模型解释化学现象,揭示现象的本质和规律。”
“水溶液中的离子反应与平衡”是高考化学必考内容,试题多会以图像的形式呈现,具有一定的综合性、灵活性和技巧性,很好地考查学生化学学科核心素养。这部分内容也是学生学习的难点,基于高中化学必修1“离子反应”和选择性必修1“水溶液中的离子平衡”等内容的学习,学生基本具备从微观角度去分析溶液中存在何种微粒的能力,但仍缺乏系统的分析策略,多数学生对“两轴三点”(横、纵坐标轴,起点、终点和特殊点)没有形成系统认识,不能将图像与离子反应、微粒种类及物理量建立起关联。
为此,本文以“水溶液中的离子反应与平衡”图像复习教学为例,运用模型分类认知,传授教师帮助学生突破思维障碍的方法,完善知识结构及认识思路。
二、热点图像分类展示
1.pH-V图
【探题源】(2010·江苏卷·12)常温下,用0.100 0 mol·L-1NaOH溶液滴定20.00 mL 0.100 0 mol·L-1CH3COOH溶液所得滴定曲线如图1。下列说法正确的是
( )
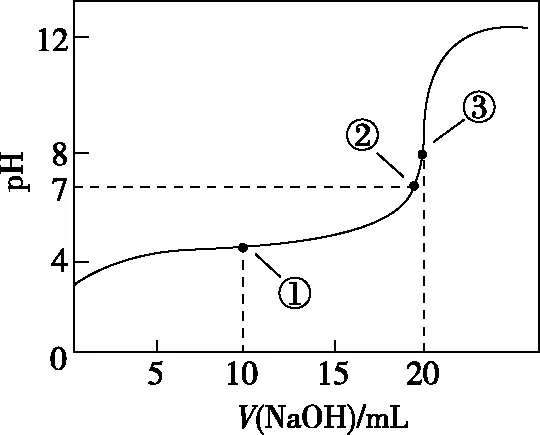
图1
A.点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
B.点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-)
C.点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
【参考答案】D
【解析】点①溶液中的溶质为0.001 mol的CH3COOH和0.001 mol的CH3COONa,据元素质量守恒“2c(Na+)=c(CH3COOH)+c(CH3COO-)”和电荷守恒“c(Na+)+c(H+)=c(CH3COO-)+c(OH-)”,整理后消去c(Na+)可得:c(CH3COO-)+2c(OH-)=c(CH3COOH)+2c(H+),故A错误;点②溶液的pH=7,即c(H+)=c(OH-),再据电荷守恒“c(Na+)+c(H+)=c(CH3COO-)+c(OH-)”可得:c(Na+)=c(CH3COO-),故B错误;点③溶液中的溶质为0.002 mol的CH3COONa,又因为CH3COO-水解且程度较小,则离子浓度大小关系为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故C错误;当CH3COOH较多,滴入的碱较少时,则生成CH3COONa少量,则可能出现c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-),故D正确。
【建模型】基本方法:抓住关键点→确定酸碱性→厘清微粒组成→用好“三守恒”
突破酸碱中和滴定曲线图像的关键是“五点四段”,如以常温下用0.1 mol·L-1NaOH溶液滴定20 mL 0.1 mol·L-1HA溶液的滴定曲线为例,其溶液pH的变化如图2所示。
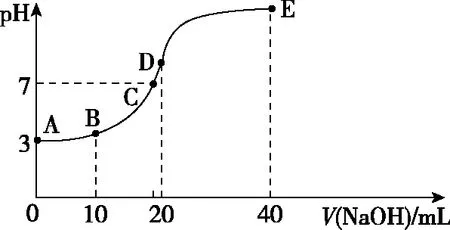
图2
溶液中的溶质成分经历了“酸→酸、盐混合→盐→盐、碱混合”的“四段”变化。巧用“五点”,即曲线的起点、反应一半点、恰好完全反应点、溶液中性点和过量点,先判断各点所对应溶液的酸碱性(pH),再思考溶质在溶液中的宏观表现、各粒子间相互是否反应以及宏观相对的量,最后应用电荷守恒、元素质量守恒等守恒关系去分析变化体系中不变的关系。
笔者总结抓住滴定曲线的5个关键点的一般方法:抓反应的“起始”点,判断酸、碱的相对强弱;抓反应的“一半”点,判断是哪两种溶质的等量混合,若为二元弱酸H2A,则溶质为弱酸酸式盐NaHA单一成分;此时n(HA)=n(NaA),抓溶液的“中性”点,判断溶液中溶质的成分及哪种物质过量或不足,此时溶液中的c(H+)=c(OH-);抓“恰好”完全反应点,此时酸碱混合恰好完全反应生成正盐,溶液的酸碱性只由盐水解决定;抓反应的“过量”点,判断溶液中的溶质及量的关系。结合图2曲线,应用方法思路可总结如表1。
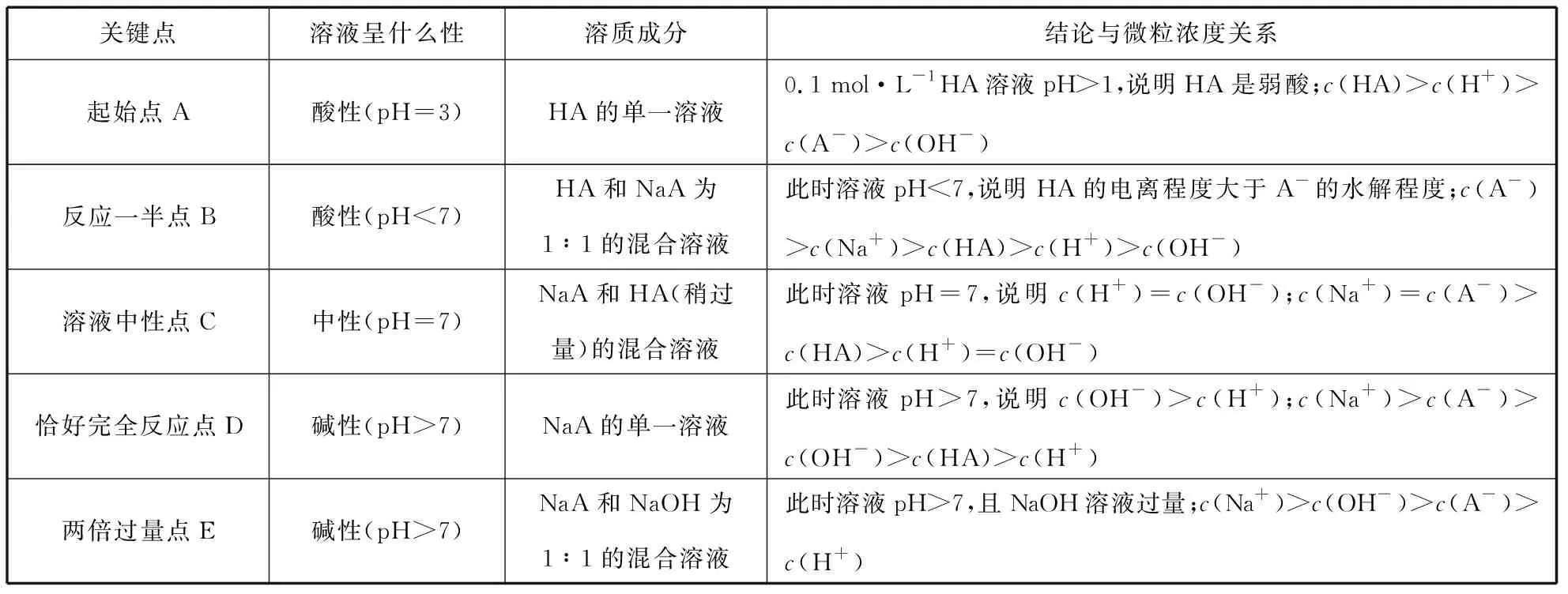
表1
【实操应用1】(2021·浙江6月选考·23)取两份10 mL 0.05 mol·L-1的NaHCO3溶液,一份滴加0.05 mol·L-1的盐酸,另一份滴加0.05 mol·L-1NaOH溶液,溶液的pH随加入酸(或碱)体积的变化如图3。
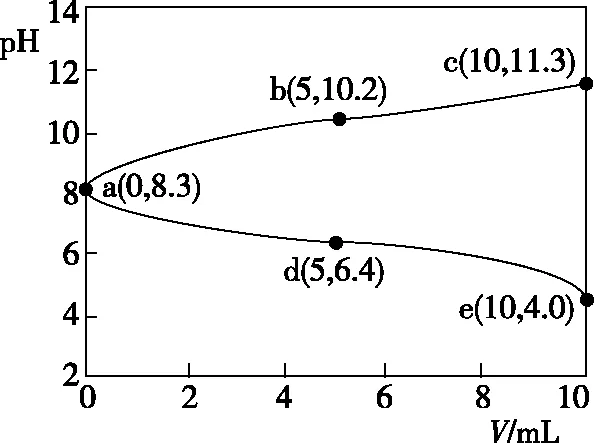
图3
下列说法不正确的是
( )
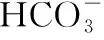
D.令c点的c(Na+)+c(H+)=x,e点的c(Na+)+c(H+)=y,则x>y
【参考答案】C
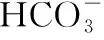
2.δ-pH图
( )
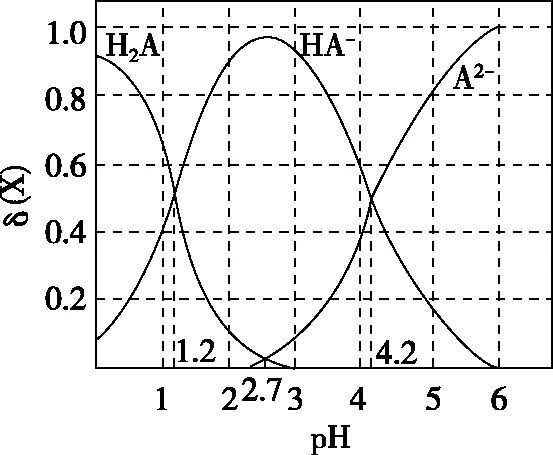
图4
A.pH=1.2时,c(H2A)=c(HA-)
B.lg[K2(H2A)]=-4.2
C.pH=2.7时,c(HA-)>c(H2A)=c(A2-)
D.pH=4.2时,c(HA-)=c(A2-)=c(H+)
【参考答案】D
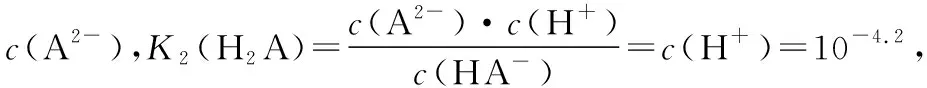
【建模型】基本方法:分清微粒线→关注交叉点→借用“三守恒”→构建关联式。
分布系数(δ)图像是酸碱中和滴定曲线的一种变式,常以pH为横坐标,分布系数(δ)为纵坐标,结合滴定实验数据而绘制出的关系曲线,分布系数(δ)代表组分的平衡浓度占总浓度的比值。因此,学生在解题时应先按照“此起彼伏”的规律分清各微粒所对应的曲线,结合题意明确其来源,再根据曲线交点的pH确定电离常数,也可借用三大守恒确定溶液中离子浓度的等式或不等式关系等。图像中的交点是两种微粒浓度相等的点,可以由交点的相关数据快速求出弱酸(或弱碱)的Ka(或Kb)。对于二元弱酸H2A,随着pH的增加,第一个交点即为溶液c(H2A)=c(HA-)的点,此时pH1=pKa1,第二个交点即为溶液c(HA-)=c(A2-)的点,此时pH2=pKa2。
【实操应用2】(2021·山东省学业水平等级考试·15)赖氨酸[H3N+(CH2)4CH(NH2)COO-,用HR表示]是人体必需氨基酸,其盐酸盐(H3RCl2)在水溶液中存在如下平衡:
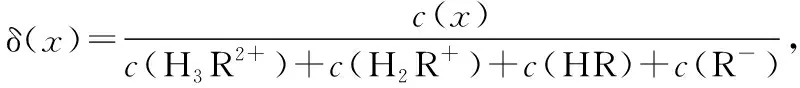
( )
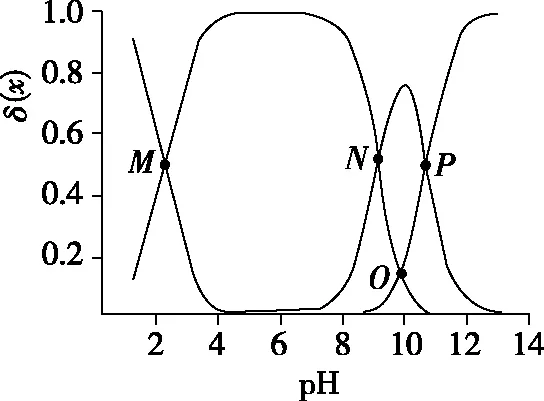
图5
B.M点,c(Cl-)+c(OH-)+c(R-)=2c(H2R+)+c(Na+)+c(H+)
D.P点,c(Na+)>c(Cl-)>c(OH-)>c(H+)
【参考答案】CD
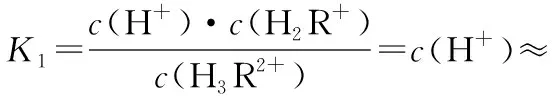
3.lgx-pH图
【探题源】(2017·全国卷Ⅰ·13)常温下将NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图6所示。下列叙述错误的是
( )
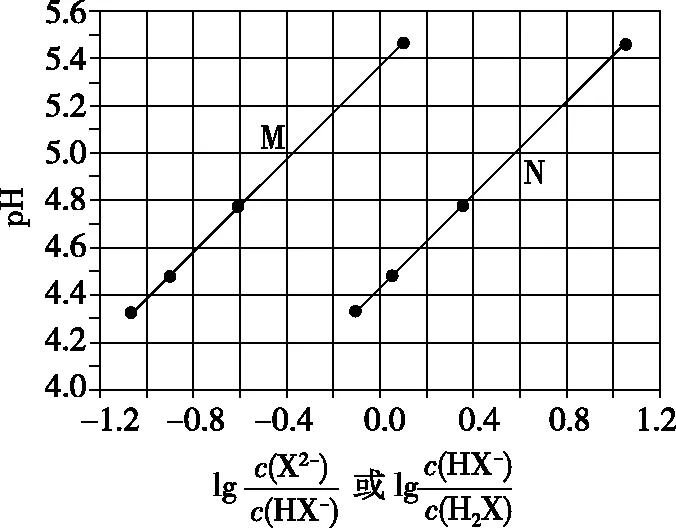
图6
A.Ka2(H2X)的数量级为10-6
C.NaHX溶液中c(H+)>c(OH-)
D.当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+)
【参考答案】D
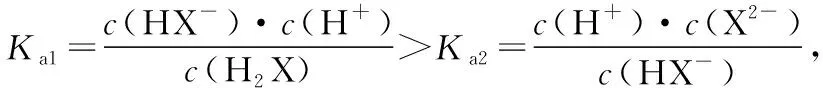
【建模型】基本方法:明确对数意义→分清微粒线→关注交叉点→构建关系式
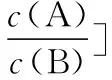
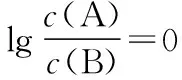
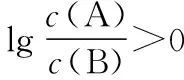
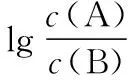
④交叉点为微粒浓度相等点,再用三大守恒构建出溶液离子浓度的等量或不等量关系。
【实操应用3】(2020·山东卷·15)25℃时,某混合溶液中c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1,lgc(CH3COOH)、lgc(CH3COO-)、lgc(H+)和lgc(OH-)随pH变化的关系如图7所示。Ka为CH3COOH的电离常数,下列说法正确的是
( )
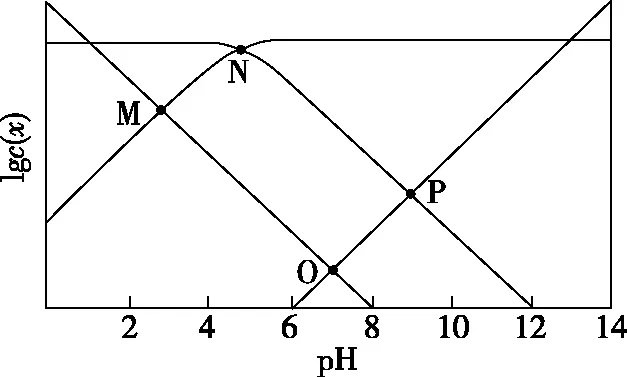
图7
A.O点时,c(CH3COOH)=c(CH3COO-)
B.N点时,pH=-lgKa
D.pH由7到14的变化过程中,CH3COO-的水解程度始终增大
【参考答案】BC
【解析】明确对数意义,分清微粒线。随着pH的升高,c(OH-) 和c(CH3COO-)增大,c(H+)和c(CH3COOH)减小,又由于pH=7时,c(H+)=c(OH-),故可推知,图8中曲线1为lgc(CH3COO-)随pH的变化曲线,曲线2为lgc(H+) 随pH的变化曲线,曲线3为lgc(OH-)随pH的变化曲线,曲线4为lgc(CH3COOH)随pH的变化曲线。
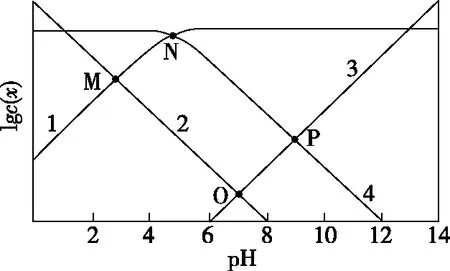
图8
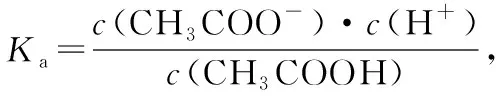
4.δ-V-pH图
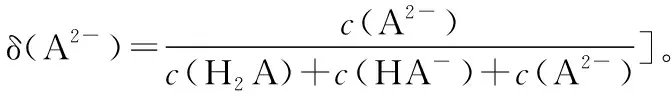
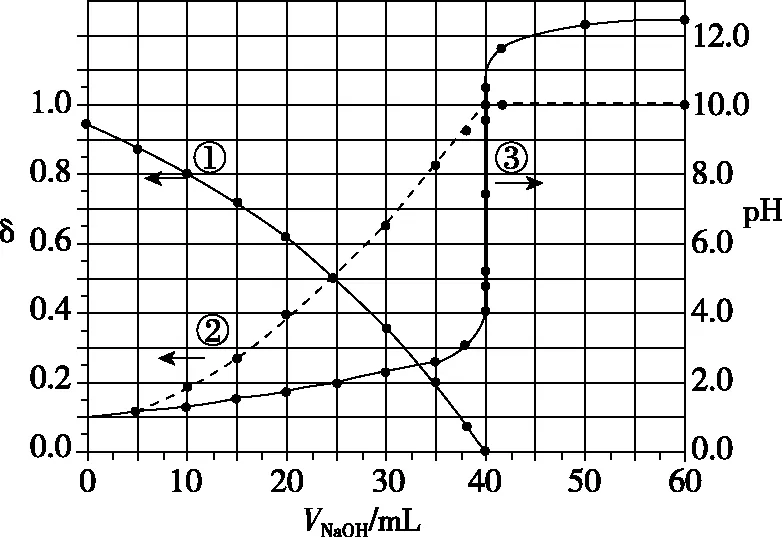
图9
下列叙述正确的是
( )
A.曲线①代表δ(H2A),曲线②代表δ(HA-)
B.H2A溶液的浓度为0.200 0 mol·L-1
C.HA-的电离常数Ka=1.0×10-2
D.滴定终点时,溶液中c(Na+)<2c(A2-)+c(HA-)
【参考答案】C

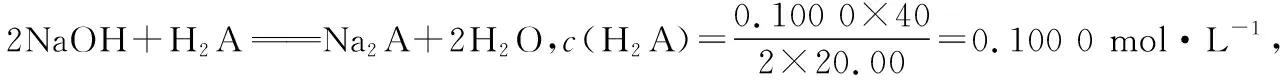
【建模型】基本方法:确认共同轴→拆解复合图→迁移二元图
【实操应用4】(2021·辽宁省选择性考试·15)用0.100 0 mol·L-1盐酸滴定20.00 mL Na2A溶液,溶液中H2A、HA-、A2-的分布分数δ随pH变化曲线及滴定曲线如图10。下列说法正确的是
( )
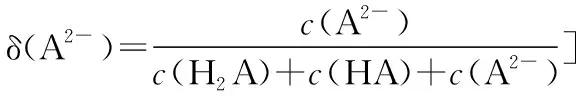
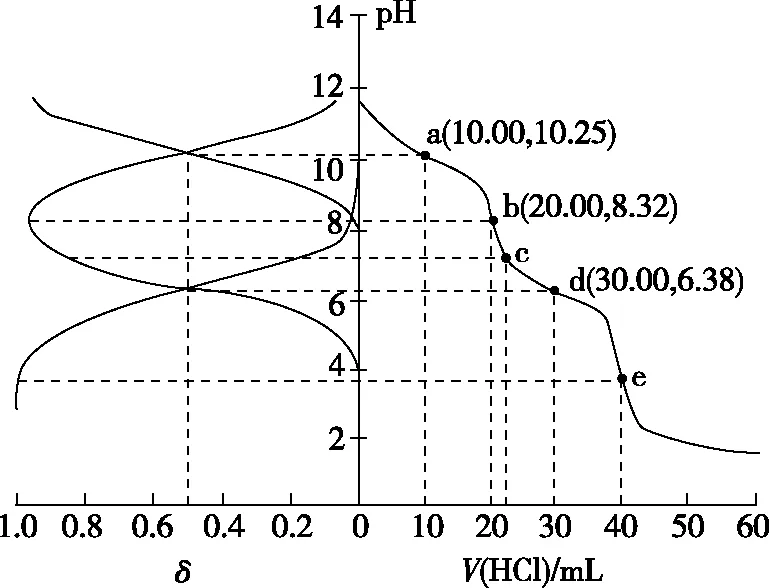
图10
A.H2A的Ka1为10-10.25
B.c点:c(HA-)>c(A2-)>c(H2A)
C.第一次突变,可选酚酞作指示剂
D.c(Na2A)=0.200 0 mol·L-1
【参考答案】C
【解析】由图像可知,随着pH的减小,A2-的分布分数δ逐渐减小,HA-的分布分数δ逐渐增大,恰好生成NaHA之后,HA-的分布分数δ逐渐减小,H2A的分布分数δ逐渐增大,由此可得表示H2A、HA-、A2-的分布分数δ的曲线如图11所示。
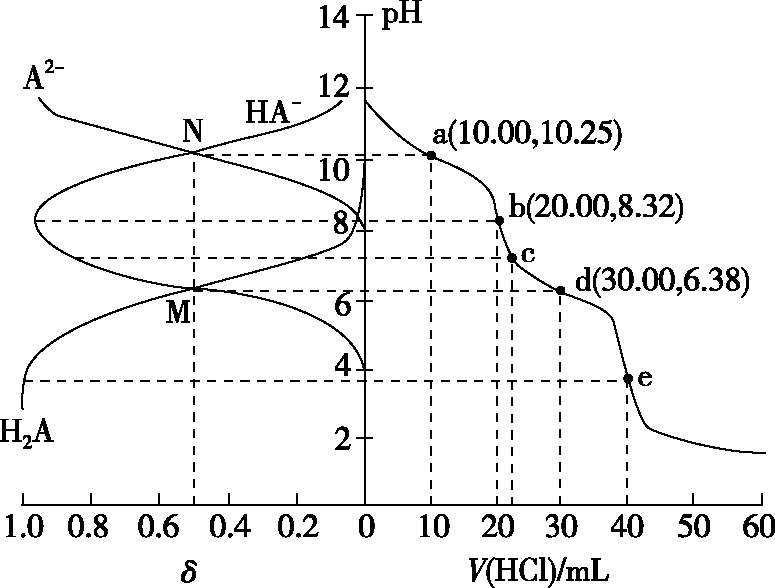
图11
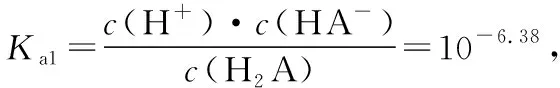
三、结语
“水溶液中的离子反应与平衡”图像类试题很好地将基于真实情境下的化学实验过程用图像予以表征,要求考生能对图像从静态到动态化的阅读,从而获取有关的感性认知,再将基础知识与提取的关键信息相结合来解决有关问题。总之,突破此类试题的整体思路是基于微粒观、变化观、守恒观等从宏观到微观,重视模型的迁移应用。巧妙解读图像的关键是明确图像纵、横坐标的物理意义,从图像中找特殊点,并对特殊点中所蕴含的信息从定性与定量两个维度进行准确解读。


