过表达核苷二磷酸激酶对透明质酸的产量和相对分子质量的影响
虞菊萍,刘 玮,叶 萌,唐东洋,高向东
(中国药科大学生命科学与技术学院,南京 211198)
透明质酸(hyaluronic acid,HA)由于其独特的黏弹性、生物相容性和非免疫原性,已广泛应用于生物医学领域和化妆品工业[1]。HA在体内发挥生物学活性依赖于其相对分子质量和均一性,高相对分子质量HA 在细胞外基质维持细胞完整性[2]和保水能力,而低相对分子质量HA 则广泛应用于药物递送[3]、组织工程[4]和肿瘤治疗[5]等领域。HA由葡萄糖醛酸(GlcUA)与N-乙酰氨基葡萄糖(GlcNAc)双糖单位构成[6]。HA 传统生产方式是动物组织提取或经C族链球菌发酵提取,但传统制备工艺比较复杂且存在很大安全隐患,为此,Jing等[7]率先采用化学-酶合成法成功实现了均一特定相对分子质量HA 的合成。然而该方法仍存在局限性,如单糖前体价格过于昂贵、反应体系不易放大。随着HA 合成通路的揭示及合成生物学技术的发展,研究者们开始尝试在安全性的微生物宿主中构建HA 代谢通路,进行HA 的异源表达。目前公认的安全菌株有大肠埃希菌[8]、枯草芽孢杆菌[9]、毕赤酵母[10]和乳酸乳球菌[11],均已被成功用作异源表达系统。Jia等[12]设计了分别包含透明质酸合成酶或透明质酸前体合成相关酶基因的可诱导基因表达簇,利用重组枯草芽孢杆菌对HA 进行诱导表达,成功获得了均一相对分子质量HA。
已有研究者阐明的链球菌透明质酸合成途径[13]显示,产生透明质酸二糖单元需要葡萄糖、辅酶Ⅰ(NAD+)、核苷三磷酸(NTPs)和乙酰辅酶A,该过程会产生尿苷二磷酸(UDP)。有研究表明,细胞内代谢中间体UDP-N-乙酰半乳糖胺、UDP-半乳糖醛酸、UDP和尿苷三磷酸(UTP)均可抑制Ⅰ类透明质酸合酶的活性,其中UDP 的抑制活性最高[14]。不过,碱性磷酸酶可以水解HA 合成过程中产生的UDP,加入碱性磷酸酶后透明质酸聚合反应的动力学则基本恢复线性[15]。因此,本研究推测UDP 的积累对Ⅱ类透明质酸合成酶也有类似的抑制作用,UDP 浓度的降低有利于胞内透明质酸的合成。核苷二磷酸激酶(NDK)是一种高度保守的酶,可以催化核苷二磷酸(NDP)和核苷三磷酸(NTP)的相互转化[16]。在HA 生物合成过程中,核苷二磷酸激酶基因(ndk)的过表达将促进UDP 向UTP 的转化,从而提供充足的生成活化UDP-单糖前体所不可缺少的UTP。因此,ndk基因在HA 合成过程中可能起着至关重要的作用。
为了提高重组枯草芽孢杆菌中HA 的产量和相对分子质量,同时考察UDP 蓄积对Ⅱ型透明质酸合成酶的影响,本研究将ndk基因以及透明质酸合成酶基因(多杀性巴氏杆菌透明质酸合酶、4-UDP-葡萄糖焦磷酸化酶和UDP-葡萄糖脱氢酶)导入枯草芽孢杆菌中进行了过表达。这是首次将ndk基因应用于HA生物合成系统以评估UDP的积累对Ⅱ类透明质酸合成酶的影响,也为其他糖类药物研发及产量和相对分子质量提高提供了新的思路。
1 材 料
1.1 试 剂
细菌基因组提取试剂盒,高纯度质粒小提试剂盒和琼脂糖凝胶回收试剂盒(北京天根生化科技有限公司);LATaq聚合酶和限制性内切酶(大连TAKARA 公司);EasyPureTMRNA 提取试剂盒(北京全式金生物技术有限公司);实时荧光定量PCR 试剂盒SYBR Green PCR Mastermix(美国应用生物系统ABI公司);引物[美国英杰(上海)生命技术公司];聚苯乙烯硫酸酯钠盐标准品(北京龙智达公司);透明质酸标准品(山东焦点生物科技公司);全染色剂Stains-All 染料(美国Sigma 公司)。其他化学试剂均为分析纯。
1.2 仪 器
PCR 仪(美国Bio-Rad 公司);StepOne 实时荧光定量PCR 仪、H-1650 型台式高速离心机(美国Thermo Fisher 公司);AV-300 MHz 核磁共振仪(TMS 内标)、Bruker Rapid scan tensor 27 红外光谱仪(德国Bruker 公司);Avanti J-26 XP 高速冷冻离心机(美国Beckman公司);ZHWY-100B摇床(上海智诚分析仪器有限公司)。
1.3 菌 株
Escherichia coliDH5α 菌株(本实验室保存);Bacillus subtilisWB800 菌 株(美 国BGSC 保 藏中心)。
2 方 法
2.1 基因扩增与表达系统构建
本研究选择将Ⅱ类透明质酸合成酶基因(Pm⁃HAS)置于基因组整合型的木糖诱导启动子下,同时选择含有IPTG诱导的乳糖利用操纵子的低拷贝附加型游离质粒pHCMC05 负责HA 合成关键酶基因。基因克隆所需的系列引物信息见表1。多杀性巴氏杆菌透明质酸合酶(PmHAS)基因从多杀性巴氏杆菌P-1059(ATCC#15742)中扩增获得,UDP-葡萄糖脱氢酶基因(tuaD)、UDP-葡萄糖焦磷酸化酶基因(gtaB)、核苷二磷酸激酶基因(ndk)从枯草芽孢杆菌168 中扩增获得。基因表达组装的详细信息如图1-A 和表2 所示。含有pSG1729-PmHAS和pHCMC05-tuaD-gtaB的菌株被命名为Hp8tg,携带有pSG1729-PmHAS-ndk和pHCMC05-tuaD-gtaB的菌株被命名为Pn8tg。利用含有100 mg/L 壮观霉素和25 mg/L 氯霉素的LB 琼脂平板(含20 g/L 琼脂的LB 培养基)筛选枯草芽孢杆菌的重组菌株。将阳性菌株接种到含有10 g/L 可溶性淀粉的LB 琼脂平板上进一步培养,然后经碘溶液染色处理,验证构建的质粒是否成功整合到特定的amyE位点。

Table 1 Primers used in this study
2.2 PmHAS活性测定
收集重组菌株用于体外评估透明质酸合成酶(PmHAS)活性。用已预冷的磷酸盐缓冲液(PBS,pH 7.2)洗涤菌体3次,然后将其重悬于含有10 g/L溶菌酶的PBS 中,于冰浴条件下超声处理。酶反应的条件参见文献[14]。将样品加至含有20 g/L聚丙烯酰胺的Tris-硼酸-EDTA 凝胶上,用Stains-All 染料对凝胶进行避光染色,然后通过10%乙醇溶液进行脱色处理。
2.3 RT-PCR分析
用EasyPure RNA 提取试剂盒提取重组菌株的总RNA,并测定RNA 的浓度。选择PrimeScriptⅡ第一链cDNA 合成试剂盒合成第一链cDNA。用SYBR Green荧光染料进行定量RT-PCR。
2.4 HA的发酵
有研究表明,PmHAS 的聚合活性取决于二价阳离子,二价阳离子有利于单糖前体的结合[17],因此选择Mg2+作为PmHAS的辅因子加入培养基。本研究以HA 产量为考察指标对LB 培养基进行优化,选择初始葡萄糖浓度、金属离子浓度、初始磷浓度进行单因素考察,然后通过响应面分析试验确定了工程菌株的最佳发酵培养基配方。将重组枯草芽孢杆菌按1%比例接种于含有壮观霉素和氯霉素的培养基中。调节培养基至初始pH 为7.2,培养条件为37 ℃,220 r/min,培养过程中对培养基pH 进行监测使其保持在7.2 左右。接种后2 h加入诱导剂木糖(xylose)至终浓度为1 mmol/L,接种后4 h 加入诱导剂β-D-异丙基硫代半乳糖(IPTG)至终浓度7.5 g/L。
2.5 HA的提取纯化和鉴定
培养结束后对培养物进行离心分离,收集上清液,经无水乙醇醇沉得到HA 沉淀。沉淀用蒸馏水重溶,利用截留相对分子质量为8 000 ~ 14 000的透析袋进行透析处理,透析液冻干后即获得HA粗品。通过DEAE-Sepharose Fast Flow 对其进一步纯化,详细操作见文献[18],收集具有高浓度目标产物的洗脱液,经透析并冻干后即得HA样品。
以D-葡萄糖醛酸作标准品,选择硫酸咔唑法对纯化后的样品进行定量测定,并计算HA 的产量。HA 的相对分子质量通过高效液相色谱系统进行测定,色谱柱为Shodex OHpak SB-806 HQ,流动相为0.2 mol/L 氯化钠(35 ℃,0.5 mL/min)。通过相对分子质量已知的聚苯乙烯硫酸酯钠盐标准品在高效液相色谱上的保留时间拟合标准曲线,根据样品的保留时间计算出样品的相对分子质量分布。

Table 2 Plasmids used in this study
通过PMP-RP-HPLC-DAD 方法分析HA 的单糖组成。详细步骤参考文献[12]。通过傅里叶红外光谱法及核磁共振波谱法进一步表征HA样品。
3 结 果
3.1 枯草芽孢杆菌中HA生物合成途径的构建
本研究构建了两种类型的诱导型操纵子(图1)。可溶性淀粉琼脂平板上菌株培养结果验证了基因在amyE位点的整合成功,图1-C 显示宿主菌株不能被染色,但是Hp8tg和Pn8tg可以被染色,这表明相关基因成功整合。通过PCR 对重组菌株基因组以及质粒的进一步分析结果表明,所有被改造成操纵子的基因均保持完整。体外PmHAS 的活性测试实验表明PmHAS 在重组菌株中成功表达。
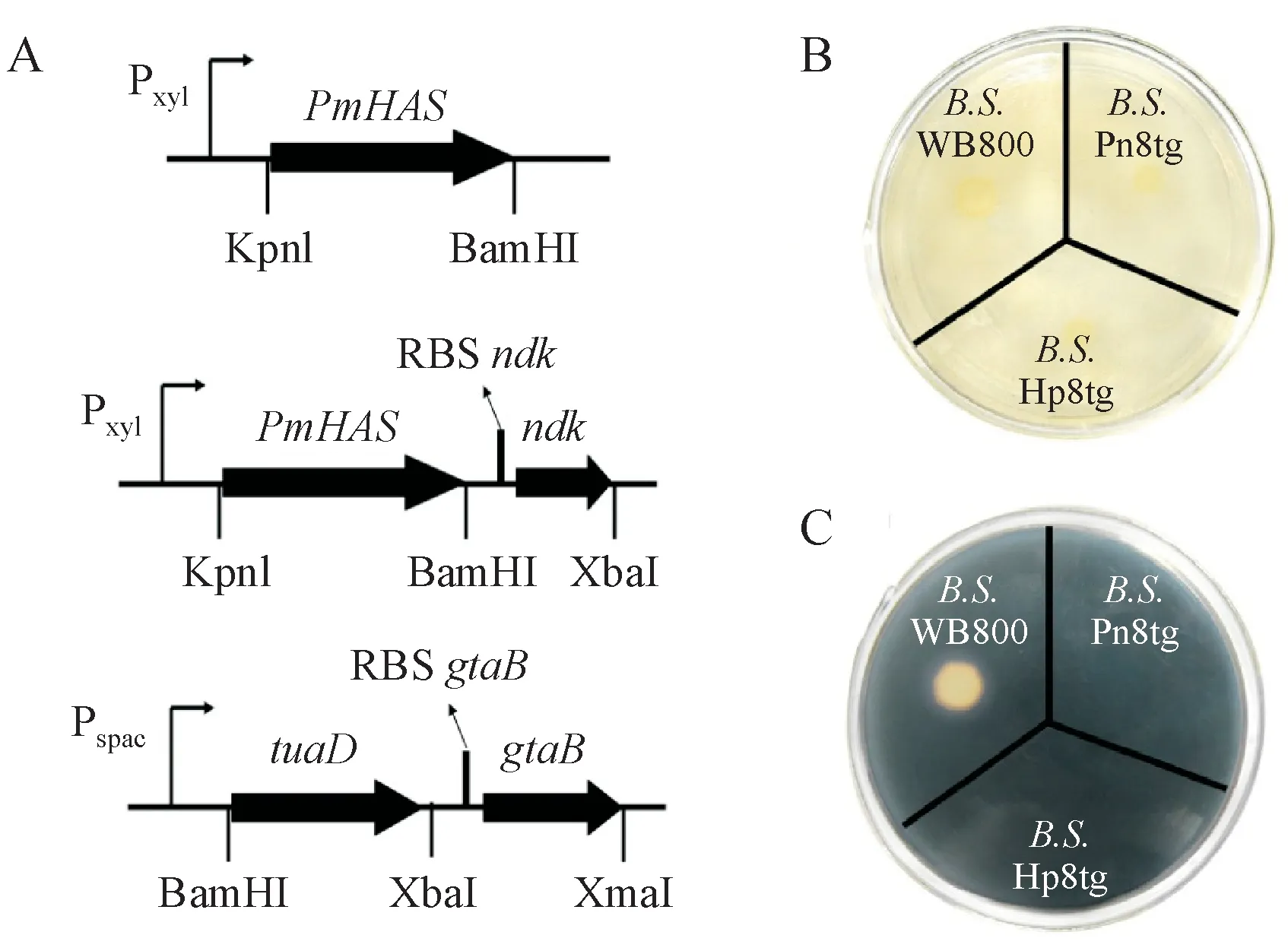
Figure 1 Description and verification of the successful construction of recombinant system
通过单因素考察和响应面分析试验,确定了工程菌株的发酵培养基组成为:1%蛋白胨、0.5%酵母粉、1% NaCl、37.86 g/L 葡萄糖、47.19 mmol/L Mg2+及77.02 mmol/L PO3-4。对发酵产物进行的单糖组成分析、FT-IR 和1H NMR 分析结果表明,重组枯草芽孢杆菌产生的多糖为HA。单糖组成分析如图2所示,通过与已知单糖的高效液相色谱图比较,表明样品中单糖组成为GlcN 和GlcUA,且物质的量比为1∶1,两种单糖构成发酵产物的骨架。
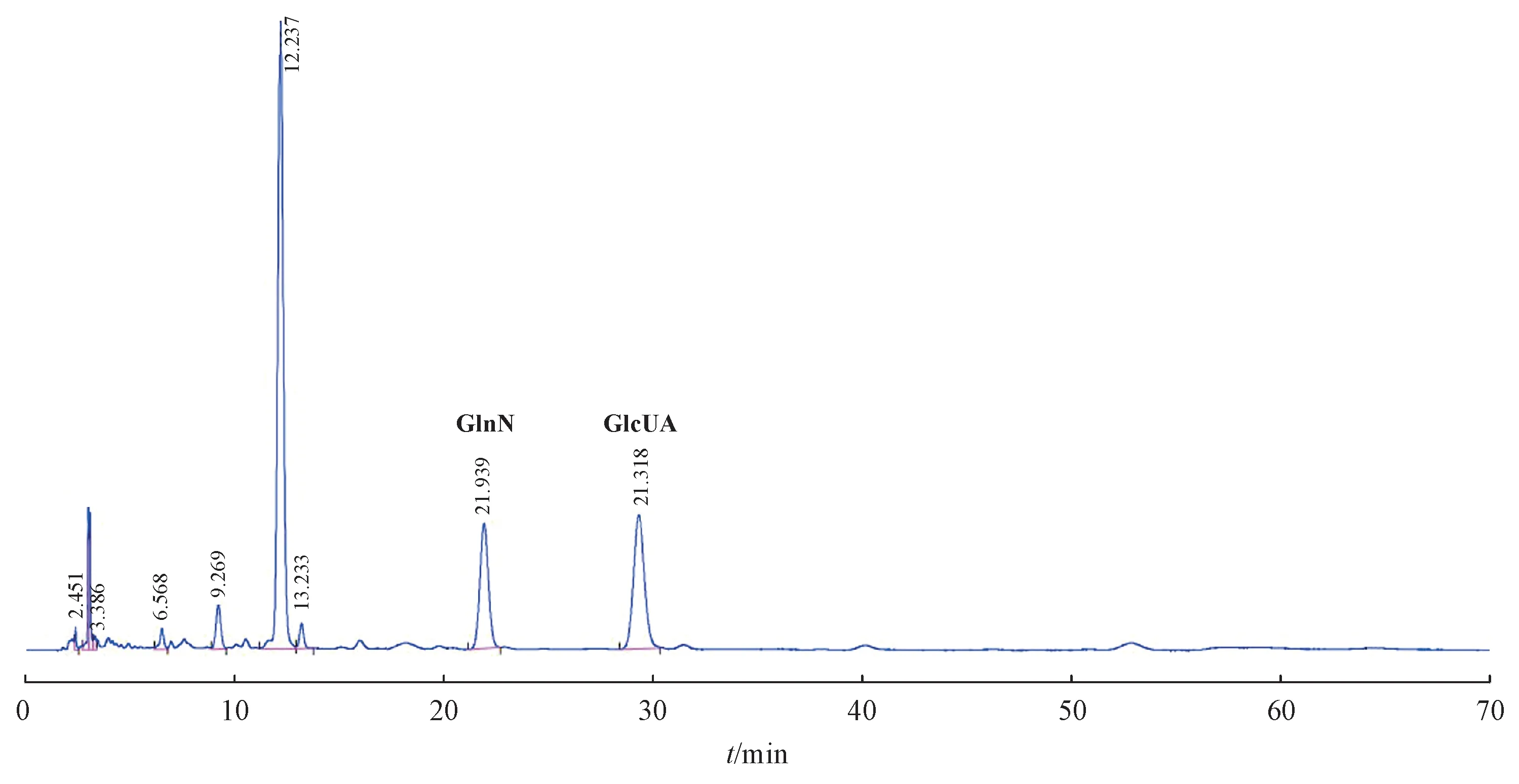
Figure 2 HPLC spectra of PMP derivatives of hyaluronic acid(HA)sample
发酵产物与HA 标准品的红外光谱比对结果显示,两个光谱中的主峰重叠。吸收峰归属如下:3 419.51 cm-1处的宽带可归因于-OH 伸缩振动,2 926.25 cm-1可 归 因 于-CH 伸 缩 振 动,1 652.94 cm-1和1 544.23 cm-1伸缩振动归因于-NHCOCH3基团的存在,1 403.21 cm-1是-COOH 的特征峰,-CO的伸缩振动在1 076.62 cm-1。此外,发酵产物的1H NMR 和峰归属分别见图3 和表3。根据单糖组成分析、FT-IR 谱和1H NMR 谱结果提示,重组菌株产生的产物可鉴定为HA。单糖组成分析中的GlcN 应为GlcNAc 在HA 水解过程中脱乙酰化产生的。综上所述,HA 产生菌Hp8tg(Bacillus subtilisWB800 pSG1729-PmHAS/pHCMC05-tuaD-gtaB)及Pn8tg(Bacillus subtilisWB800 pSG1729-PmHASndk/pHCMC05-tuaD-gtaB)已成功构建。
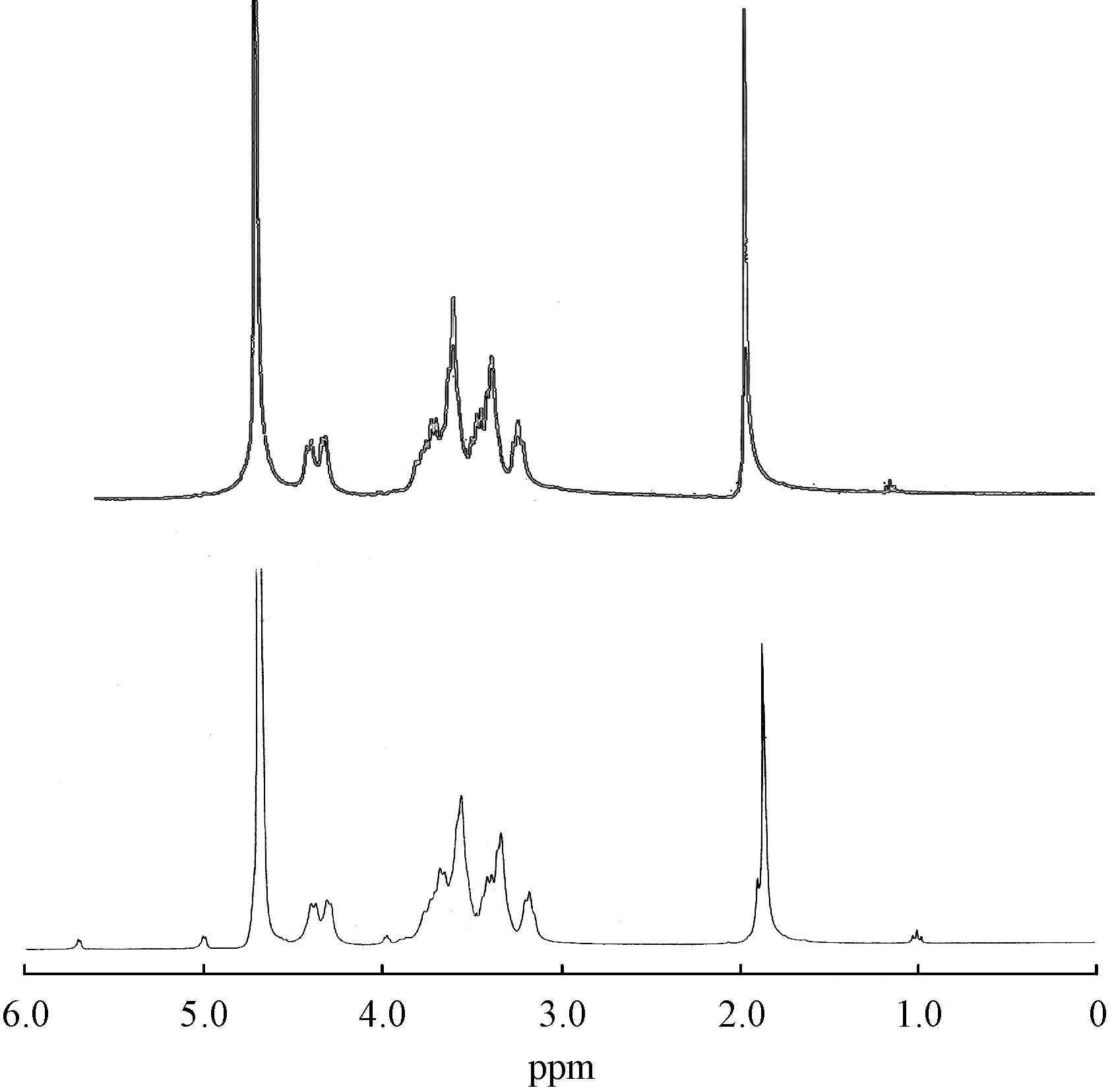
Figure 3 1H NMR spectra of produced HA(A)and standard HA(B)
3.2 核苷二磷酸激酶过表达增加HA 的产量和相对分子质量
由于透明质酸生物合成过程中UDP 的不断产生和单糖前体的大量消耗,ndk基因被引入HA 合成系统。通过定量RT-PCR计算ndk基因的相对转录水平。用木糖诱导后,可以观察到Hp8tg 和Pn8tg 之间ndkmRNA 水平的显著差异(图4-A),证明木糖启动子可以有效控制以及ndk过表达菌株成功构建。
通过测定发酵液的A600来监测Hp8tg 和Pn8tg的生长。如图4-B所示,Pn8tg可以达到比Hp8tg更高的干细胞重量(0.90±0.02 g/L、0.76±0.03 g/L)。此外,Pn8tg 的最大比生长率为(0.57±0.02)h-1,而Hp8tg 的最大比生长率仅为(0.34±0.03)h-1(图4-C)。Hp8tg和Pn8tg的生长结果对比表明,ndk过表达能促进细菌生长。
图4-D 显示两种工程菌株的产量与培养时间呈正相关。在发酵的第1和第3个24 h观察到类似的缓慢增加,在第2个24 h观察到相对急剧的增加。因此,在接下来的研究中选择48 h 作为发酵的终点。结果表明,发酵48 h后,菌株Pn8tg的HA 产量比Hp8tg高33.81%,分别为(321.0±10.2)mg/L和(239.9±11.1)mg/L,这说明ndk基因的过表达使得HA 产量提高了约1.3 倍。HA 的产量和生产率分别为(356.7±11.3)mg/g细胞、(6.7±0.2)mg·L-1·h-1和(315.7 ± 14.6)mg/g 细 胞、(5.0 ± 0.2)mg·L-1·h-1。收集工程菌株不同时间点产生的HA,测定其相对分子质量。图4-E 显示,Pn8tg 在8 h 和12 h 产生的HA 相对分子质量均低于Hp8tg,而在24、36和48 h时,Pn8tg 产生的HA 相对分子质量均较Hp8tg 更高,约提高了1.1 倍。这可能是由于发酵早期Pn8tg 的生长率高于Hp8tg,在此期间,大量UDP-单糖前体被用于细胞生长,导致HA 生物合成过程中可用的UDP-单糖前体减少。两种工程菌株在12 h 获得的HA 相对分子质量均低于8 h,这可能是由于生长率突然上升所致。此外,48 h收集的HA 相对分子质量低于36 h,这与培养时间的延长有利于相对分子质量增加的传统观点相反[8]。考虑到培养基的酸碱度(数据未显示),说明发酵后期相对分子质量增加趋势的反转可归因于培养基酸碱度的升高,因为长期停留在碱性条件下不利于HA相对分子质量的增加。

Table 3 Analysis of 1H NMR of HA sample

Figure 4 Characterization of Hp8tg and Pn8tg(± s,n = 3)
4 讨 论
本研究可以证实,与Ⅰ类透明质酸合成酶类似,UDP 的积累对Ⅱ类透明质酸合成酶Pm⁃HAS也有抑制作用。因此,将核苷二磷酸激酶基因ndk以及透明质酸合成酶基因,包括多杀性巴氏杆菌HA 合酶基因(PmHAS)、4-UDP-葡萄糖焦磷酸化酶基因(gtaB)和UDP-葡萄糖脱氢酶基因(tuaD)共同引入枯草芽孢杆菌细胞中进行过表达,可以促使UDP 转化为UTP,防止UDP 蓄积,同时削弱了Ⅱ类透明质酸合成酶的活性抑制,而UTP 则进一步参与合成HA 的活化单糖前体。不过,可能由于UTP 的浓度升高及其他中间代谢物对PmHAS 的活性也有一定抑制作用,从而造成HA 的产量提高有限。实验结果表明,ndk基因的过度表达可以提高HA 的产量和相对分子质量。其原因包括以下两个方面:一是随着ndk基因过度表达,细胞密度增加;二是NDK 催化UDP向UTP 的转化,解除了UDP 积累对PmHAS 的抑制作用。
总之,本研究首次将ndk基因引入HA 生物合成系统,揭示了UDP 的积累对体内Ⅱ类透明质酸合酶的活性具有抑制作用,从而降低HA 的相对分子质量和产量。因此,可以通过解除副产物抑制效应以及维持细胞间能量平衡的策略来提高目标产物的产量。此外,本研究所提供的策略可为工业化制品产生菌的改良提供参考。

