双环[1.1.1]戊烷衍生物的合成研究进展
黄 雨,张寅生
(正大天晴药业集团股份有限公司,江苏省抗病毒靶向药物研究重点实验室,南京 211100)
双环[1.1.1]戊烷(BCP)是一种具有三维立体结构的桥环骨架,其作为苯环、叔丁基和炔烃的生物电子等排体,已经在药物化学领域得到广泛的应用[1]。一般而言,将BCP基团引入到类药分子当中,会极大的改善它们的理化性质,例如水溶性、细胞膜渗透性和代谢稳定性等[2]。随着BCP 结构应用范围的不断扩展,其合成方法的研究也受到了人们的持续关注。
自1964 年,Wiberg 等[3]首次合成BCP 衍生物以来,人们已经开发出了多种构建BCP 骨架的方法。其中比较具有实用价值和扩展性的方法有两类:一类是双环[1.1.0]丁烷的插碳反应,另一类是[1.1.1]螺浆烷的开环反应。此外,近两年来,人们又发展了一些其他新颖的方法来构建手性或者多取代的BCP 衍生物。这些方法的应用,极大地丰富了BCP 化合物的多样性。本文对上述BCP主要的合成方法和策略进行总结,期望能够为新药研发人员提供参考。
1 双环[1.1.0]丁烷的插碳反应
双环[1.1.0]丁烷的插碳反应是合成BCP 衍生物最早的方法之一,由Wiberg 等[4]于1965 年完成(图1)。他们发现亚甲基卡宾可以与双环[1.1.0]丁烷(1)发生插碳反应生成BCP 化合物2。但是该反应收率较低,仅有1%。随后,Applequist等[5]对该反应条件进行优化,通过二卤卡宾与双环[1.1.0]丁酯(4)反应,能以较好的收率得到BCP衍生物6。然而,由于合成化合物4的路线较长,该方法的应用受到了限制。

Figure 1 Synthetic route of compound 2(A)and compound 6(B)
目前,该方法主要应用于2-取代BCP 衍生物的合成当中。例如,Ma 等[6]和Bychek 等[7]分别以三甲基甲硅烷基2-氟磺酰基-2,2-二氟乙酸酯和三甲基(三氟甲基)硅烷作为二氟卡宾的来源,与双环[1.1.0]丁烷(8)进行插碳反应,合成了系列2,2-双氟取代的BCP衍生物(图2)。
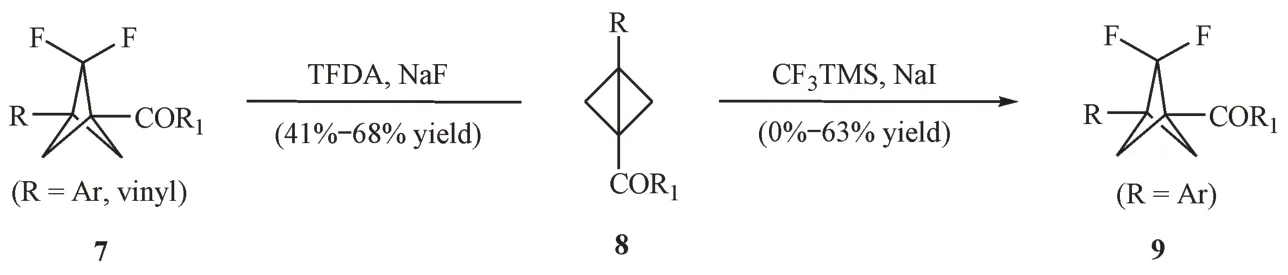
Figure 2 Synthesis of difluoro-substituted bicyclo [1.1.1]pentanes
2 [1.1.1]螺浆烷的开环反应
[1.1.1]螺浆烷的开环反应是合成BCP 衍生物应用最为广泛的方法。[1.1.1]螺浆烷具有很大的环张力[8],其 桥 头C1-C3 中心键的距离只有1.59 Å。基于其特有的结构特征,[1.1.1]螺浆烷也展现出了非常全面的反应性,即无论是自由基、亲核试剂或者亲电试剂,均可以和[1.1.1]螺浆烷发生开环反应[9],这为BCP衍生物的合成提供了广阔的空间。
2.1 [1.1.1]螺浆烷的合成
1982 年Wiberg 等[10]以1,3-二溴双环[1.1.1]戊烷(11)为原料,经分子内偶联反应首次对[1.1.1]螺浆烷(10)进行了合成。然而其收率很低,难于大规模的制备。1985 年,Semmler 等[11]以商品化的1,1-二溴-2,2-二(氯甲基)环丙烷(12)为底物,在甲基锂的作用下,成功地将[1.1.1]螺浆烷的合成收率提高到70%(图3)。值得关注的是,[1.1.1]螺浆烷的稳定性差,在使用它的时候一般需要现制现用。

Figure 3 Synthetic route of [1.1.1]propellane
2.2 自由基介导的开环反应
自由基介导的[1.1.1]螺浆烷开环反应一直以来是人们研究的热点。相关研究表明[12],[1.1.1]螺浆烷中的电荷转移键(中心键)在自由基引发剂的作用下生成双环戊基自由基(具有良好的热力学和动力学稳定性),然后在各种自由基捕获剂的存在下可以得到结构多样的BCP 衍生物。
2.2.1 三乙基硼烷介导下的自由基反应 2018年,Caputo 等[13]报道了三乙基硼烷引发的[1.1.1]螺浆烷与卤代烷的原子转移自由基加成开环反应(图4),成功合成系列BCP 卤化物。随后,作者以BCP 碘代物为原料,先将其锂化,然后成功地进行了多种官能团的转化,这为复杂结构BCP 衍生物的构建奠定了基础。
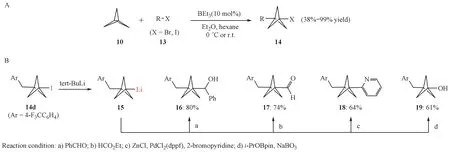
Figure 4 Synthesis of BCP analogues via triethylborane-initiated radical addition
2.2.2 可见光参与的自由基反应 2019 年,Nugent 等[14]首次报道了可见光催化下[1.1.1]螺浆烷与有机卤代烷烃的自由基开环反应。该反应以fac-Ir(ppy)3作为光催化剂,新戊腈作为溶剂,在蓝光照射下得到多种碘代BCP 衍生物。该反应条件温和,收率高,底物适用性广,非常适用于化合物的后期修饰。在此基础上,该课题组[15]发现BCP 碘代物在铁的催化下,可以直接与芳基或杂芳基格氏试剂发生熊田交叉耦合反应,从而高效地制备1,3-双碳基取代的BCP衍生物(图5)。
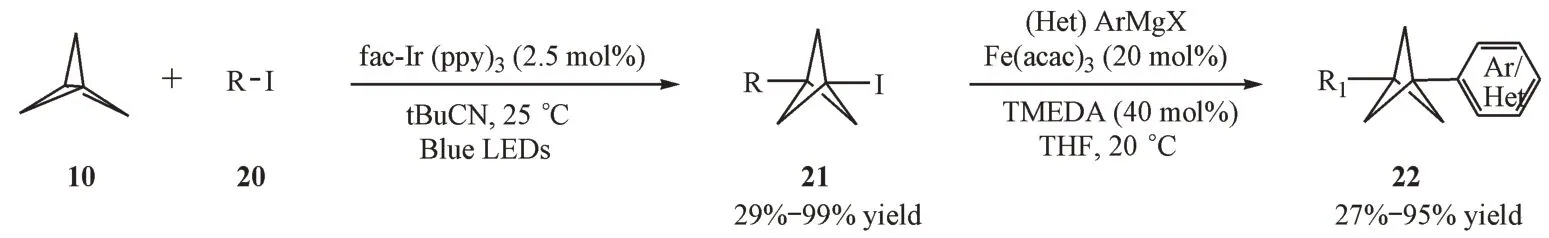
Figure 5 Photoredox-catalyzed radical reaction of organic halides with [1.1.1]propellane
2021年,Shin等[16]发现在可见光催化下,以N-氨基吡啶盐为原料,可以向螺浆烷中同时引入氨基和吡啶环两种官能团(图6)。在该反应过程中,N-氨基吡啶盐优先与乙酸根阴离子形成一个电子供体-受体复合物,从而在无需光催化剂的作用下,可以顺利地与[1.1.1]螺浆烷进行自由基开环反应。虽然该方法存在一定的局限性,例如BCP 基团一般处于吡啶氮原子的对位,但是此通用方法极大地拓展了BCP 的应用场景,具有非常重要的应用价值。
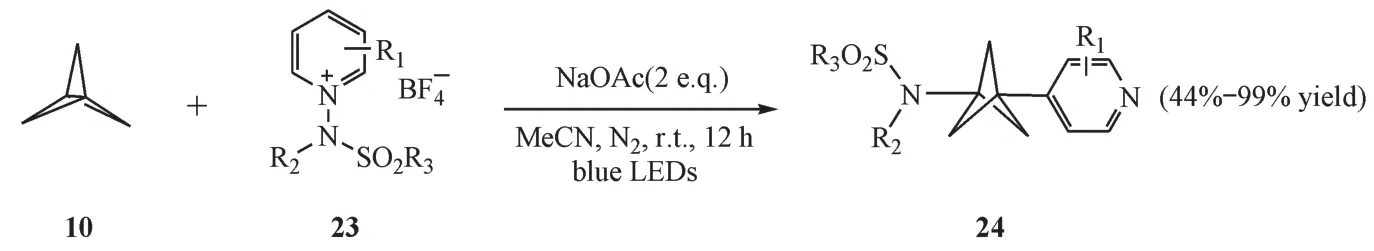
Figure 6 Strain-release aminopyridylation of [1.1.1]propellane
2021 年,Wong 等[17]报道了多催化体系下对[1.1.1]螺浆烷的不对称自由基开环反应,成功合成了一系列α-手性BCP 衍生物(图7)。该反应依次经历了光催化、有机催化和还原性氢原子转移催化过程,实现了在自由基开环过程中对于BCP的α位立体中心构型的控制。
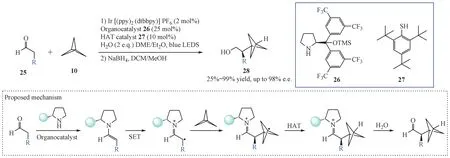
Figure 7 Catalytic asymmetric synthesis of α-chiral BCPs
2.2.3 硅自由基参与的自由基反应 2020 年,Kondo 等[18]报道了硅自由基参与的[1.1.1]螺浆烷的开环反应,并首次向BCP 骨架中同时引入含硅官能团和含硼官能团(图8)。在光照条件下,作者以80%的收率得到硅硼化BCP 衍生物30。随后通过该化合物中C-Si键或(和)C-B 键的转化,合成了结构多样的BCP 衍生物。不过,鉴于有关C-Si 键转化的反应有限,所以该合成砌块在药物化学领域的应用会受到一定的限制。
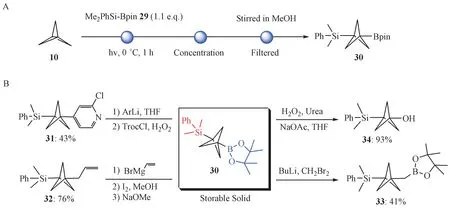
Figure 8 UV-initiated silaboration of [1.1.1]propellane and further applications
2.2.4 多组分自由基开环反应 2017年,Kanazawa等[19]在密度泛函理论(DFT)计算的指导下,利用酰肼作为自由基前体,偶氮二甲酸二叔丁酯作为自由基受体,实现了首例铁催化[1.1.1]螺浆烷的自由基多组分碳胺化反应(图9)。所得产物经过简单的官能团转换,可以转变为3-取代BCP 氨基类化合物。
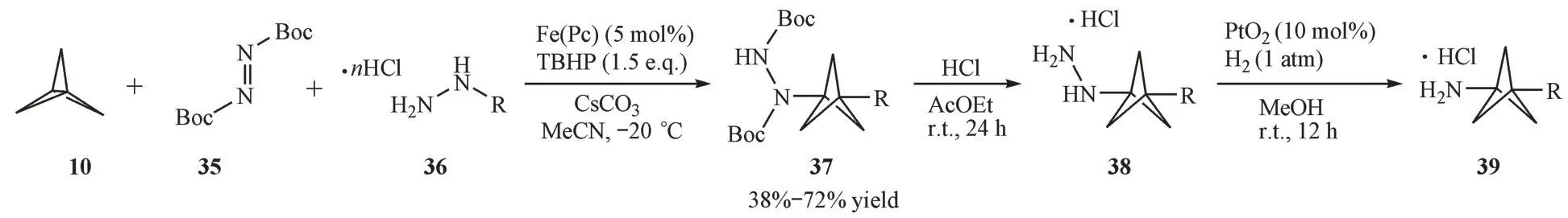
Figure 9 Iron(II)-catalyzed multicomponent carboamination of [1.1.1]propellane
2020 年,Kim 等[20]首次报道了以氮自由基引发的[1.1.1]螺浆烷三组分胺化反应(图10)。作者推测该三组分反应经历了3 个过程:首先,在光催化剂的作用下,产生酰胺基自由基。随后,酰胺基自由基与[1.1.1]螺浆烷发生自由开环反应,生成BCP 自由基。最后,3-酰胺化的BCP 自由基可以和多种试剂发生原子/基团转移反应,从而产生一系列结构新颖的BCP衍生物。
2020年,Zhang等[21]利用光催化下产生的烷基自由基先对[1.1.1]螺浆烷进行开环,然后所产生的BCP 自由基中间体在铜催化剂作用下与各种亲核试剂进行偶联反应(图11)。该方法条件温和,适用于不同类型的烷基自由基前体和多种N,P,S-亲核试剂。

Figure 10 Visible-light-mediated strain-release multicomponent reaction of [1.1.1]propellane with electrophilic nitrogen-radicals
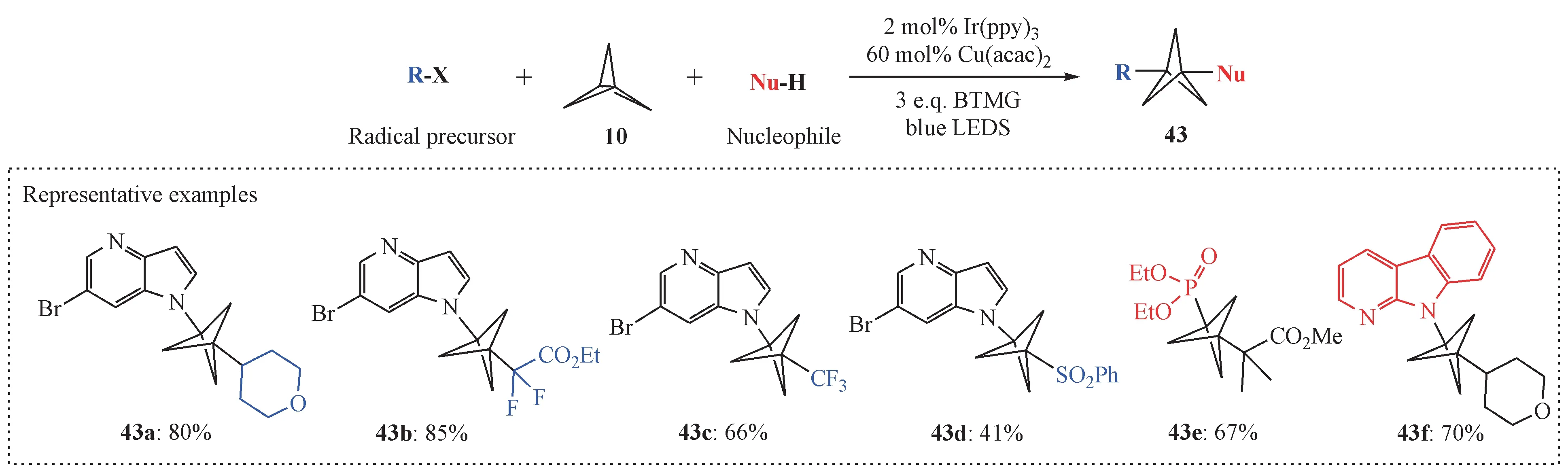
Figure 11 Dual photoredox/coppercatalyzed three-component radical coupling of [1.1.1]propellane
虽然在大多数的情况下,[1.1.1]螺浆烷的自由基开环反应都可以得到理想的反应结果,但是该方法仍存在着一些局限性,例如反应条件要求严格,为了避免产生低聚物,需要严格控制反应的温度和浓度[3]。又如,在一些情况下,需要对[1.1.1]螺浆烷进行进一步纯化才能得到目标产物。此外,自由基开环反应可控性较差,有时候并不能得到预期的产物。例如Wiberg 等[22]发现,底物结构的微小改变会极大影响反应的结果(图12)。
2.3 亲核试剂介导的开环反应
2.3.1 有机锂试剂介导的开环反应 1990 年,Della 等[23]发现1-溴双环[1.1.1]戊烷(44)在叔丁基锂的作用下,通入二氧化碳可以得到化合物46。其反应机制为1-溴双环[1.1.1]戊烷先发生消除反应生成[1.1.1]螺浆烷,然后[1.1.1]螺浆烷在叔丁基锂的作用下开环生成叔丁基双环[1.1.1]戊基锂中间体45,最后在二氧化碳的存在下生成BCP 羧酸化合物(图13)。此外,4,4'-叔丁基联苯锂(LiDBB)和联苯基锂[24]均可以和[1.1.1]螺浆烷发生类似的开环反应。然而有趣的是,很少有报道以苯基锂或者甲基锂对[1.1.1]螺浆烷进行开环反应[25]。
2.3.2 格氏试剂介导的开环反应 格氏试剂介导的[1.1.1]螺浆烷的开环反应相比有机锂试剂而言较为困难。2000年,Messner等[25]发现在35 ℃条件下,以乙醚为溶剂,反应3~7 d,才能够以较高的收率得到3-芳基取代的BCP 溴化镁中间体。在此基础上,Makarov等[26]将反应温度提高至100 ℃,成功地在保持收率的同时将反应时间缩短至3 h之内(图14)。值得一提的是,3-芳基取代的BCP格氏试剂是一种重要的中间体,通过金属催化反应可以构建结构复杂的1,3-二取代的BCP 衍生物[25-27]。
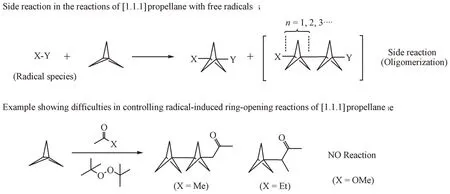
Figure 12 Side reaction in the reactions of [1.1.1]propellane with free radicals
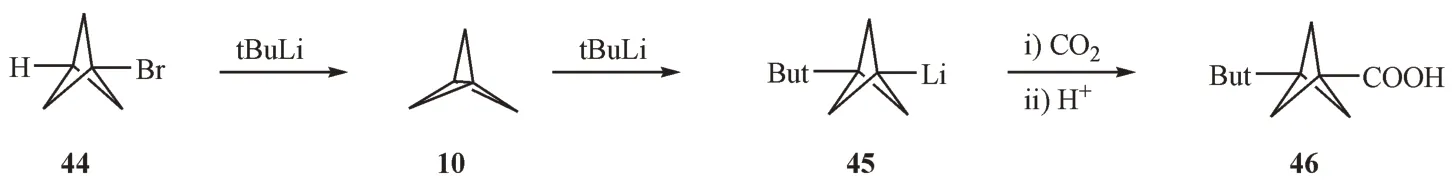
Figure 13 Addition of t-butyllithium to [l.l.l]propellane
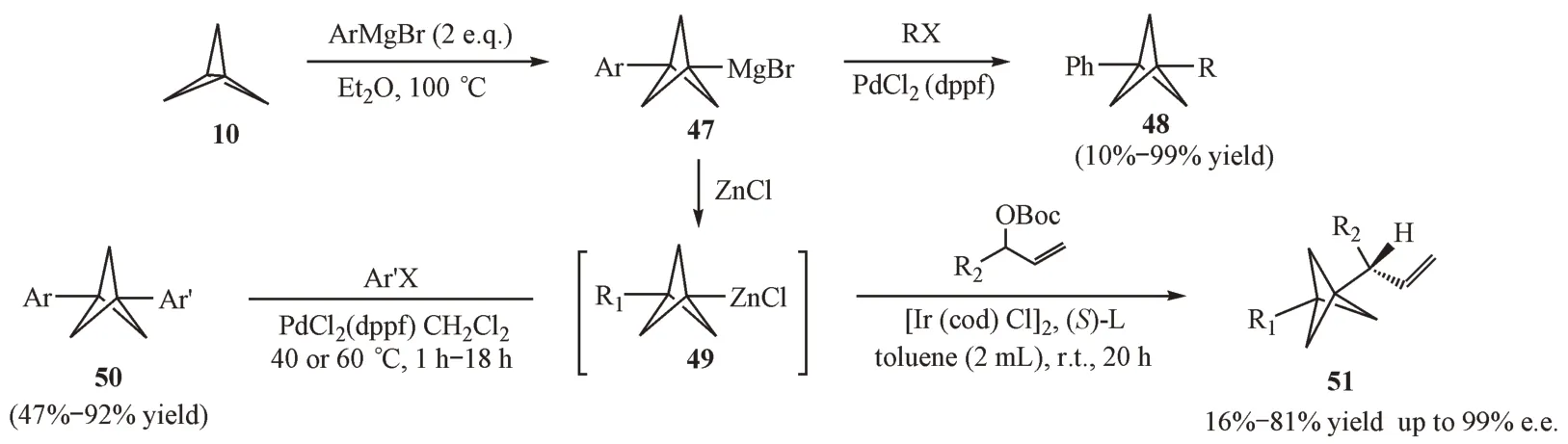
Figure 14 Addition of Grignard reagents to [l.l.l]propellane
2.3.3 涡轮酰胺介导的开环反应 2016 年,Baran 课题组[28]发现,仲胺在i-PrMgCl·LiCl 的作用下先生成相应的“涡轮酰胺”亲核试剂,然后再对[1.1.1]螺浆烷进行开环加成反应,能够以较高的收率得到含有BCP 结构的叔胺类化合物(图15)。利用该方法,可以大规模地制备重要合成砌块双环[1.1.1]戊烷-1-胺(53)。
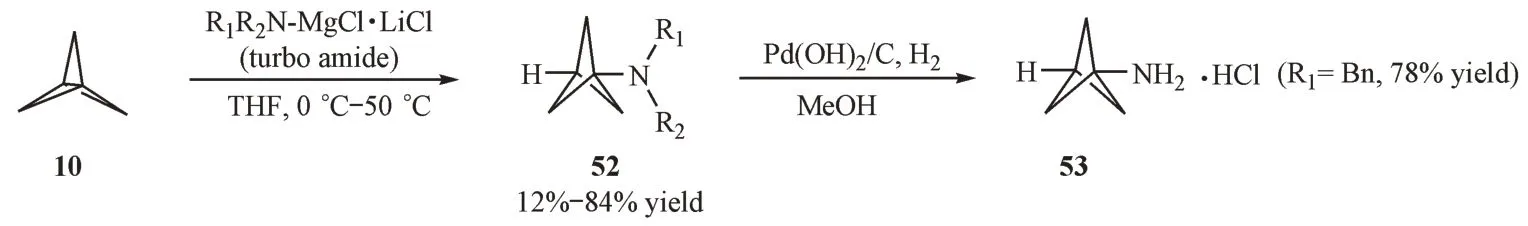
Figure15 Turbo-amide enabled ring opening of [1.1.1]propellane to access mono-substituted bicyclo [1.1.1]pentylamines
2.3.4 有机阴离子介导的开环反应 2018 年,Shelp等[29]发现原位生成的2-氮杂烯丙基阴离子在室温条件下能够快速地和[1.1.1]螺浆烷发生开环加成反应,从而以良好的收率得到BCP 苄基亚胺类化合物(图16)。随后,该课题组又发现在上述反应过程中添加频哪醇硼酸酯,可以顺利地得到BCP 苄亚胺频哪醇硼酸酯[30]。在此基础上,研究人员以醋酸钯为催化剂,实现了BCP 硼酸酯与卤代芳烃或杂芳烃的交叉偶联反应,这为芳基取代BCP衍生物的合成开辟了新的途径。
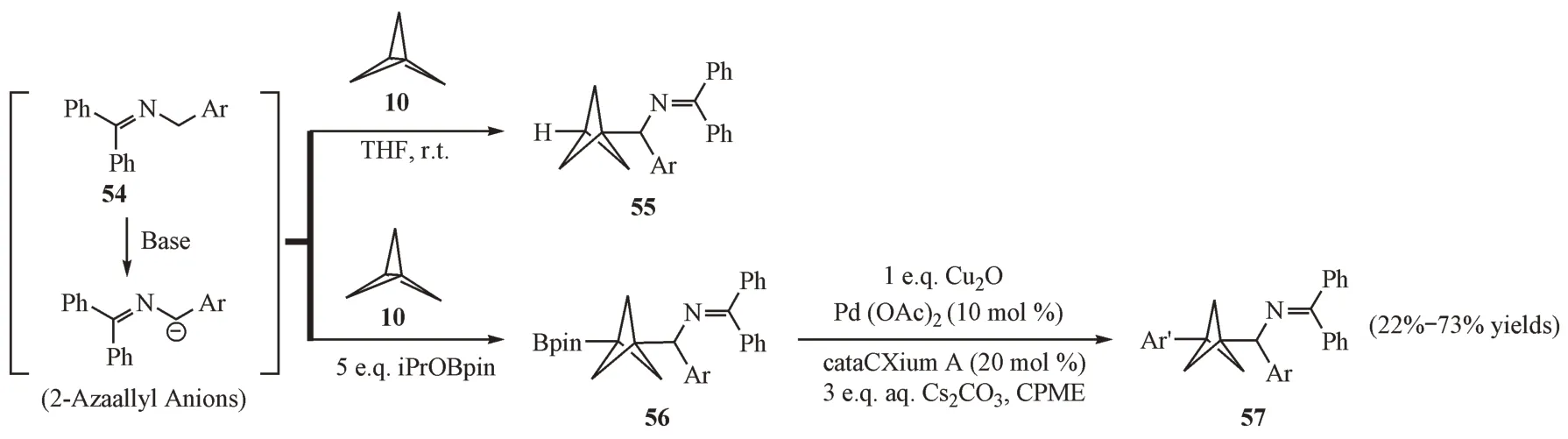
Figure 16 Reactions of 2-aryl-1,3-dithianes and [1.1.1]propellane
2.4 亲电试剂介导的开环反应
亲电试剂与[1.1.1]螺浆烷的反应特别的迅速,一般会生成四元开环产物。这是因为BCP 阳离子中间体不稳定,很容易发生重排反应。但是,Wiberg 等[31]发现3-碘取代的BCP 阳离子却相对稳定,可以相继和一些亲核试剂反应(图17)。
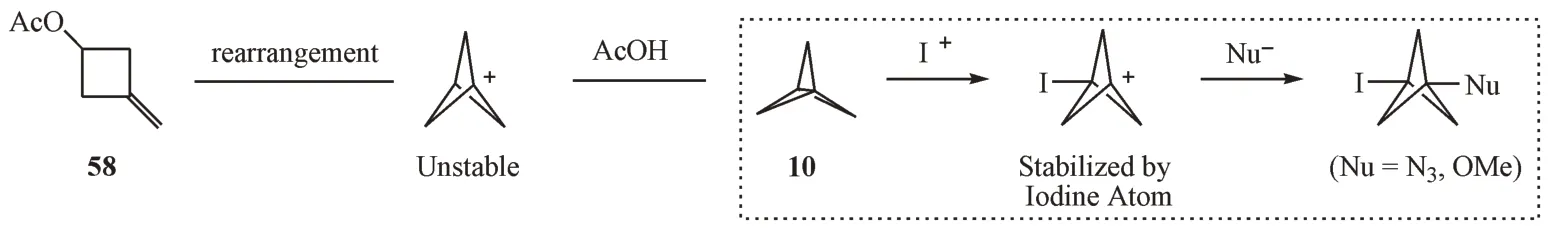
Figure 17 Reactions of [1.1.1]propellane with cationic species
3 其他合成方法
3.1 铑催化的BCP桥头C-H键官能团化
2020 年,Garlets 等[32]报道了通过双铑手性催化剂Rh2(S-TCPTAD)4合成α-手性BCP 分子的创新方法(图18)。研究表明,在该反应体系中,双铑催化剂可以选择性地活化3位的碳氢键,从而对其进行官能团化。
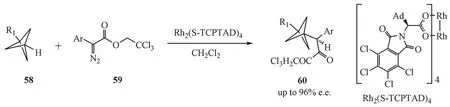
Figure 18 Enantioselective C-H functionalization of bicyclo [1.1.1]pentanes
3.2 2-亚甲基取代[1.1.1]螺浆烷的开环反应
2020 年,Zhao 等[33]以1,3-二氯丙酮为起始原料,经过4 步反应得到了2-亚甲基侧链取代的[1.1.1]螺浆烷中间体63(图19-A)。该化合物的中心键和[1.1.1]螺浆烷类似,也具有非常大的张力。基于该中间体,研究人员合成了多个极具应用价值的合成砌块,并成功地将其应用到药物化学之中。Ma 等[34]基于相似的中间体,以“涡轮酰胺”亲核试剂对其进行开环,合成了系列1-二烷基氨基-2-烷基双环-[1.1.1]戊烷衍生物(图19-B)。虽然此类方法有些冗长,但是这为1,2-或者1,2,3-取代的BCP 衍生物的合成提供了一条非常行之有效的策略,相信在不久的将来会得到广泛的应用。
3.3 分子内偶联环化反应
2021 年,Yang 等[35]通过分子内偶联环化的策略,成功地合成了多种具有挑战性的2-亚甲基取代的BCP 硼酸酯衍生物(图20-A)。值得一提的是,通过硼酸酯的简单转化,可以得到许多复杂的2-亚甲基取代的BCP衍生物(图20-B)。

Figure 19 Synthesis of 1,2-difunctionalized bicyclo [1.1.1]pentanes
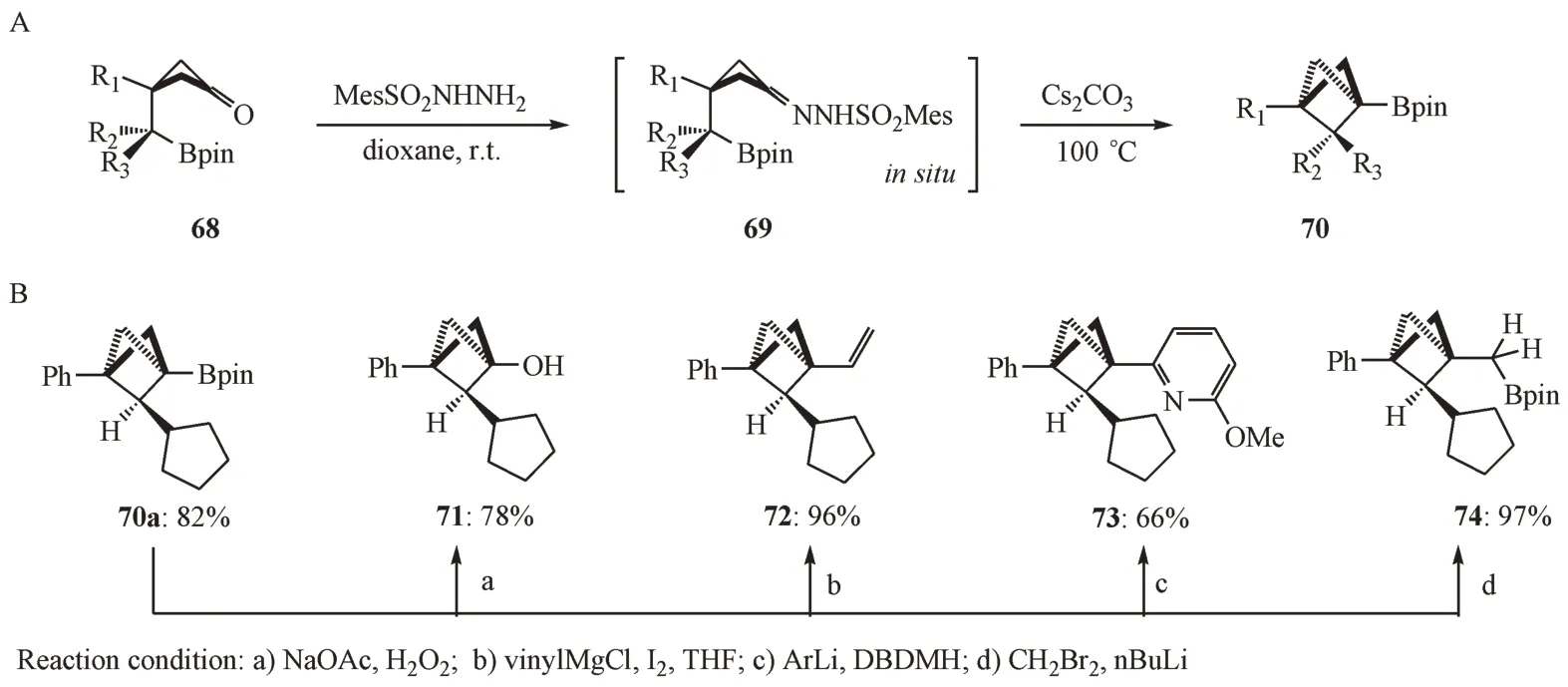
Figure 20 Synthesis of BCP analogues via intramolecular cyclization
4 结 语
总之,BCP衍生物的合成已经取得了很大的进展,特别是[1.1.1]螺浆烷开环反应的开发,极大地推动了BCP 结构在药物化学中的应用。然而不可否认,目前的合成方法仍然存在着底物适用性差、反应条件苛刻等缺陷。未来,研究人员可以将一些新兴的技术方法(如电化学等)应用到BCP 衍生物的合成当中。此外,如何从现有的BCP 分子砌块出发,构建结构复杂的BCP 衍生物也值得进一步关注。

