蛋白酶对鹿血成分及抗运动疲劳作用的影响
杜小琴,张小琴,夏炎,张万超,梁正杰,吴中宝
(重庆市药物种植研究所,特色生物资源研究与利用川渝共建重点实验室,南川 408435)
持续性运动疲劳不仅影响正常生活,还会导致内分泌紊乱、免疫力下降,甚至出现器质性疾病,威胁身体健康[1]。目前对天然抗疲劳肽的研究多集中于从动植物身上提取得到的活性物质,鹿血、西洋参[2]、玉米[3]、红芪[4]、牡蛎、带鱼、刺参、海参等均为天然抗疲劳肽来源。鹿血为鹿科动物梅花鹿或马鹿的膛血或茸血。前人研究发现鹿血经酶解后可提高其抗疲劳作用,能显著增加小鼠负重游泳时间[5],降低代谢产物乳酸、丙二醛、血尿氮的水平[6],但目前有关不同蛋白酶种类对鹿血抗运动疲劳作用的影响研究还鲜见报道。鹿血酶解后的抗运动疲劳作用与其含有的多肽分子质量[7]、含量、结构等有关,与其氨基酸的组成也有关,然而目前相关的研究报道较少,因此研究不同蛋白酶处理对鹿血成分及抗运动疲劳作用的影响。
关于提高鹿血抗运动疲劳作用的水解用酶,韩欢胜等[8]利用中性蛋白酶、木瓜蛋白酶、碱性蛋白酶和胰蛋白酶对鹿血进行酶解处理,发现碱性蛋白酶处理后的鹿血具有较强的自由基清除率能力;邸多隆等[9]认为胶原蛋白酶和菠萝蛋白酶处理鹿血能明显增加小鼠力竭游泳时间。
前期研究中,项目组利用动物蛋白酶处理鹿血粉,结果发现酶解6 h后的鹿血酶解物具有较强的抗运动疲劳活性,但未对其他酶解时间的鹿血酶解物进行抗运动疲劳活性评价,为了对比分析其他种类蛋白酶经不同酶解时间处理后对鹿血酶解液成分及抗运动疲劳作用的影响,项目组以鹿血粉为原料,利用木瓜蛋白酶、中性蛋白酶、碱性蛋白酶及其复合酶,经不同酶解时间(3、6、12 h)处理鹿血,采用高效液相色谱法分析蛋白酶处理对鹿血成分的影响,通过酶解物给药后对小鼠力竭游泳时间、肝糖原含量、肌乳酸含量及血尿氮含量的影响分析蛋白酶处理对鹿血抗运动疲劳作用的影响,以期为鹿血的合理利用及抗疲劳产品开发提供理论依据。
1 材料与方法
1.1 材料
鹿血粉为梅花鹿(Cervusnippon)膛血的真空冷冻干燥粉(鹿血与鹿血粉的质量比为5∶1),吉林省吉鹿源生物科技有限公司;木瓜蛋白酶(活性为800 U/mg)、中性蛋白酶(活性为200 U/mg)、碱性蛋白酶(活性为200 U/mg)、复合酶(木瓜蛋白酶、中性蛋白酶、碱性蛋白酶,质量比为1∶1∶1),南宁庞博生物工程有限公司;实验动物:SPF级雄性昆明小鼠,4~6周龄,体质量22~25 g,湖南斯莱克景达实验动物有限公司(许可证号:SCXK(湘)2019-0004);血尿氮试剂盒(产品编号:C013-1-1)、乳酸测定试剂盒(产品编号:A019-2-1)、肝糖原试剂盒(产品编号:A043-1-1),均购自南京建成生物工程研究所有限公司。
Agilent 1260(Ⅱ)高效液相色谱仪,美国安捷伦科技有限公司;DXFT-12型精研混炼机,山东鼎信超微粉碎技术有限公司;PT3502A型酶标仪,北京普天新桥技术有限公司;TGL-16C型离心机,上海安亭科学仪器有限公司;铅皮:宽9 mm,厚0.8 mm。
1.2 方法
1.2.1 酶解 在预试验基础上略作修改。鹿血粉经精研混炼机粉碎,粉碎时间25 min,粉碎温度-19~-13℃。鹿血粉中加入5倍质量的蒸馏水搅拌均匀,按照4 g/L的比例加入蛋白酶,搅拌水浴酶解,90 ℃灭酶20 min,之后冷却至20 ℃,真空抽滤,得鹿血酶解液,蒸发挥去水分,低温干燥得固体粉末,4 ℃保存。

表1 4种蛋白酶酶解条件
1.2.2 HPLC成分分析 色谱条件:色谱柱Cosmosil PBr(4.6×250 mm,5 μm),流动相为0.05%三氟乙酸水溶液(A),-80%乙腈/0.05%三氟乙酸水溶液(B),梯度洗脱程序为:0~5 min 5% B,5~40 min 5%~60% B,40~53 min 60% ~100% B,53~60 min 100% ~5% B,柱温25 ℃,流速1.0 mL/min,检测波长220 nm,进样量5 μL。
样品的处理:精密称取粉末25 mg,置25 mL容量瓶中,加水至刻度摇匀,过滤,取滤液,用0.45 μm微孔滤膜过滤即得。
1.2.3 动物试验
1.2.3.1 给药 雄性昆明小鼠84只,分为6组,每组14只。选用时间为6 h的酶解产物给药,第1组为生理盐水(CK),第2组为鹿血粉(未酶解,处理Ⅰ),第3组为木瓜蛋白酶(处理Ⅱ),第4组为中性蛋白酶(处理Ⅲ),第5组为碱性蛋白酶(处理Ⅳ),第6组为复合酶(处理Ⅴ)。各组小鼠自由进食、进水2 d后开始给药。第2~6组供试品质量浓度均为20 mg/mL,每天下午6点灌胃给药,剂量为150 mg/kg,第1组灌胃给同剂量的生理盐水,并自由进食和进水。连续给药10 d后每组取7只进行强迫负重游泳力竭试验,另外7只进行血尿氮、乳酸、肝糖原含量测定。
《中药大辞典》[10]中鹿血的人体(60 kg)剂量为:(3~6)g,根据人与实验动物药物剂量的换算方法可算出小鼠(20 g)的剂量为:(1.82~3.64)mg,本试验选择了3 mg。
1.2.3.2 负重游泳力竭试验 参照LIU J 等[11]的方法,略有改动。末次给药30 min后,每只小鼠称质量,鼠尾根部负重小鼠体质量5%的铅皮,置于水深为30 cm的游泳箱中,每组一箱,水温25 ℃,计时器计记录小鼠自开始游泳到力竭的时间,小鼠头不能伸出水面持续10 s以上即为力竭。
1.2.3.3 肝糖原、肌乳酸的测定 末次给药30 min后,每只小鼠称质量,鼠尾根部负重小鼠体质量5%的铅皮,置于水深为30 cm的游泳箱中,每组一箱,水温25 ℃,计时器计时,游泳时间达到10 min时停止游泳,立即处死小鼠,取小鼠肝脏和后腿肌肉,并精确称质量,按试剂盒提供的测定方法测定肝糖原和肌乳酸。
1.2.3.4 血尿氮的测定 小鼠末次给药30 min后,置于水深30 cm的游泳箱中不负重游泳,水温调节至29 ℃,不断搅动水面,避免小鼠处于漂浮状态。计时器计时,游泳时间达到75 min后,停止游泳,立即心脏取血0.2~0.3 mL,2 000 r离心10 min,取血浆,按试剂盒提供的测定方法测定血尿氮。
1.3 数据处理
各组试验均重复3次以上,采用SPSS软件进行显著性检验,以P<0.05 为差异有统计学意义。采用origin 2017软件作图。
2 结果与分析
2.1 蛋白酶处理对鹿血成分的影响
木瓜蛋白酶、中性蛋白酶、碱性蛋白酶、复合酶分别处理鹿血3、6、12 h后的HPLC色谱图如图1-4所示。由图可知,在该色谱条件下鹿血酶解物的色谱峰较多,木瓜蛋白酶酶解物可较好地分布在12.547~31.387 min的保留时间范围内,中性蛋白酶酶解物可较好地分布在10.648~31.461 min的保留时间范围内,碱性蛋白酶酶解物可较好地分布在10.786~32.170 min的保留时间范围内,复合酶酶解物可较好的分布在10.763~32.220 min的保留时间范围内。不同种类的蛋白酶酶解处理后,鹿血的HPLC色谱峰差异较大,同种蛋白酶不同酶解时间处理后,鹿血的HPLC色谱峰差异较小。

A:酶解3 h;B:酶解6 h;C:酶解12 h。A:Hydrolysis for 3 hours;B:Hydrolysis for 6 hours;C:Hydrolysis for 12 hours.图1 木瓜蛋白酶处理对鹿血成分的影响Figure 1 Effects of papain treatment on chemical composition of Cervus nippon blood
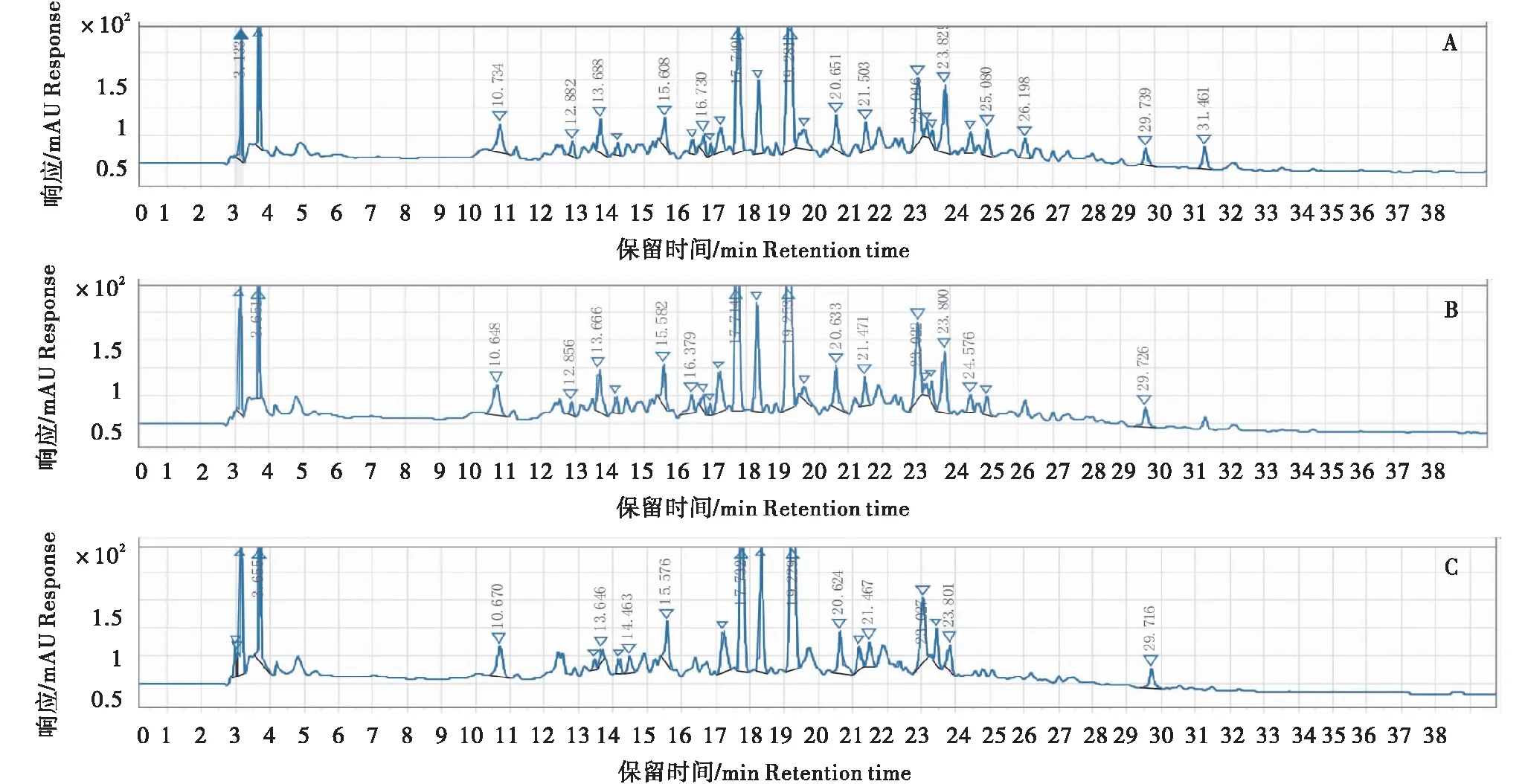
A:酶解3 h;B:酶解6 h;C:酶解12 h。A:Hydrolysis for 3 hours;B:Hydrolysis for 6 hours;C:Hydrolysis for 12 hours.图2 中性蛋白酶处理对鹿血成分的影响Figure 2 Effects of neutral protease treatment on chemical composition of Cervus nippon blood

A:酶解3 h;B:酶解6 h;C:酶解12 h。A:Hydrolysis for 3 hours;B:Hydrolysis for 6 hours;C:Hydrolysis for 12 hours.图3 碱性蛋白酶处理对鹿血成分的影响Figure 3 Effects of alkaline protease treatment on chemical composition of Cervus nippon blood
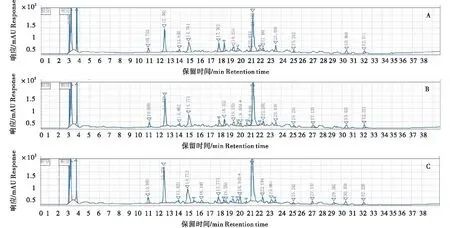
A:酶解3 h;B:酶解6 h;C:酶解12 h。A:Hydrolysis for 3 hours;B:Hydrolysis for 6 hours;C:Hydrolysis for 12 hours.图4 复合酶处理对鹿血成分的影响Figure 4 Effects of compound enzyme treatment on chemical composition of Cervus nippon blood
2.2 蛋白酶处理给药对小鼠力竭游泳时间的影响
水温和负重可明显影响小鼠的力竭游泳时间[12-13],通过预试验,本试验采用5%负重,水温控制在25 ℃,可使各组小鼠的力竭游泳时间控制在10~20 min。由图5可知,以碱性蛋白酶处理鹿血连续给药10 d后,小鼠负重游泳时间(18.22±2.97)min比对照组(10.47±1.79)min多74.02%,差异极显著(P<0.01).与对照组相比,中性蛋白酶处理鹿血给药可显著提高小鼠负重游泳时间(P<0.05),而鹿血粉和木瓜蛋白酶、复合酶处理鹿血给药在提高小鼠力竭游泳时间上差异均不显著(P>0.05)。
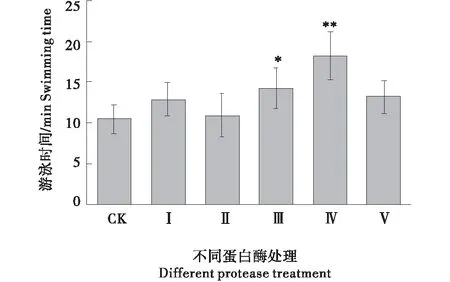
*:表示差异显著;**表示差异极显著;CK、Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ分别表示对照(生理盐水)、鹿血粉、木瓜蛋白酶、中性蛋白酶、碱性蛋白酶及复合蛋白酶处理。*:Refer to significant difference;**:Refer to extremely significant difference;CK、Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ denote normal saline(CK),deerblood powder,papain,neutral protease, alkaline protease and compound enzyme treaments respectivity.图5 蛋白酶处理给药对小鼠力竭游泳时间的影响Figure 5 Effects of protease treatment on swimming time in mice of Cervus nippon blood
2.3 蛋白酶处理给药对小鼠肝糖原含量的影响
糖是肌肉活动能量的重要来源,高强度运动中的体力耗竭总是和肌糖原的耗竭同时发生。肌糖原消耗的同时,为维持血糖水平,肝糖原储备减少。由图6可知,以鹿血粉和木瓜蛋白酶、碱性蛋白酶处理鹿血连续给药10 d后,小鼠肝糖原含量分别比对照组(8.59±1.99 mmol/L)多88.82%、94.88%、90.45%,差异均为极显著(P<0.01)。与对照组相比,中性蛋白酶、复合酶处理鹿血给药在提高小鼠肝糖原含量上差异均不显著(P>0.05)。由此说明鹿血粉和木瓜蛋白酶、碱性蛋白酶处理鹿血可以通过增加肝糖原储备或减少运动时肝糖原的消耗,为机体提供更多的能量,从而达到抗疲劳的效果。
2.4 蛋白酶处理给药对小鼠肌乳酸含量的影响
剧烈运动时,机体相对缺氧,糖酵解加快,产生大量乳酸,当肌肉乳酸消除速度低于积累速度时,乳酸积累导致疲劳。因此减少乳酸的产生或加速乳酸的清除,都可以起到抗疲劳的作用。由图7可知,以中性蛋白酶、复合酶处理鹿血连续给药10 d后,小鼠乳酸含量(1.06±0.57、1.10±0.62 mmol/L)分别比对照组(1.84±0.35 mmol/L)少42.39%、40.22%,差异均为极显著(P<0.01).与对照组相比,碱性蛋白酶处理鹿血给药可显著降低小鼠乳酸含量(P<0.05),而鹿血粉和木瓜蛋白酶、中性蛋白酶处理鹿血给药在降低小鼠乳酸含量上差异均不显著(P>0.05).
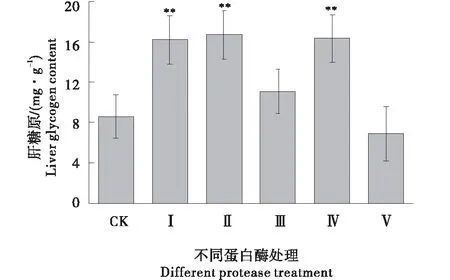
*:表示差异显著;**表示差异极显著;CK、Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ分别表示对照(生理盐水)、鹿血粉、木瓜蛋白酶、中性蛋白酶、碱性蛋白酶及复合蛋白酶处理。*:Refer to significant difference;**:Refer to extremely significant difference;CK、Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ denote normal saline(CK),deerblood powder,papain,neutral protease, alkaline protease and compound enzyme treaments respectivity.图6 蛋白酶处理给药对小鼠肝糖原含量的影响Figure 6 Effects of protease treatment on liver glycogen content in mice of Cervus nippon blood

*:表示差异显著;**表示差异极显著;CK、Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ分别表示对照(生理盐水)、鹿血粉、木瓜蛋白酶、中性蛋白酶、碱性蛋白酶及复合蛋白酶处理。*:Refer to significant difference;**:Refer to extremely significant difference;CK、Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ denote normal saline(CK),deerblood powder,papain,neutral protease, alkaline protease and compound enzyme treaments respectivity.图7 蛋白酶处理给药对小鼠乳酸氮含量的影响Figure 7 Effects of protease treatment on DL-lactic acid content in mice of Cervus nippon blood
2.5 蛋白酶处理给药对小鼠血尿氮含量的影响
长时间运动后,机体不能通过糖、脂肪分解代谢获得足够的能量时,蛋白质和氨基酸分解代谢加强,血尿氮水平升高,运动后血尿氮水平越高说明运动适应性越差。由图8可知,与对照组相比,鹿血粉和中性蛋白酶、碱性蛋白酶处理鹿血给药均可显著降低小鼠血尿氮含量(P<0.05),而木瓜蛋白酶、复合酶处理鹿血给药在降低小鼠血尿氮含量上差异均不显著(P>0.05).由此说明鹿血粉和中性蛋白酶、碱性蛋白酶处理鹿血可明显提高小鼠的运动适应性。

*:表示差异显著;**表示差异极显著;CK、Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ分别表示对照(生理盐水)、鹿血粉、木瓜蛋白酶、中性蛋白酶、碱性蛋白酶及复合蛋白酶处理。*:Refer to significant difference;**:Refer to extremely significant difference;CK、Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ denote normal saline(CK),deerblood powder,papain,neutral protease, alkaline protease and compound enzyme treaments respectivity.图8 蛋白酶处理给药对小鼠血尿氮含量的影响Figure 8 Effects of protease treatment on blood urea nitrogen content in mice of Cervus nippon blood
3 讨论与结论
负重游泳力竭试验是用来评价药物或食物抗运动疲劳作用的常用试验模型[14],为了进一步确认蛋白酶处理鹿血给药对小鼠运动耐力的影响,试验使用另外一组小鼠(每组10只),在负重3.00%,水温29℃条件下进行负重游泳力竭试验,结果表明碱性蛋白酶处理鹿血给药组小鼠的负重游泳时间为(174.50±18.18)min,中性蛋白酶组为(150.00±15.94)min,比对照组分别长1.04、0.62倍,差异极显著(P<0.01),这与负重5.00%,水温25 ℃条件所得结果类似,说明了碱性蛋白酶、中性蛋白酶处理鹿血可明显增强小鼠的运动耐力,这可能与碱性蛋白酶、中性蛋白酶酶解物的抗氧化活性较高有关[8,15-16]。能量耗竭、代谢产物蓄积和氧化应激是目前疲劳产生机制的主流学说[13]。机体在运动时需氧量会增加,出现供血不足,心肌细胞会出现缺血缺氧的现象,大量自由基由此产生,出现运动性氧应激反应等症状,导致运动疲劳[17]。鹿血血红蛋白酶解后可产生不同分子量的肽段、氨基酸等物质,多肽的抗氧化活性与氨基酸种类或极性相关[18],HPLC成分分析表明,不同种类的蛋白酶酶解处理后,鹿血酶解物的HPLC色谱峰差异较大,即鹿血不同蛋白酶酶解物中肽段分子量、氨基酸种类等差异较大,这就导致了鹿血不同蛋白酶酶解物抗氧化活性的差异。
通过对比单一酶处理和复合酶处理给药对鹿血抗运动疲劳作用的影响,结果表明复合酶处理鹿血给药组仅在降低小鼠乳酸含量上与单一的木瓜蛋白酶、碱性蛋白酶处理给药组差异显著,这可能与酶解鹿血肽的氨基酸模式有一定相关性[19-20],在木瓜蛋白酶处理鹿血多肽中,必须氨基酸为总氨基酸的55.34%,是一种理想的运动蛋白;支链氨基酸为总氨基酸的21.9%[6],支链氨基酸一方面可促进运动的能量储备和利用,另一方面能通过竞争性抑制而减少5-羟色胺的合成,有助于延缓疲劳的出现[21]。
根据上述试验结果,对力竭游泳时间和3个生化指标的阳性率进行统计,碱性蛋白酶处理鹿血在力竭游泳时间、肝糖原、肌乳酸和血尿氮4个指标为阳性;中性蛋白酶处理鹿血在力竭游泳时间、肌乳酸和血尿氮3个指标为阳性;鹿血粉(未酶解)在肝糖原、血尿氮2个指标为阳性;复合酶处理鹿血肌乳酸1个指标为阳性;木瓜蛋白酶处理鹿血在肝糖原1个指标为阳性。由此可知在供试的4种蛋白酶中,碱性蛋白酶处理鹿血具有较好的抗疲劳作用,其次为中性蛋白酶。
本试验对比分析4种蛋白酶经不同酶解时间处理后对鹿血酶解液成分及抗运动疲劳作用的影响,结果表明不同种蛋白酶酶解处理后,鹿血的HPLC色谱峰差异较大,导致了抗运动疲劳作用的差异。供试的4种蛋白酶中,碱性蛋白酶处理鹿血具有较好的抗疲劳作用,其次为中性蛋白酶。该结果可为鹿血不同蛋白酶酶解物对小鼠的抗运动疲劳作用提供依据。

