不同饵料对拟穴青蟹生长、酶活性及生化指标的影响
苏贵森,肖国强,蔡景波,张 翔,黄晓林,蔡西栗,蔡逸龙,柴雪良*
(1.上海海洋大学水产科学国家级实验教学示范中心,上海 201306; 2. 浙江省海洋水产养殖研究所; 浙江省近岸水域生物资源开发与保护重点实验室;温州市海洋生物遗传育种重点实验室,浙江 温州 325005; 3.平阳县农业农村局,浙江 温州 325400)
引 言
拟穴青蟹(Scyllaparamamosain)简称青蟹,属于甲壳纲(Crustacea),十足目(Detapoda),梭子蟹科(Portunidae),青蟹属(Scylla)。2019年养殖产量超过16万t,占海水养殖蟹类的一半以上[1]。在我国,青蟹养殖的种类主要是拟穴青蟹,其养殖产量占青蟹养殖产量的90%以上[2]。目前,我国青蟹的养殖模式仍以池塘养殖为主,因大量冰鲜饵料的投喂导致水域环境恶化。近年来,蟹公寓等集约化、高密度的设施化养殖方式开始出现。因设施化养殖可以实现环境调控,降低外部风险,提高养殖效率,具有立体化、规模化、集约化等优点,因此是青蟹绿色高效养殖的发展方向。
传统养殖模式下拟穴青蟹配合饲料开发与替代的研究已有报道,例如,周凡等[3]的实验结果证明了配合饲料在拟穴青蟹池塘养殖中具有可行性。董兰芳等针对拟穴青蟹的配合饲料进行了大量的水桶养殖实验,得出了青蟹配合饲料中蛋白质[4],碳水化合物[5],脂肪[6],铁[7]等重要元素的适宜添加水平。王悦等[8]在循环水单体养殖条件下进行青蟹蛋白质和脂肪需求的研究,结果显示青蟹饲料中最适蛋白质和脂肪水平分别为42%~46%和6%~10%,对后续设施化条件下全价饲料的开发具有重要意义。
本研究以两种配合饲料(青蟹配合饲料、鳗鱼饲料)及常用动物性饵料(杂鱼和缢蛏)投喂拟穴青蟹,在“蟹公寓”设施化条件下,比较不同饵料对其生长性能及消化酶活力的影响,为设施化条件下的青蟹养殖提供技术支撑。
1 材料与方法
1.1 实验材料
1.1.1 实验动物及养殖设施
实验在浙江省海洋水产养殖研究所清江基地进行。室内组装4栋蟹公寓,每栋蟹公寓由60个蟹盒组成。蟹盒尺寸为40 cm×30 cm×20 cm,每个蟹盒养殖一只青蟹。每栋蟹公寓独立进出水,进水水质保持一致。拟穴青蟹采自浙江省乐清市清江镇,平均质量(52.9±4.9) g,于蟹公寓暂养1周。每日18时前换水,清理残饵粪便;18时,投喂鲜活低值贝类;21时半至次日6时,开启进水阀门,保持常流水,水流速0.2 L·min-1;6时至18时静水养殖,减少青蟹的应激。暂养期间,水温为23.9±1.2℃,pH 7.8±0.2,盐度22.1±0.5,溶解氧7.8±0.3 mg L-1。每天观察青蟹的摄食情况和活动情况。
1.1.2 饵料制备
实验设置4种饵料(见表1):青蟹配合饲料(天邦全熟化配合饲料,crab compound feed,CF)、活缢蛏(Sinonovaculaconstricta,SC)、杂鱼(鲢,Hypophthalmichthysmolitrix,HM)、鳗鱼饲料(健马牌幼鳗配合饲料,eel feed, EF)。根据拟穴青蟹幼蟹的摄食特点,饲料应为粒径≤3 mm的沉性颗粒饲料。将鳗鱼饲料加水和羧甲基纤维素钠,放入小型电动挤压颗粒机,制成鳗鱼饲料颗粒,之后放入烘箱60 ℃烘干至含水量小于10%,自然冷却后密封冷藏备用。

表1 四种饵料的常规营养成分
1.2 实验方法
1.2.1 实验设计及养殖管理
选取规格相近、活力较好的拟穴青蟹240只(雄蟹120只,雌蟹120只),随机分成4组,每组投喂1种饵料。每种饵料实验组设3个重复,每个重复20只青蟹,共计60只(雄蟹30只,雌蟹30只)。养殖管理同暂养期间一致。养殖于2019年9月7日开始,共进行56 d。每天观察青蟹的摄食情况和活动情况,记录褪壳及死亡情况。
1.2.2 样品收集与分析
8周的养殖试验结束后,记录每组的存活数及质量。每个饵料组在每个重复中随机各取4只蟹(2只雄蟹,2只雌蟹),共12只蟹。将蟹放置于解剖盘中,用酒精进行体表消毒。用抗凝剂润洗过的无菌注射器从第三步足基关节处取血,将血淋巴与抗凝剂1∶1混匀,4 ℃下8000 r/min离心10 min[12],取上清液用于血清生化指标及SOD测定。解剖蟹体取肝胰腺、鳃及肌肉,液氮速冻后于-80 ℃保存,其中肝胰腺用于肝胰腺生化指标及消化酶活力测定,鳃用于Na+K+-ATP酶活力测定。
生化酶活测定:胃蛋白酶、淀粉酶和脂肪酶的活性测定均按照试剂盒(南京建成生物工程研究所)操作步骤准确测定。超氧化物歧化酶(SOD)和Na+K+-ATP酶采用索莱宝生物试剂盒,按照厂家提供的说明书进行测定。 血清生化指标及肝胰腺生化指标采用迈瑞生化分析仪(迈瑞,BS390)进行测定。
1.3 数据分析
生长性能计算公式如下:
特定生长率(SGR,% ·d-1)=100×(lnWt-lnW0)/t
(1)
肝胰腺指数(HSI,%)=100×Wh/Wt
(2)
成活率(SR,%)=100×Nt/N0
(3)
式中,W0为初始平均质量,g;Wt代表青蟹的终末平均质量,g;N0代表青蟹初始数量;Nt代表青蟹的终末数量;t为实验天数,d。
采用SPSS 22.0对实验数据进行统计分析,以单因素方差分析方法检验不同饵料投喂对拟穴青蟹生长、生理生化等指标的差异显著性,以Pearson方法分析相关性,取P<0.05为差异显著。
2 结果
2.1 不同饵料对拟穴青蟹生长性能的影响
不同饵料投喂56 d后,拟穴青蟹的特定生长率、肝胰腺指数及成活率结果见表2。在整个养殖期间,缢蛏组的特定生长率最大,为(1.15±0.12) %·d-1,显著大于其他3组(P<0.05),其余3组之间无显著差异。肝胰腺指数则是配合饲料组最高,4个饵料组之间无显著差异。成活率则是杂鱼组最高(55.00%),鳗鱼饲料组(53.33 %)次之,缢蛏组(48.33%)和配合饲料组(48.33%)最低。各饵料组之间,青蟹的成活率无显著差异。

表2 不同饵料对拟穴青蟹特定增长率、肝胰腺指数的影响
2.2 不同饵料对拟穴青蟹肝胰腺及血清生化指标的影响
拟穴青蟹血清生化指标测定结果显示(表3),总蛋白(TP)含量杂鱼组最高,其次是缢蛏组、配合饲料组、鳗鱼饲料组,其中鳗鱼饲料组的总蛋白含量显著低于其他三组(P<0.05)。无机磷(P)含量,缢蛏组和鳗鱼饲料组显著高于杂鱼组和配合饲料组(P<0.05)。铁(Fe)、镁(Mg)、白蛋白(ALB)和钙(Ca)含量,各组之间无显著差异(P>0.05)。
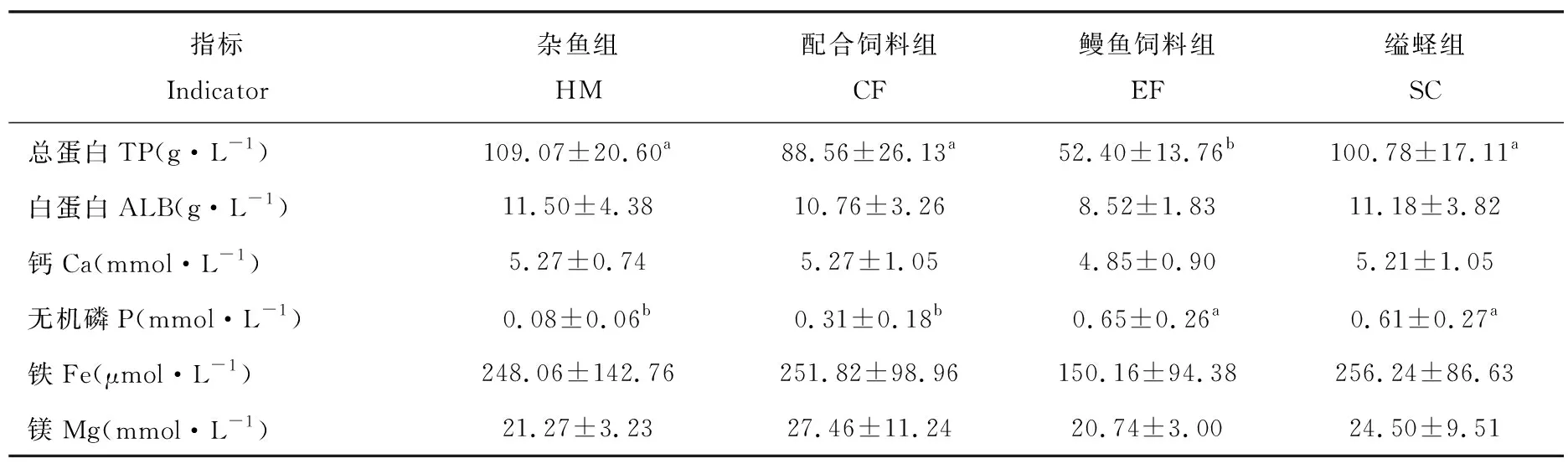
表3 不同饵料对拟穴青蟹血清生化指标的影响
拟穴青蟹肝胰腺生化指标测定结果显示(表4),总蛋白(TP)、葡萄糖(Glu)及镁(Mg)含量各组之间无显著差异。白蛋白含量鳗鱼饲料组最低,为0.64 g·L-1,显著低于其余3组(P<0.05)。总胆固醇(TC)含量也是鳗鱼饲料组最低,显著低于杂鱼组(P<0.05),其余各组之间差异不显著(P>0.05)。甘油三酯(TG)含量,鳗鱼饲料组显著低于其余3组(P<0.05)。无机磷(P)含量,缢蛏组和配合饲料组显著高于杂鱼组(P<0.05);铁离子(Fe)含量,杂鱼组显著低于其他3个养殖组(P<0.05)。
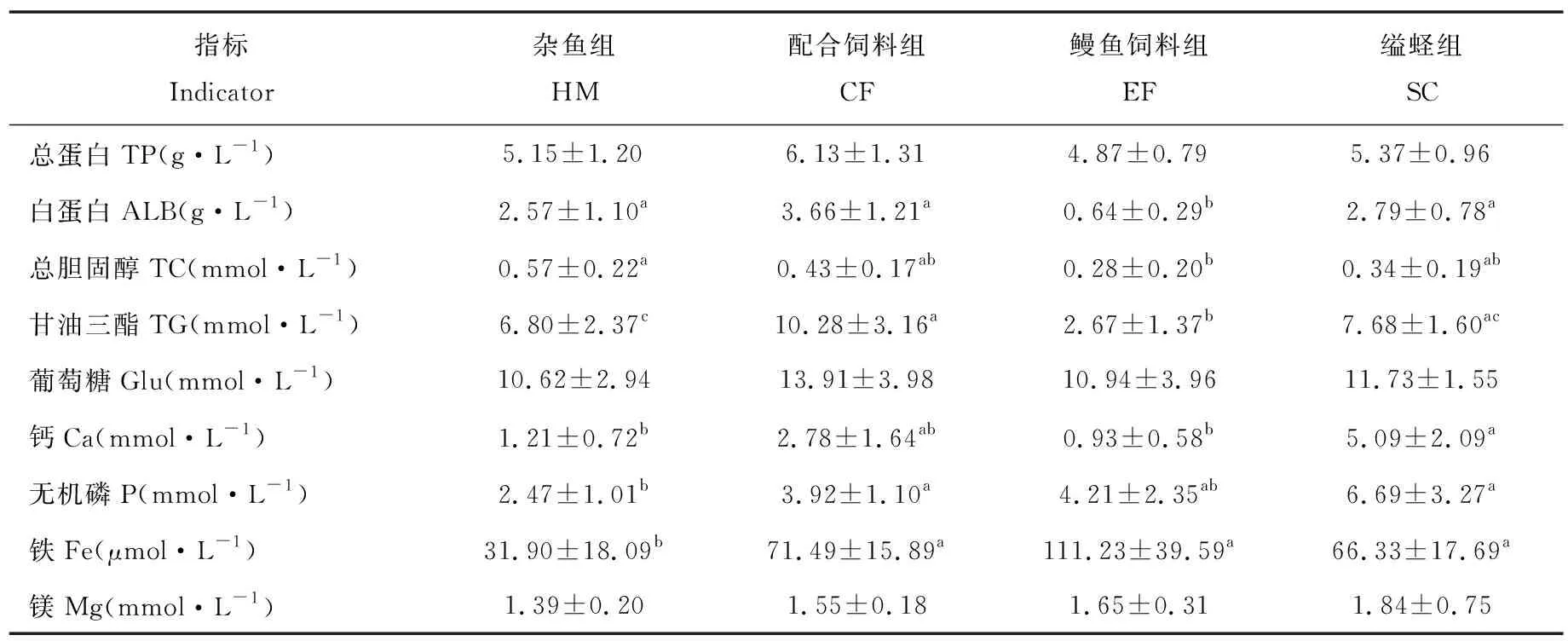
表4 不同饵料对拟穴青蟹肝胰腺生化指标的影响
2.3 不同饵料对拟穴青蟹生化酶活的影响
不同饵料对拟穴青蟹SOD和Na+-K+-ATP酶活力的影响见图1,图2。缢蛏组SOD酶活力显著高于杂鱼组(P<0.05),其余各组之间差异不显著(P>0.05)。缢蛏组Na+-K+-ATP酶活力显著高于鳗鱼饲料组(P<0.05),其余各组之间差异不显著(P>0.05)。

图1 不同饵料对拟穴青蟹超氧化物歧化酶活力的影响

图2 不同饵料对拟穴青蟹Na+K+-ATP酶活力的影响
对拟穴青蟹肝胰腺消化酶活力测定后发现(图3),缢蛏组胃蛋白酶(Protease)活力最高,但各组之间差异不显著(P>0.05)。脂肪酶活力(LPS),杂鱼组最高,其余三组依次为缢蛏组、鳗鱼饲料组、配合饲料组,其中杂鱼组脂肪酶活力显著高于其他各组(P<0.05)。杂鱼组淀粉酶(AMS)活力最高,但各组之间差异不显著(P>0.05)。

图3 不同饵料对拟穴青蟹蛋白酶(a)、脂肪酶(b)及淀粉酶(c)活力的影响
2.4 相关性分析
表5列出各组胃蛋白酶与特定生长率的相关性指数。杂鱼组特定生长率与胃蛋白酶活力之间存在显著相关性(R=0.767,P<0.05),其余各组特定生长率和消化酶之间均无显著相关性(P>0.05)。

表5 胃蛋白酶与特定生长率的相关性分析
3 讨论
3.1 不同饵料对拟穴青蟹生长性能的影响
缢蛏组的拟穴青蟹特定生长率最高,这与养殖期间缢蛏组拟穴青蟹的摄食情况与营养输入相吻合。缢蛏组的蛋白质摄入量较高,使得拟穴青蟹生长较快。但肝胰腺指数则是青蟹配合饲料组和鳗鱼饲料组较高,可能是因为青蟹配合饲料和鳗鱼饲料脂肪水平较高,促进了肝胰腺的脂肪积累,这与杨丽丽[13]的研究结果相似,即高蛋白质的饵料能促进拟穴青蟹生长,但肝胰腺脂肪储存较低,肝胰腺指数偏低。虽然杂鱼的蛋白质含量较高[11],但其适口性较差,导致杂鱼组的摄食量较低,这可能是杂鱼组青蟹生长较慢的重要原因之一。
3.2 不同饵料对拟穴青蟹肝胰腺及血清生化指标的影响
有研究表明,不同饵料会对动物的血清血清生化指标造成影响[14-15]。血清中TP、ALB含量升高是机体蛋白质代谢旺盛的表现[16]。缢蛏组与杂鱼组血清中的TP及ALB含量较高,表明这两组青蟹蛋白质代谢旺盛,结合其生长情况及饵料营养成分,我们认为缢蛏组与杂鱼组的情况不同:缢蛏组将更多的蛋白质转化为自身营养,而白鲢的碳水化合物含量很低,蛋白质更多用于能量代谢,这也比较符合各组青蟹的生长情况。有研究表明,水生甲壳动物血淋巴中的糖类、脂类和总蛋白(TP)等代谢水平会对其离子转运供能产生影响,进而影响渗透压[17];对三疣梭子蟹的研究也显示,血清Glu、TG及TP均与渗透压调节密切相关[18]。本研究中,鳗鱼饲料组血清TP含量显著低于其余各组,表明该组的渗透压调节可能受到影响。
肝胰腺指标中,TP和ALB则是青蟹配合饲料组最高。胆固醇(TC)是性激素、蜕皮激素肾上腺皮质类固醇激素及维生素D等活性物质的前体,在维持甲壳动物生长发育、内分泌及生殖中发挥重要作用。甘油三酯(TG)是青蟹幼体的主要脂类组成,是幼体能量储存和利用的主要形式[19]。在本试验中,青蟹配合饲料组的TG含量最高,这与肝胰腺指数的测定结果一致,从另一个方面也说明配合饲料能促进青蟹肝胰腺脂类的积累,这可能与青蟹配合饲料的脂肪酸含量及脂肪源有关。肝胰腺是大部分海洋蟹类的钙储存器[20],三疣梭子蟹的肝胰腺在钙储存及蜕壳后的壳硬化中起重要作用[21]。从实验结果看,缢蛏组青蟹的肝胰腺钙含量最高,这可能与青蟹对缢蛏壳的摄食有关。
3.3 不同饵料对拟穴青蟹生化酶活力的影响
SOD可以清除生物体内多余的自由基,保证动物机体内部的稳态,还在抗衰抗炎方面有重要作用[22]。Na+和Cl-是广盐性蟹类血淋巴渗透压形成的主要物质[23],而Na+-K+-ATP酶是转运Na+的重要酶类。从实验结果看,杂鱼组的SOD活力最低,说明其血清清除自由基的能力较弱,而该组Na+-K+-ATP酶活力却较高,说明了杂鱼组拟穴青蟹的免疫功能可能受到抑制。鳗鱼饲料组Na+-K+-ATP酶活力最低,说明鳗鱼饲料可能影响了拟穴青蟹的渗透压调节机制,与血清TP指标的结果一致,但具体原因尚不清楚。
消化酶活力是反应蟹类对营养物质消化和吸收能力的重要指标,可以间接反应蟹类的生理状态。饵料作为蟹类营养物质的主要来源,是消化酶活力的重要影响因素[24-26]。有研究表明,在饵料营养成分在一定范围内时,蟹类蛋白酶会随饵料蛋白质水平的升高而升高[27-28]。本研究中的缢蛏组、鳗鱼饲料组和青蟹配合饲料组的蛋白酶活力较高,推断可能是由于这几种饵料的蛋白质水平较高引起的。虽然杂鱼组的蛋白酶活力也很高,但该实验组的原因与其他几组不同,结合杂鱼组残饵较多的情况,可能是由于适口性差,导致青蟹摄食的蛋白质较少,无法满足青蟹的生长发育需求,青蟹需要提高蛋白酶活力以从饵料中摄入更多的蛋白质。在草鱼[29]、日本囊对虾[30]中也有类似发现,比如在日本囊对虾研究中,卤虫无节幼体的蛋白质含量高于角毛藻,而投喂角毛藻的日本囊对虾幼体胰蛋白酶活力比投喂卤虫无节幼体的高出6倍以上。
脂肪酶方面,杂鱼组脂肪酶活力显著高于其他各组(P<0.05)。但对比各个饵料组的脂肪投喂水平,与蛋白质相似,杂鱼组摄入的脂肪较少,因此推断可能较高的脂肪酶活力是对低脂肪饵料的一种适应,以提高饵料脂肪的利用率。
一般来说,蟹类消化酶活力中,肝胰腺蛋白酶活性最高,淀粉酶活力高于纤维素酶,脂肪酶活力最低[31-33]。但本研究中消化酶活力的绝对值与之不同,具体表现在脂肪酶活力较高与淀粉酶活力较低。在十足类卵巢发育期间,肝胰腺储存的脂肪,可能用于卵巢发育[34]。考虑到取样时,青蟹性腺开始发育,肝胰腺中的脂肪可能用于性腺的发育,所以肝胰腺脂肪酶活力较高。而淀粉酶活力较低则可能是因为水温开始降低,青蟹作为变温动物,水温的降低使其代谢降低,对糖类的需求降低,使得淀粉酶活性较低。脂肪酶和淀粉酶活力的变化也说明,蟹类消化酶的活力与其生理代谢过程和营养物质需求密切相关。
3.4 相关性
本研究中,杂鱼组特定生长率与胃蛋白酶活力呈显著正相关,结合该组胃蛋白酶活力及特定生长率数据,进一步说明杂鱼组拟穴青蟹的蛋白质摄入不足,蛋白质的摄入量已经成为决定杂鱼组拟穴青蟹特定生长率的重要因素。
4 小结
结合生长性能、生化酶活力等参数,缢蛏投喂的效果最好;鳗鱼饲料及杂鱼会对拟穴青蟹的部分血清生化指标及酶活力造成负面影响。青蟹配合饲料具有来源稳定、质量可控及保存方便等优势且在肝胰腺指数及肝胰腺TG含量方面的优势较大。本研究为蟹公寓养殖拟穴青蟹的饵料选择提供了参考。

