整合素β3在肺腺癌骨转移中的作用及应用价值
穆佳倩,滕小艳,魏丽荣,仇 荣,桂鹏程,杜玉珍
1.上海海洋大学水产与生命学院,上海 201306;2.上海交通大学附属第六人民医院检验科,上海 201306
肺癌患者的5年生存率为14% ~ 17%[1],转移是肺癌患者死亡的主要原因[2]。肺腺癌是肺癌最常见的病理学类型,骨骼是肺腺癌常见的转移部位[3],且以溶骨性骨转移多见[4]。肺癌发生骨转移后,易伴有骨痛、神经压迫和高钙血症等骨相关事件,严重影响患者生存质量[5]。
整合素(integrin,ITG)是主要的细胞黏附分子受体,几乎参与肿瘤进展和转移的全过程[6]。整合素β3(integrin β3,ITGB3)是整合素家族的重要成员,参与肿瘤的黏附、血管生成[7-9]以及肿瘤亲器官性转移等过程[10-11]。然而,ITGB3是否与肺腺癌的骨转移相关,未见报道。本研究拟通过癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库和临床样本分析ITGB3与肺腺癌转移的相关性;并构建肺腺癌细胞ITGB3过表达稳定转染细胞株,探究ITGB3对肺腺癌细胞增殖、迁移和侵袭能力的影响及其在肺腺癌骨转移中可能的作用。
1 材料和方法
1.1 细胞系及主要试剂
人肺腺癌细胞系A549、PC9,大细胞肺癌细胞系NCI-H460,小细胞肺癌细胞系SBC3、SBC5和正常的人胚肺细胞系MRC5均购自美国典型培养物保藏中心(American Type Culture Collection,ATCC);高糖DMEM、RPMI-1640、MEM培养基、胎牛血清、青霉素/链霉素(双抗)、G418、不含EDTA胰酶、Exo-free FBS均购自美国Gibco公司;LipofectamineTM3000转染试剂购自美国Invitrogen公司;FITC 抗人CD61抗体、Human Integrin beta-3(ITGB3)ELISA试剂盒购自美国Elabscience公司;化学发光试剂ECL购自美国Millipore公司;细胞周期与凋亡检测试剂盒购自上海碧云天生物技术有限公司;Matrigel基质胶购自美国Corning公司;兔抗人Integrin β3单克隆抗体、兔抗人MMP2单克隆抗体、山羊抗兔IgG二抗、山羊抗鼠IgG二抗均购自武汉爱博泰克生物科技有限公司;鼠抗人MMP9单克隆抗体、鼠抗人CD63单克隆抗体均购自美国Arigo公司;兔抗人TSG101单克隆抗体购自英国Abcam公司;exoRNeasy Serum/Plasma Midi试剂盒购自美国QIAGEN公司;人外周血淋巴细胞分离液购自北京索莱宝科技有限公司;巨噬细胞集落刺激因子(macrophage colony-stimulating factor,M-CSF)、核因子κB受体活化因子配体(receptor activator of NF-κB ligand,RANKL)均购自美国R&D systems公司;抗酒石酸酸性磷酸酶(tartrateresistant acid phosphatase,TRAP)染色试剂盒购自北京博乐通生物科技有限公司。
1.2 TCGA数据库分析
从TCGA数据库(https://cancergenome.nih.gov/)中下载经统一标准化的肺癌数据集,分析ENSG00000259207(ITGB3)基因在肺癌中的表达及与肺腺癌分期的相关性,对每个表达值进行log2(x+0.001)变换;采用R 3.6.4软件并使用秩和检验(Wilcoxon Rank Sum Tests)和符号秩检验(Wilcoxon Signed Rank Tests)进行差异显著性分析。
1.3 患者血浆样本的收集与外泌体ITGB3的检测
收集2020年4月—2021年9月在上海市第六人民医院就诊的肺腺癌患者血浆,共49例。其中,肺腺癌无转移患者15例、肺腺癌骨转移患者10例、肺腺癌其他转移患者9例,同时,收集15名健康体检者血浆作为对照组。血浆的收集均使用含EDTA抗凝剂的紫色真空采集管,并在采血后1 h于4 ℃条件下、3000×g离心10 min,收集上层血浆,于 4 ℃、11000×g离心10 min。本项目经上海市第六人民医院临床伦理委员会批准。
按照exoRNeasy Serum/Plasma Midi 试剂盒说明书要求提取患者血浆中的外泌体,采用透射电镜检测外泌体形态,采用粒径分析(NTA)检测外泌体大小,采用Western blot检测外泌体标志物TSG101和CD63的表达水平,采用Western blot和ELISA检测血浆外泌体ITGB3蛋白水平。
1.4 细胞培养及细胞株的筛选
采用高糖DMEM培养基培养A549、SBC3和SBC5细胞系,采用RPMI-1640培养基培养NCI-H460和PC9细胞系,MEM培养基培养MRC5细胞系,培养基中均加入10%的胎牛血清和1%的青霉素和链霉素,细胞在37 ℃、CO2体积分数为5%的细胞培养箱中培养。取对数生长期的细胞,采用Western blot检测各细胞ITGB3蛋白的表达水平,选取ITGB3低表达的肺癌细胞进行后续稳转株的构建。
1.5 质粒的构建、转染及稳转株的鉴定
在GenBank数据库中查阅人源ITGB3全长的编码区序列(ENST00000559488.5),采用PCR对靶序列进行扩增。将ITGB3目的片段与 pcDNA-3.1+/Neo质粒进行重组并酶切鉴定。质粒的转染实验分为对照组(即空白细胞A549、转染空载质粒的A549-Mock+)和实验组(转染ITGB3过表达质粒的A549-ITGB3+)。质粒的转染严格按照LipofectamineTM3000转染试剂说明书,并使用G418(750 μg/mL)筛选稳定转染的细胞株。
稳转株的鉴定:取对数生长期细胞,用不含EDTA胰酶消化并离心,冷的PBS洗,加入FITC标记的ITGB3抗体(用含3% BSA和0.1%Triton的PBS稀释)4 ℃避光温育 30 min,冷的PBS洗,采用流式细胞术检测ITGB3蛋白的表达水平;并用Western blot检测ITGB3蛋白的表达水平。
1.6 细胞外泌体的分离鉴定
采用差速离心法,即细胞在含10% Exo-free FBS培养基培养,收集培养液,4 ℃条件下200×g离心10 min,上层液体2 000×g离心15 min,上层液体10 000×g离心30 min。继续收集上清液转移至外泌体超滤离心管中 (100 KD),3 000×g离心30 min,浓缩液经0.22 μm孔径滤器过滤,100 000×g离心70 min,沉淀物加PBS溶解分装于-20 ℃保存用于后续分析。鉴定同血浆外泌体。
1.7 细胞周期
按照细胞周期与凋亡检测试剂盒说明书要求对不同实验分组细胞进行染色,采用流式细胞术对细胞周期进行分析。数据结果采用Modfit软件进行分析。
1.8 克隆形成
不同实验分组细胞计数600个,分别接种于6孔板,培养2 ~ 3周,弃培养液,4%多聚甲醛固定细胞、结晶紫染色、风干。倒置显微镜下观察克隆集落并拍照;使用Image J软件对各组细胞的克隆集落进行计数。
1.9 Transwell小室实验
Matrigel基质胶按1∶8比例稀释,取100 μL铺入transwell上室,细胞计数1×105个接种至上室,下室加入600 μL含10%胎牛血清的培养基培养48 h后,4%多聚甲醛固定细胞,结晶紫染色,棉签擦去小室上层未侵袭的细胞,空气中干燥。显微镜下随机选取3个视野观察并拍照,使用Image J软件对侵袭的细胞进行计数,以反映细胞侵袭能力。细胞迁移能力的检测:transwell上室内不铺基质胶,24 h终止实验,其余操作同侵袭实验。
1.10 Western blot检测
收集细胞加入含蛋白酶抑制剂的RIPA裂解液提取总蛋白,BCA法进行蛋白定量,每组取30 μg总蛋白于10%的十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecylsulphate polyacrylamide gel electrophoresis,SDSPAGE)中分离,恒压100 V转PVDF膜,脱脂牛奶封闭,其中一抗均按1∶1 000的比例稀释(ITGB3、MMP9、MMP2、TSG101、CD63和GAPDH),HRP标记的二抗按1∶5 000比例稀释,温育PVDF膜,一抗4 ℃过夜,二抗室温温育1 h,TBST洗涤。使用化学发光试剂ECL显影,使用Image J 软件分析蛋白条带的灰度值。
1.11 外泌体ITGB3诱导破骨细胞分化实验
取人的外周血10 mL按1∶1比例加PBS混匀,按照淋巴细胞分离液说明书提取人外周血单核细胞(peripheral blood mononuclear cell,PBMC),细胞计数铺96孔板,2×105每孔。培养液中加30 ng/mL RANKL、15 ng/mL M-CSF,隔天换液,诱导7 d后加入肺腺癌细胞分泌ITGB3表达水平不同的外泌体(70 μg/mL)共培养。培养至14 d,按照TRAP染色说明书对细胞染色,显微镜下观察多核破骨细胞分化情况。
1.12 统计学处理
本研究采用GraphPad Prism 8.0软件进行统计学分析处理,实验数据采用x±s表示。两组间的数据比较采用t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 ITGB3表达水平与肺癌临床特征的相关性
分析TCGA数据库下载的肺癌数据集可知,ITGB3在肺腺癌组织中的表达显著高于正常组织和肺鳞癌组织(P<0.000 1,图1A),在Ⅳ期肺腺癌组织中显著升高(P<0.000 1,图1B)。以上结果表明,ITGB3高表达与肺腺癌进展相关。
提取患者血浆外泌体,使用透射电镜(图1C)、NTA分析(图1D)和Western blot(图1E)对外泌体进行形态大小分析和鉴定。对肺腺癌患者血浆外泌体中ITGB3的表达进行检测,发现肺腺癌骨转移患者血浆外泌体ITGB3水平高于其他转移的患者(P<0.000 1,图1E、F),提示外泌体ITGB3与肺腺癌骨转移相关。
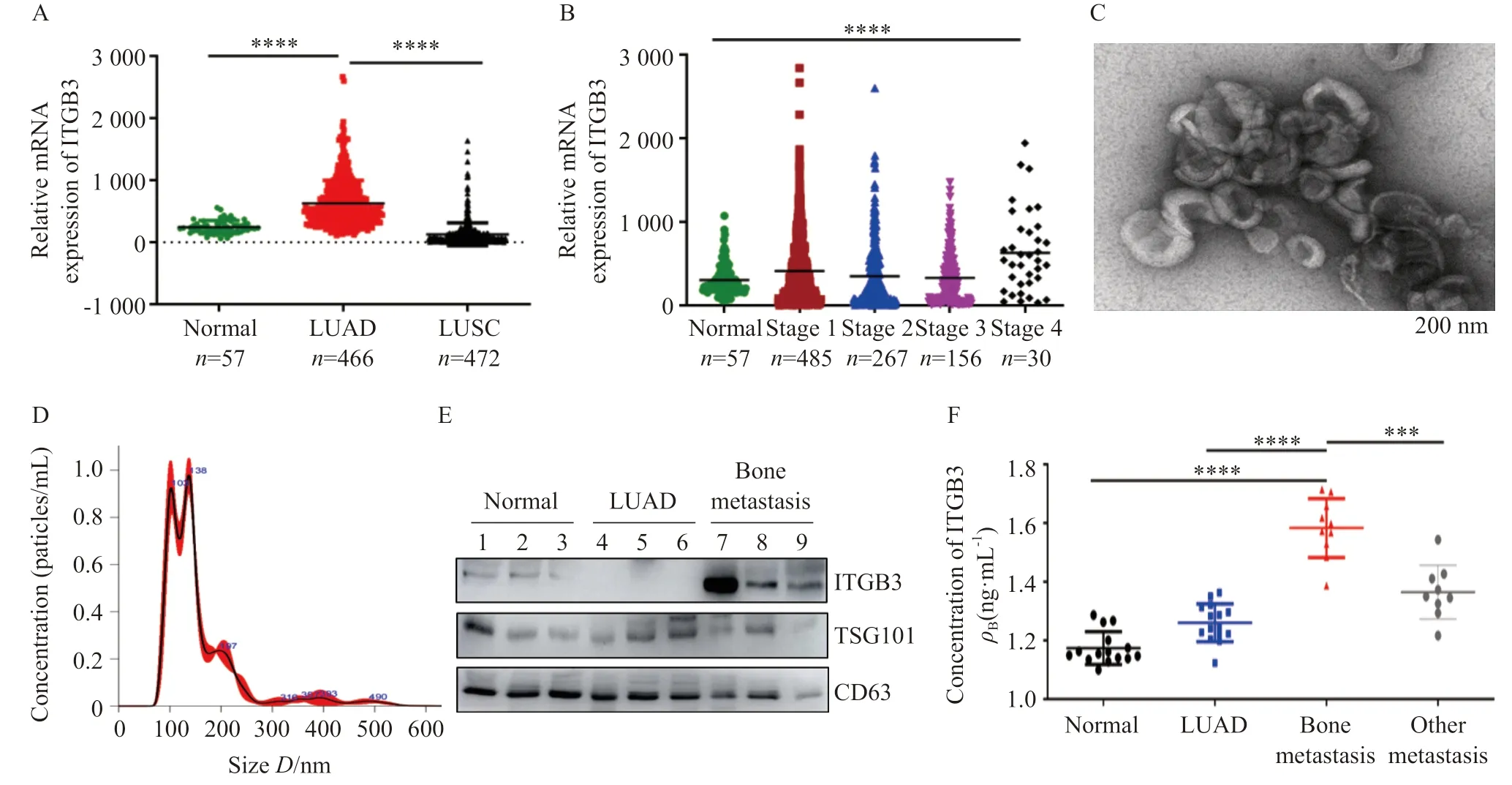
图1 ITGB3的表达水平与肺癌临床特征的相关性Fig.1 The correlation between the expression level of ITGB3 and the clinical features of lung cancer
2.2 ITGB3对肺腺癌细胞生物学行为的影响
2.2.1 ITGB3过表达稳定转染细胞株的构建
检测不同肺癌细胞株中ITGB3表达水平(图2A),选取ITGB3表达相对较低的A549细胞构建ITGB3过表达稳定转染细胞A549-ITGB3+;验证发现A549-ITGB3+细胞中ITGB3的表达水平显著高于对照组(1.033±0.114vs0.131±0.034,P<0.05)(图2B、C)。分离A549和A549-ITGB3+细胞分泌的外泌体,外泌体的鉴定同血浆外泌体(图2D ~ F)。结果发现,A549-ITGB3+细胞分泌的外泌体中ITGB3高表达(图2F)。
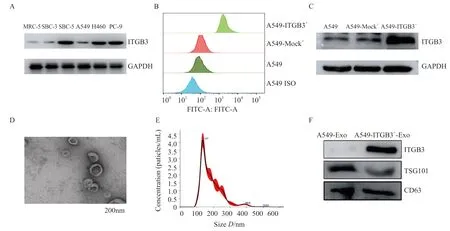
图2 A549 ITGB3过表达稳转细胞株的的构建Fig.2 Construction of A549 ITGB3 overexpression stable cell line
2.2.2 ITGB3对肺腺癌A549细胞周期、克隆形成的影响
流式细胞术细胞周期实验结果显示,A549-ITGB3+细胞周期与对照细胞差异无统计学意义(P=0.556,图3A);克隆形成实验显示,A549-ITGB3+细胞的克隆集落形成率与对照组差异无统计学意义(P=0.930,图3B),提示ITGB3过表达对A549细胞周期和克隆形成无明显影响。
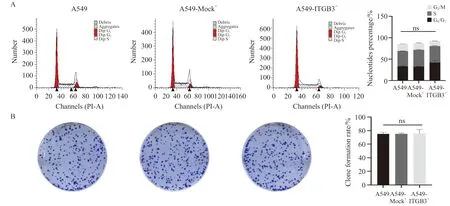
图3 ITGB3过表达对A549细胞周期和克隆形成的影响Fig.3 The effect of ITGB3 overexpression on A549 cell cycle and clone formation
2.2.3 ITGB3对肺腺癌A549细胞侵袭和迁移的影响
结果发现,A549-ITGB3+细胞的穿膜数目显著高于对照组(侵袭:1366±96.50vs623.3±41.36,迁移:1201±107.2vs500±34.51,P<0.001,图4A、B)。检测侵袭转移相关蛋白MMP9、MMP2蛋白表达水平,发现A549-ITGB3+细胞的中MMP9和MMP2水平显著高于对照组(图4C),提示ITGB3可能通过上调MMP2、MMP9表达来促进细胞的侵袭和迁移。
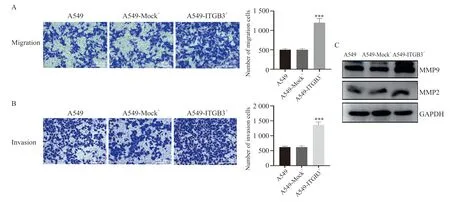
图4 ITGB3过表达对A549细胞侵袭和迁移能力的影响Fig.4 The effect of ITGB3 overexpression on the invasion and migration ability of A549 cells
2.3 细胞外泌体ITGB3对破骨细胞分化的促进作用
为进一步探讨细胞外泌体ITGB3对破骨细胞分化的影响,将外泌体用于破骨细胞的诱导分化,采用TRAP染色观察各组破骨细胞(TRAP染色阳性且核>3个的细胞)的分化情况。结果显示,A549-ITGB3+细胞外泌体诱导的破骨细胞分化效率显著高于对照组(11.50±0.707vs5.5±0.707,P<0.05,图5),提示肺腺癌细胞高表达ITGB3的外泌体可促进破骨细胞的分化。

图5 TRAP染色显示肺腺癌细胞分泌的外泌体对破骨细胞分化的影响Fig.5 TRAP staining shows the effect of exosomes secreted by lung adenocarcinoma cells on the differentiation of osteoclasts.
3 讨 论
肿瘤转移是患者预后差的重要因素,肺腺癌引起的溶骨性骨转移严重影响患者生存质量和生存期[12]。在临床上,肺癌骨转移的诊断主要依靠影像学和骨穿刺活检等,因灵敏度、特异度低以及辐射性等局限性,难以实现骨转移的早发现、早诊断[13]。目前,肺腺癌骨转移相关的分子机制尚不清楚,因此,在临床实践中,缺乏可用于监测骨转移的有效分子标志物。
ITGB3是整合素家族的重要成员,其在肿瘤转移中的作用已有较多的报道[14]。有研究报道,骨转移肿瘤细胞高表达αvβ3,并可通过与骨基质细胞因子骨桥蛋白、骨涎蛋白和纤连蛋白结合,从而促进肿瘤细胞与骨基质微环境的黏附[15]。将过表达ITGB3的小鼠乳腺癌细胞66cl4注射到同基因小鼠胫骨中可导致破骨细胞募集和骨吸收增加[16]。还有报道,认为ITGB3在肿瘤的亲骨性转移中发挥重要作用,如在小鼠静脉注射转移模型中,将B16黑色素瘤细胞分别注入ITGB3靶向缺失及野生型小鼠的左心室,发现ITGB3靶向缺失的小鼠仅有4%发生溶骨性骨转移和骨破坏,而有74%的野生型小鼠在14 d内发生溶骨性骨转移和骨破坏[17]。这些研究结果提示,ITGB3与肿瘤骨转移的发生可能存在密切关系。
本研究首先通过TCGA数据库分析发现ITGB3与肺腺癌的进展相关,收集肺腺癌患者血浆血浆外泌体,检测ITGB3水平。结果发现,外泌体ITGB3水平不仅与转移呈正相关,而且与肿瘤患者的骨转移呈高度正相关。进而,采用肺腺癌A549细胞系构建ITGB3过表达稳转株(A549-ITGB3+),收集A549、A549-ITGB3+细胞分泌的外泌体。结果发现,ITGB3过表达的A549-ITGB3+细胞的外泌体ITGB3也过表达。随后,将肿瘤细胞分泌的ITGB3表达水平不同的外泌体用于破骨细胞诱导分化,发现ITGB3高表达的外泌体对破骨细胞的促分化作用更明显。以上结果提示,ITGB3与肿瘤骨转移相关,可能是诊断肺腺癌骨转移的潜在分子标志物。
本研究就ITGB3对肺腺癌骨转移的促进作用进行了初步探讨,同时,根据生物信息分析和患者血浆外泌体ITGB3的小样本定量检测,提示外泌体ITGB3可能是肺腺癌骨转移的潜在分子标志物,但以上推测只有体外干预实验的证据和小样本患者数据的支持,仍需要进一步体内干预实验的证据以及大样本临床数据进行验证。
利益冲突声明:所有作者均声明不存在利益冲突。
——外泌体与老年慢性疾病相关性的研究进展

