乙酰基转移酶KAT3b与ABCE1乙酰化在食管癌中的相关性研究
梁宗英,杨 阳,孙光蕊,赵宝山,辛国华,张 乐,侯继申
1.承德医学院附属医院胸外科,河北 承德 067000;2.河北省胸科医院临床实验室,河北 石家庄 050000
食管癌是全世界范围内常见的恶性肿瘤之一,其发病率和死亡率位居高不下[1]。虽然手术及放化疗在一定程度上改善了部分食管癌患者的预后,但其总体生存率仍不容乐观[2]。因此,研究食管癌发生、发展的具体分子机制,就成为预防和治疗食管癌新的理论突破口。
ATP结合盒转运子E1(ATP-combined box transporter E1,ABCE1)的基因是一种癌基因,其编码的ABCE1蛋白在多种肿瘤中呈高表达状态,且其与肿瘤的增殖、转移及预后密切相关[3]。研究[4]发现,ABCE1在食管癌组织中呈高表达,且其与食管癌的增殖、凋亡、侵袭和转移密切相关。
蛋白质乙酰化修饰是表观遗传学修饰中的重要组成部分,参与多种生物学过程。蛋白质的乙酰化修饰需要在乙酰基转移酶的催化下进行,故在蛋白质乙酰化修饰的生物学过程中,乙酰基转移酶也扮演了重要的角色,参与肿瘤的发生、发展[5]。 食管癌中乙酰基转移酶3b(acetyltransferase 3b,KAT3b)是乙酰基转移酶家族中的重要一员,可以催化多种组蛋白及非组蛋白发生乙酰化,进而参与肿瘤的发生、发展。
本研究通过检测食管癌中ABCE1和KAT3b的表达及ABCE1蛋白的乙酰化水平,分析KAT3b、ABCE1乙酰化与病理学特征之间的相关性,并观察下调KAT3b对ABCE1蛋白乙酰化水平的影响,探讨乙酰基转移酶KAT3b与ABCE1蛋白乙酰化修饰之间的内在联系、在食管癌发病过程中的作用及其机制。
1 资料和方法
1.1 组织和细胞
选取2020年1月—2021年5月承德医学院附属医院胸外科手术切除的食管癌标本。纳入标准:术后肿瘤组织病理学检查证实为鳞癌,无其他肿瘤病史,术前无放化疗、免疫及靶向治疗史;实验组:55例食管癌组织;对照组:55例相同患者与之对应正常食管黏膜组织。一般资料:男性44例,女性11例;≥60岁42例,<60岁13例;TNM分期:Ⅰ期7例,Ⅱ期32例,Ⅲ期16例;组织分化:高分化7例,中分化40例,低分化8例;有淋巴结转移14例,无淋巴结转移41例。本研究经承德医学院附属医院伦理委员会批准,并获得患者知情同意。人食管癌细胞系EC109由承德医学院附属医院中心实验室提供。
1.2 主要试剂
ABCE1单克隆抗体、Acetylated-Lysine抗体、KAT3b抗体均购自英国Abcam公司,A/G琼脂糖珠购自美国CST公司,DNA提取试剂盒购自北京全式金生物有限公司,免疫组织化学SP试剂盒和浓缩型DAB试剂均购自珠海市泉晖企业有限公司,Alexa Fluor 488-conjugated羊抗兔荧光抗体、ATTO 594-conjugated羊抗鼠荧光抗体购自河北贝博实验用品有限公司。RNA引物由广州锐博生物科技有限公司设计合成。
1.3 实验方法
1.3.1 免疫组织化学SP法
组织切片二甲苯脱蜡,梯度乙醇浸泡,滴加3%H2O2,室温放置10 min。破膜后,放入柠檬酸缓冲液,高温修复抗原。切片冷却,加山羊血清,室温封闭。清洗后,湿盒中加入一抗(KAT3b单克隆抗体1∶1 000;ABCE1单克隆抗体,1∶1 000)4℃温育过夜。室温条件下,二抗温育30 min。DBA显色,苏木精复染。
1.3.2 蛋白质印迹法(Western blot)检测
提取蛋白,蛋白浓度测定;采用凝胶电泳分离总蛋白,并采用半干转膜法将总蛋白转移到聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上。5%脱脂奶粉室温封闭1 h后,将膜放入稀释好的一抗(KAT3b单克隆抗体1∶1 000;ABCE1单克隆抗体,1∶1 000)温育40 min。漂洗后,将膜放入稀释好的二抗中温育30 min。漂洗后,暗室中进行发光反应,并曝光成片。采用Image pro plus软件分析蛋白条带的积分光密度(integral optical density,IOD)值,以目的蛋白IOD值和内参IOD值的比值反映各组目的蛋白的表达量。
1.3.3 实时荧光定量聚合酶链反应(realtime fluorescence quantitative polymerase chain reaction,RTFQ-PCR)
提取组织和细胞总RNA,取300 ng RNA,按反转录试剂盒说明书进行反转录。应用荧光定量试剂盒检测ABCE1和KAT3b mRNA的相对表达量。相对表达量为2-ΔΔCt。
1.3.4 生物信息学分析和预测
生物信息学软件乙酰化集富集法软件(Acetylation Set Enrichment Based,ASEB)预测可以将ABCE1蛋白作为底物催化其发生乙酰化的乙酰基转移酶[6]。ASEB不仅可以预测目的蛋白乙酰化状态,还可以预测催化目的蛋白发生乙酰化修饰的乙酰基转移酶及可能发生乙酰化的赖氨酸位点。
1.3.5 荧光免疫组织化学(fluorescence immunohistochemistry,IF)法
组织切片60 ℃恒温箱中烘烤20 min,二甲苯及乙醇脱蜡,磷酸盐缓冲生理盐水(phosphatebuffered saline,PBS)清洗后抗原修复;5%山羊血清室温封闭30 min,甩去多余液体;加一抗(ABCE1抗体1∶1 000,KAT3b抗体1∶1 000),4 ℃过夜,37 ℃复温45 min,PBS洗3次;加荧光标记的二抗(羊抗兔荧光抗体1∶200、羊抗鼠荧光抗体1∶200),室温避光温育1 h,PBS洗3次;DAPI染色10 min,PBS洗3次;抗荧光淬灭封片剂封片,拍照。
1.3.6 免疫共沉淀
组织提取蛋白质,加入A/G琼脂糖珠5 mL和ABCE1单克隆纯抗体5 μL,混匀后补充2×裂解缓冲液至每管总体积450 μL,取上清液400 μL置入离心管,4 ℃、15 r/min,固定混匀器共沉淀12 h。4 ℃离心,弃上清液。1×裂解缓冲液500 μL洗涤A/G琼脂糖珠。4 ℃,3 000 r/min,离心3 min,弃上清液。最后一次洗涤完毕后,弃去上清液。1×裂解缓冲液35 μL和等体积的2×十二烷基硫酸钠(sodium dodecylsulphate,SDS)上样缓冲液混合,煮沸8 min;3 000 r/min,离心;行SDS-聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)、电转移、封闭,加入一抗(acetylated-lysine抗体1∶2 000,KAT3b抗体 1∶1 000,GAPGH抗体1∶1 000)于3%BSA中 4 ℃温育过夜。加入二抗后显影。
1.3.7 细胞培养及转染
EC109细胞系用常规培养基培养。采用脂质体介导法,将KAT3b siRNA和阴性对照siRNA分别转染EC109细胞系。实验组为KAT3b siRNA组(si-K组),阴性对照组为KAT3b siRNA空载体组(si-N组),空白对照组为空白细胞组 (NC组)。
1.4 统计学处理
采用SPSS 21.0统计软件。计量资料资料符合正态分布、方差齐的数据用x±s表示,计数资料采用χ2分析,配对样本采用t检验,多组间均数比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 食管癌和正常食管黏膜组织中ABCE1和KAT3b蛋白表达
免疫组织化学结果显示,ABCE1在食管癌组织中呈高表达,其阳性表达率为83.64%(46/55),高于正常食管黏膜的23.64%(13/55),差异有统计学意义(P<0.05);KAT3b蛋白在食管癌组织和正常黏膜组织中的阳性表达率分别为78.18%(43/55)和25.45%(14/55),差异有统计学意义(P<0.05,图1)。
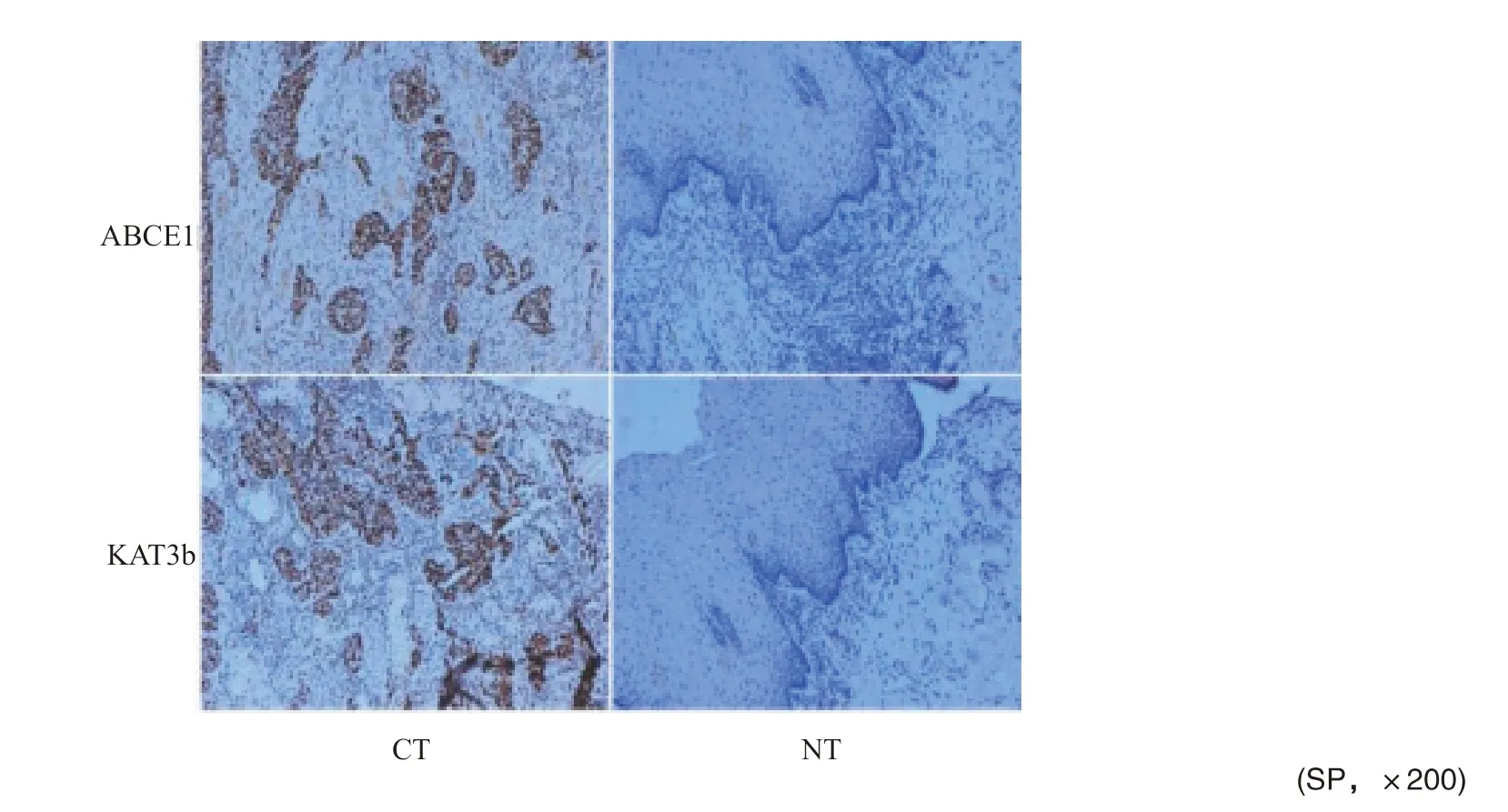
图1 食管癌和正常食管粘膜组织中ABCE1和KAT3b蛋白表达Fig.1 Protein expression of ABCE1 and KAT3b in esophageal cancer and normal esophageal mucosal tissues
2.2 食管癌和正常食管黏膜组织中ABCE1和KAT3b蛋白表达
Western blot检测结果显示,ABCE1在55例食管癌组织中的表达量为(72.64±2.14)%,高于正常食管黏膜组织中的(18.78±1.86)%,差异有统计学意义(P<0.05)。55例食管癌组织中KAT3b表达量为(60.43±1.76)%,高于正常黏膜组织的(10.34±1.62)%,差异有统计学意义(P<0.05,图2)。
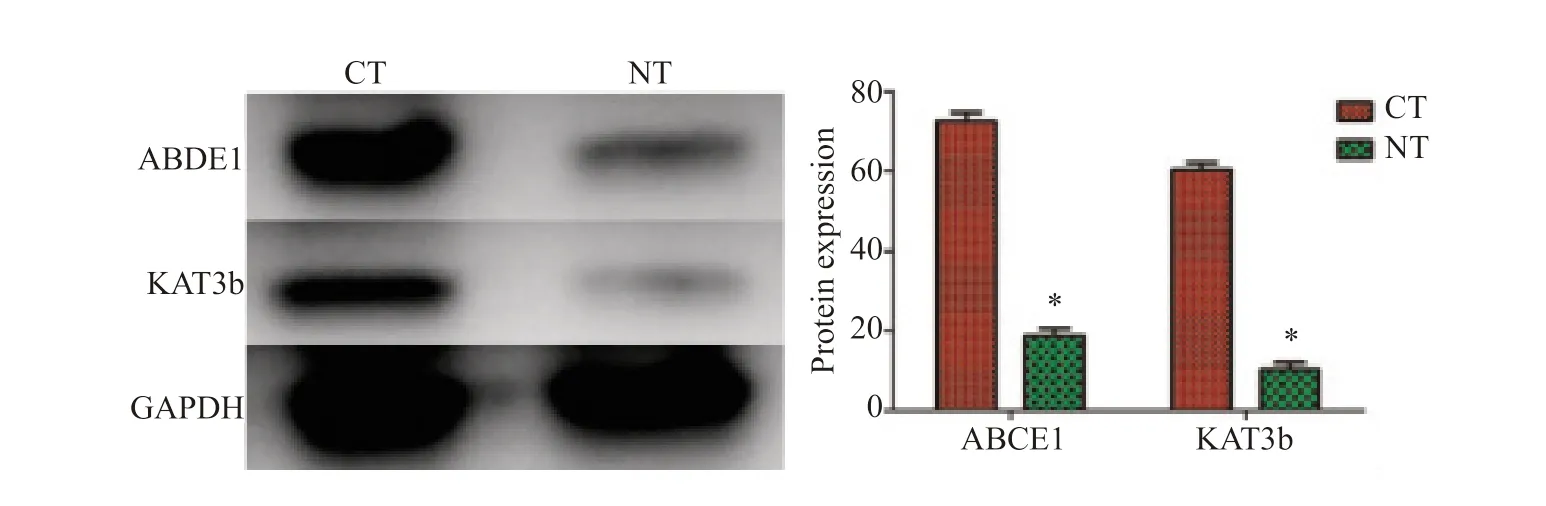
图2 食管癌和正常食管黏膜组织中ABCE1和KAT3b蛋白表达Fig.2 ABCE1 and KAT3b protein expression in esophageal cancer and normal esophageal mucosal tissues
2.3 食管癌和食管正常黏膜组织中KAT3b及ABCE1蛋白乙酰化水平
免疫共沉淀实验结果显示,在55例食管癌组织中KAT3b蛋白表达量为(60.43±1.76)%,高于正常黏膜组织的(10.34±1.62)%,差异有统计学意义(P<0.05)。ABCE1蛋白发生了乙酰化,其在癌组织中的乙酰化率为(67.18±3.16)%,显著高于正常食管黏膜组织的(17.87±1.13)%,差异有统计学意义(P<0.05,图3)。
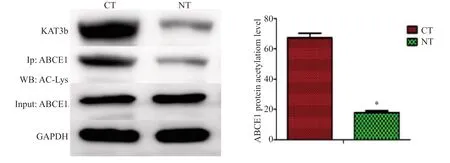
图3 食管癌和正常食管粘膜组织中KAT3b蛋白和ABCE1蛋白乙酰化水平 Fig.3 The expression levels of KAT3b and ABCE1 protein acetylation in oesophageal cancer and normal esophageal mucosal tissues
2.4 乙酰基转移酶KAT3b以ABCE1为底物催化其发生乙酰化的预测
生物信息学软件Acetylation Set Enrichment Based (ASEB)预测结果显示,乙酰基转移酶KAT3b可以将ABCE1蛋白作为底物催化其发生乙酰化,其可能发生乙酰化的赖氨酸(K)为19和397号位点(表1)。

表1 乙酰基转移酶KAT3b以ABCE1为底物发生乙酰化的预测 Tab.1 The predict of acetyltransferase KAT3b catalyzed ABCE1 for substrate acetylation
2.5 食管癌组织中ABCE1和KAT3b蛋白表达
荧光免疫组织化学结果显示,ABCE1和KAT3b蛋白在食管癌组织中同时呈现高表达状态,二者主要表达于细胞质中,部分表达于细胞核中(图4)。
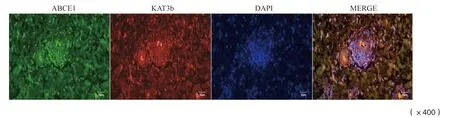
图4 免疫荧光组化检测ABCE1和KAT3b蛋白在食管癌组织中表达Fig.4 Immunofluorescence histochemistry detected the ABCE1 and KAT3b protein expression in esophageal cancer tissues
2.6 食管癌组织中ABCE1乙酰化和KAT3b的相关性
食管癌组织中ABCE1蛋白乙酰化和KAT3b蛋白的表达具有相关性,其相关系数r=0.414,二者呈正相关(P<0.05,表2)。
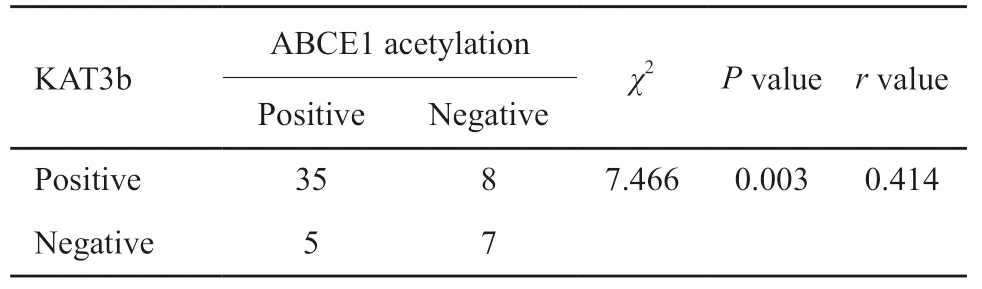
表2 食管癌组织中ABCE1乙酰化与KAT3b表达的相关性 Tab.2 Correlation of ABCE1 acetylation and KAT3b expression in oesophageal cancer tissues
2.7 食管癌组织中ABCE1乙酰化及KAT3b与临床病理学特征的相关性
ABCE1乙酰化与食管癌TNM分期、组织分化及淋巴结转移相关(P<0.05),与性别及年龄无关(P>0.05)。KAT3b阳性表达与TNM分期、分化程度及淋巴结转移密切相关(P<0.05),与性别及年龄无相关性(P>0.05,表3)。

表3 食管癌组织中ABCE1乙酰化、KAT3b与临床病理学特征的关系 Tab.3 Relationship between ABCE1 acetylation and KAT3b and clinicopathological features in esophageal cancer tissue
2.8 si-RNA干扰下调KAT3b效果
合成的si-RNA-KAT3b含有绿色荧光标记的标签,转染EC109细胞成功后荧光显微镜下可见细胞内有绿色荧光表达(图5)。RTFQPCR检测3组细胞KAT3b mRNA相对表达水平。结果显示,si-K组KAT3b mRNA相对表达量为0.23±0.03,si-N组及NC组表达量分别为1.34±0.12和1.31±0.16。si-K组的mRNA表达量明显低于si-N组及NC组,差异有统计学意义 (P<0.05,图6)。Western blot检测结果显示,si-K组KAT3b蛋白表达量显著低于si-N组及NC组,差异有统计学意义(P<0.05,图7),说明合成干扰下调KAT3b的RNA序列有效。
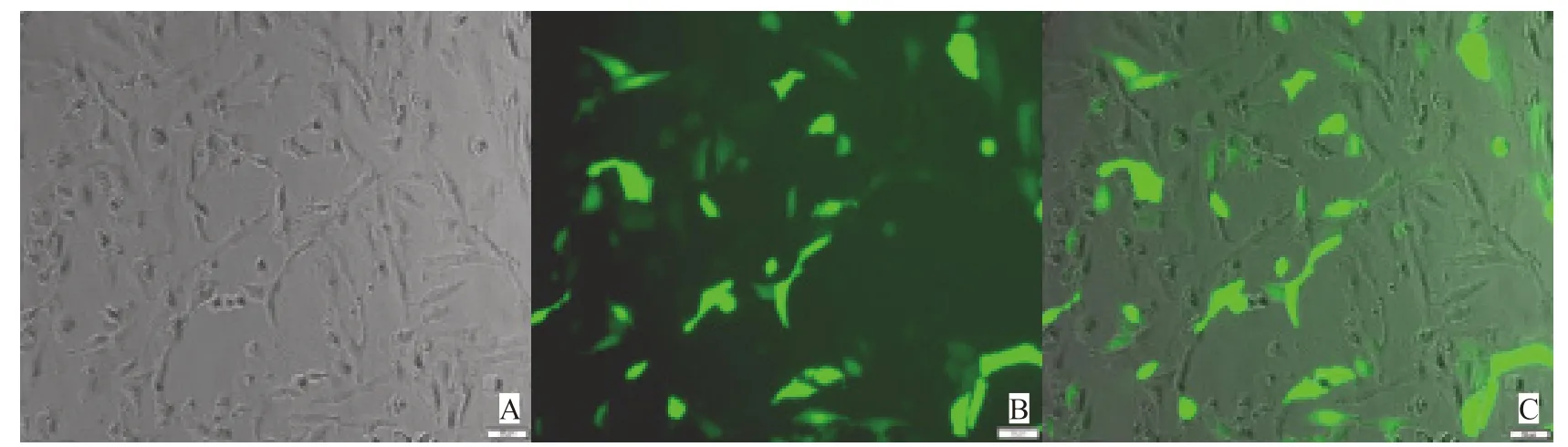
图5 RNA干扰KAT3b转染EC109细胞荧光显微镜观察结果 Fig.5 Fluorescent microscopy observations of R N A interfering KAT3b transfected EC109 cells
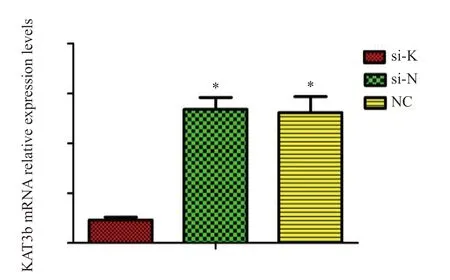
图6 RNA干扰KAT3b转染EC109细胞后KAT3b mRNA相对表达量Fig.6 Relative KAT3b mRNA expression after KAT3b transfection with EC109 cells
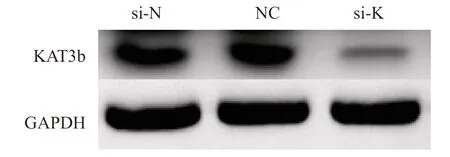
图7 RNA干扰KAT3b转染EC109细胞后KAT3b蛋白表达量 Fig.7 KAT3b protein expression after RNA interfering with KAT3b transfection of EC109 cells
2.9 下调KAT3b对ABCE1蛋白乙酰化的影响
免疫共沉淀实验结果显示,RNA干扰下调KAT3b 后,si-K组ABCE1乙酰化水平显著下降(P>0.05),而si-N和NC组乙酰化水平差异无统计学意义(P<0.05,图8),提示抑制KAT3b的表达可以明显降低EC109细胞中ABCE1乙酰化水平。Si-K: KAT3b si-RNA group; Si-N: Negative control group; NC: Blank control group.
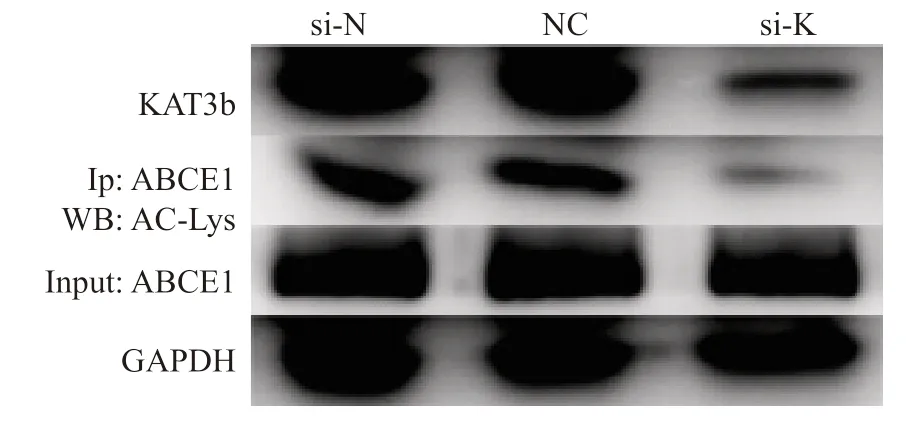
图8 RNA干扰KAT3b转染EC109细胞后ABCE1乙酰化水平 Fig.8 Acetylation levels of ABCE1 after RNA interfering with KAT3b transfection of EC109 cells
3 讨 论
食管癌发病隐匿,发现时往往已进展至中晚期,故食管癌患者的总体预后不理想。目前食管癌的治疗主要以手术和放化疗为主,然而,放化疗对晚期食管癌患者的缓解率较低,往往会导致多种不良反应[7]。随着对癌基因的深入研究,靶向治疗为食管癌患者提供了更好的选择。
表观遗传学中的乙酰化修饰可以遗传性地调控基因的表达,并参与大多数细胞的生物学过程[8]。研究[9-10]证实,蛋白质乙酰化修饰在基因表达、调控及癌症启动等过程中起着至关重要的作用。ABCE1作为一种高度保守的转运蛋白,在多种肿瘤中呈高表达状态,在肿瘤发生、发展过程中扮演癌基因的角色。研究[3]表明,肿瘤组织中高表达的ABCE1与非小细胞肺癌、膀胱癌及多种肿瘤的细胞增殖、凋亡、转移及肿瘤耐药等关系密切。前期研究[11]发现,ABCE1在肺腺癌组织中呈高表达状态,且发生了乙酰化修饰,并与肺腺癌细胞的增殖、侵袭和转移密切相关。本研究发现,在食管癌组织中ABCE1蛋白呈高表达,而在正常食管黏膜内则呈低表达。本研究结果显示,ABCE1在食管癌组织中也发生了乙酰化修饰,且其乙酰化水平与食管癌的TNM分期、肿瘤分化程度及淋巴结转移具有明显的相关性,说明ABCE1是一种乙酰化蛋白,而且其乙酰化修饰可能参与了食管癌的增殖、侵袭和转移。
KAT3b是乙酰基转移酶家族中的代表性成员之一,不仅可以催化组蛋白发生乙酰化,可以催化多种非组蛋白底物发生乙酰化,并参与多种癌症的发生、发展。本研究证实,食管癌组织中KAT3b蛋白呈高表达,且与肿瘤分期、分化和淋巴结转移相关。但在食管癌中KAT3b作为乙酰基转移酶能否催化ABCE1的乙酰化修饰进而调控食管癌的发生、发展需要进一步验证。本研究通过生物信息学软件预测显示,KAT3b可以将ABCE1蛋白作为底物催化其发生乙酰化,其可能发生乙酰化的赖氨酸(K)为19和397号位点。进一步研究发现,在食管癌组织中ABCE1和KAT3b蛋白共表达于细胞质,且二者呈现高表达状态,说明在食管癌中KAT3b可以与ABCE1相互作用,KAT3b作为乙酰基转移酶可能参与ABCE1蛋白的乙酰化修饰过程。进一步通过统计学分析了KAT3b和ABCE1乙酰化水平的相关性,结果表明在食管癌组织中,KAT3b的阳性表达与ABCE1高乙酰化呈正相关,提示KAT3b作为乙酰基转移酶可能参与ABCE1的乙酰化修饰,从而促进食管癌细胞的增殖、侵袭和转移。
研究[12-13]证实,在不同的肿瘤细胞中通过抑制乙酰化转移酶途径抑制肿瘤细胞的作用亦不相同。本研究结果提示食管癌细胞内KAT3b作为乙酰基转移酶催化了非组蛋白ABCE1的乙酰化修饰,进而调控食管癌的发生、发展。
综上所述,在食管癌中KAT3b的表达与ABCE1乙酰化水平密切相关,KAT3b的高表达可能促进了ABCE1的高乙酰化状态,这可能是促进食管癌发生、发展的重要环节。
利益冲突声明:所有作者均声明不存在利益冲突。

