治疗前18F-FLT和18F-FDG PET/CT摄取异质性在局部晚期鼻咽癌疗效预测中的价值
马 光,区晓敏,胡超苏,宋少莉,杨忠毅
1.复旦大学附属肿瘤医院核医学科,复旦大学上海医学院肿瘤学系,复旦大学生物医学影像研究中心,上海分子影像探针工程技术研究中心 200032;2.复旦大学附属肿瘤医学放疗科、复旦大学上海医学院肿瘤学系 200032
鼻咽癌是中国南部常见的头颈部恶性肿瘤之一[1],其主要治疗手段为放射治疗。多项研究表明联合放疗及化疗有益于提高局部晚期鼻咽癌患者的预后[2-4],但由于肿瘤存在异质性,局部晚期鼻咽癌患者的治疗反应仍存在个体差异。因此,早期准确评估局部晚期鼻咽癌放化疗后预后能力对于临床治疗具有重要意义。正电子发射断层显像/X线计算机体层成像仪(positron emission tomography/computed tomography,PET/CT)作为功能分子影像已经广泛应用于肿瘤临床领域。其中,18F-胸苷(fluorothymidine,FLT)、18F-脱氧葡萄糖(fluorodeoxyglucose,FDG)作为PET/CT显像常用药物,可以分别从分子水平反映肿瘤能量代谢[5]和细胞增殖程度[6]。研究表明18F-FLT和18F-FDG PET/CT在早期预测肺癌[7]、食管癌[8]、三阴性乳腺癌[9]以及宫颈癌[10]等肿瘤的临床治疗预后中具有潜在性意义,但在预测局部晚期鼻咽癌放化疗后远期疗效方面未见报道。本研究旨在探讨治疗前18F-FLT和18F-FDG PET/CT显像在局部晚期鼻咽癌患者放化疗效果预测中的作用,并对两者的预测能力进行比较。
1 资料和方法
1.1 研究对象
回顾性分析复旦大学附属肿瘤医院2012年5月—2015年1月接受放化疗的局部晚期鼻咽癌患者。纳入标准如下:① 活检证实的原发性鼻咽癌,根据世界卫生组织(World Health Organization,WHO)分型为Ⅱ型或Ⅲ型;② 根据国际抗癌联盟(Union for International Cancer Control,UICC)/美国癌症联合会(American Joint Committee on Cancer,AJCC)第8版分期系统的T3-4N0-3M0和T1-2N2-3M0患者;③ 18 ~ 70岁;④ 治疗前2周完成全身18F-FLT和18F-FDG PET/CT显像。排除标准如下:① 经临床或影像学证据证实有远处转移;② 既往确诊或合并有其他原发恶性肿瘤者;③ 妊娠试验阳性的育龄妇女;④ 患有精神障碍或者其他影响理解和签署知情同意书能力的精神疾病。本研究符合1964年赫尔辛基宣言及其后来修订的伦理标准。
1.2 治疗和随访
所有患者均接受新辅助化疗及调强放射治疗。具体如下,化疗:第1 天行多西他赛(75 mg/m2),顺铂(75 mg/m2)以及第1 ~ 5天连续行5-氟尿嘧啶(500 mg/m2)治疗,随后放疗期间每3周行顺铂治疗(8 mg/m2);放疗:T1-2期原发肿瘤总剂量为66 Gy(30次分割),T3-4期肿瘤为70.4 Gy(32次分割)。治疗结束后,前2年每3个月行MRI和鼻咽镜检查,第3 ~ 5年每半年行MRI和鼻咽镜检查,5年以后每年行MRI和鼻咽镜检查。CT、PET/CT等检查在需要时进行。随访结点:无进展生存期(progression-free survival,PFS),定义为从治疗开始至肿瘤进展或者发生任何原因死亡的时间。病灶评估依据实体瘤疗效评价标准1.1(Response Evaluation Criteria In Solid Tumor,RECIST 1.1)。
1.3 PET/CT显像
18F-FLT和18F-FDG PET/CT显像分别在2 d内进行,且18F-FLT和18F-FDG PET/CT显像时间间隔小于1周。18F-FLT和18F-FDG均由本科室合成,放化纯大于95%。18F-FDG PET/CT显像要求:患者于注射示踪剂前禁食4 ~ 6 h,空腹血糖低于10 mmol/L。注射剂量为7.4 MBq/kg,注射前后,患者平卧、休息1 h,随后由Siemens Biograph 16HR PET/CT 扫描仪采集图像,扫描范围自大腿近端及颅顶,先行CT扫描,再行PET采集。CT扫描参数如下:管电压120 Kv,管电流110 mA,层厚5 mm,球管旋转时间为0.5 s,螺距1 mm,并采用标准重建法重建CT图像。PET采集参数:运用三维模式,采集6 ~ 8个床位,每个床位2 ~ 3 min。并采用有序子集最大期望值迭代法重建PET图像。通过应用CT数据进行衰减校正后融合PET/CT图像。18F-FLT PET/CT显像要求:所有条件与18F-FDG PET/CT成像相同,只是患者注射示踪剂前不需要控制血糖。
1.4 PET/CT半定量分析
由2位经验丰富的核医学科医师独立阅片,意见不同时通过讨论达成一致。测量原发肿瘤和转移淋巴结的最大标准化摄取值(maximal standardized uptake value,SUVmax)、平均标准化摄取值(mean standardized uptake value,SUVmean)、增殖性肿瘤体积(proliferative tumor volume,PTV)、代谢性肿瘤体积(metabolic tumor volume,MTV)、病灶腺苷代谢总量(total lesion thymidine,TLT)、病灶葡萄糖代谢总量(total lesion glucose,TLG)及肿瘤异质性(heterogeneity index,HI),上述指标分别记为SUVmax-T、SUVmax-N,SUVmean-T、SUVmean-N,PTV-T、PTV-N,MTV-T、MTV-N,TLT-T、TLT-N,TLG-T、TLG-N,以及HI-T、HI-N。其中,TLG(TLT)=SUVmean×MTV(PTV);HI=SUVmean/SUVmax;计算过程中,若存在多个转移淋巴结,则选择SUVmax最大者为本研究的淋巴结研究对象。我们分别以SUV=2.5、40%SUVmax、50%SUVmax、60%SUVmax、70%SUVmax作为18F-FDG PET/CT阈值测量并计算上述相关参数,同时以SUV=1.5、40%SUVmax、50%SUVmax、60%SUVmax、70%SUVmax作为18F-FLT PET/CT阈值测量并计算上述相关参数[11]。
1.5 统计学处理
采用INM SPSS 20.0软件和Graphpad prism 8软件进行统计学分析以及图像处理。年龄、随访时间、生存期等均采用中位数表示,定性资料采用频数(百分比)表示。先通过Spearman等级相关系数分析PET/CT参数与复发患者的相关性,并选出P<0.05的变量。采用时间依赖性受试者工作特征(receiver operating characteristic,ROC)曲线筛选最佳界值,同时评价其预测效能。最后依据Kaplan-Meier法绘制生存曲线,生存曲线的比较采用log-rank检验。P<0.05为差异有统计学意义。
2 结 果
2.1 一般临床资料与随访结果
共纳入24例接受TP方案放化疗的局部晚期鼻咽癌患者,其中男性21例(87.5%),女性3例(12.5%);TNM分期Ⅲ、ⅣA期分别有14例(58.33%)和10例(41.67%);截至随访时间,鼻咽部复发2例,淋巴结及肺转移共4例,尚未出现死亡病例,中位随访时间为74.51个月。
2.2 PET/CT参数与局部晚期鼻咽癌患者复发/转移相关性分析
分别以鼻咽癌原发灶(T)和区域内转移淋巴结(N)计算18F-FDG和18F-FLT PET/CT相关参数,并与复发/转移相关性进行分析(表1)。相关性分析中,仅见在18F-FLT PET/CT显像中,以70%SUVmax为阈值时,原发灶瘤内 HI(T-FLT-70%SUVmax)与复发/转移具有相关性,相关系数为0.423(P=0.04)。而其他PET/CT参数与复发/转移均未见显著相关性(均P>0.05,表1)。
2.3 生存分析
24例局部晚期鼻咽癌患者接受含TP方案放化疗后,病变均达到完全消退。随访中,复发或转移患者共6例。依据时间依赖性ROC曲线分析结果分别获得相关参数的最佳界值及相应P值,对患者进行生存分析,早期预测其PFS。计算得出以0.828作为患者原发灶HI(T-FLT-70%SUVmax)最佳界值时,其曲线下面积(areaunder curve,AUC)面积为0.80,灵敏度为80.00%,特异度为79.90%(P=0.043,图1A)。并以HI(T-FLT-70%SUVmax)=0.828对患者进行生存分析,结果显示,当HI(T-FLT-70%SUVmax)≤0.828时,其患者的中位PFS尚未达到,明显长于HI(T-FLT-70%SUVmax>0.828患者的中位PFS(57.99个月),差异有统计学意义(P=0.014,图1B,表2)。
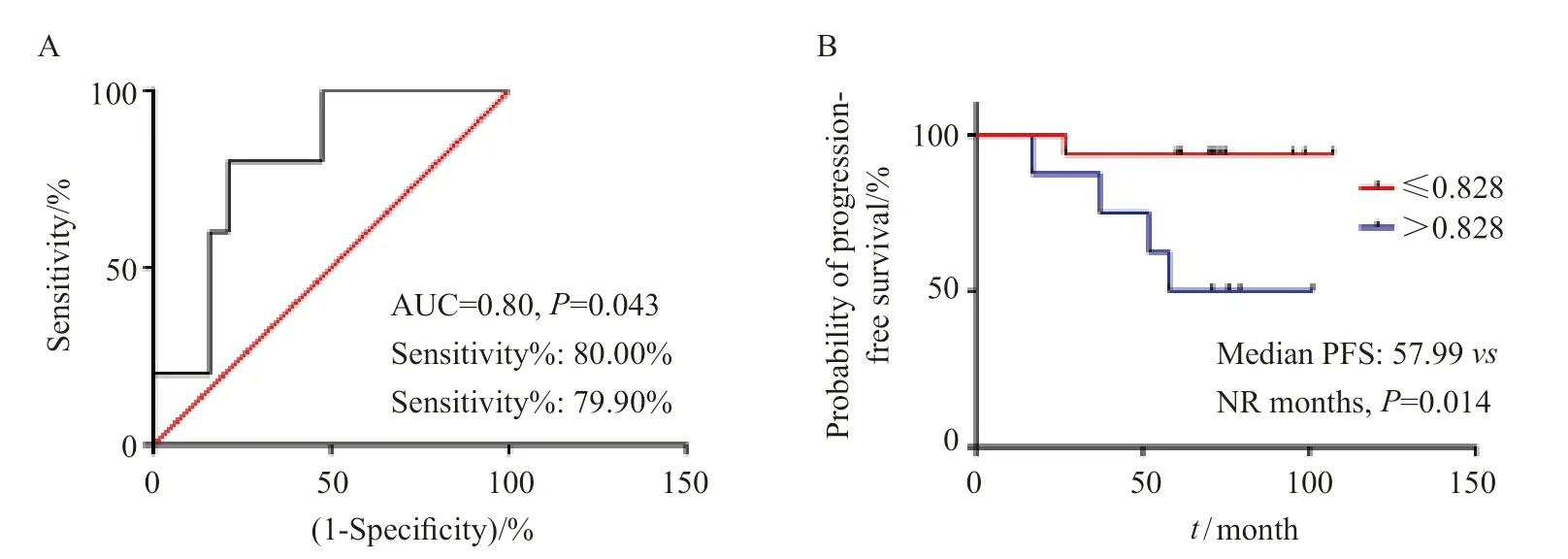
图1 受试者工作特性曲线分析HI预测PFS的能力(A)及基于PFS的Kaplan-Meier曲线(B)Fig.1 The ability of HI was analyzed by receiver operating characteristic curve for PFS (A) and Kaplan-Meier curves of PFS (B)
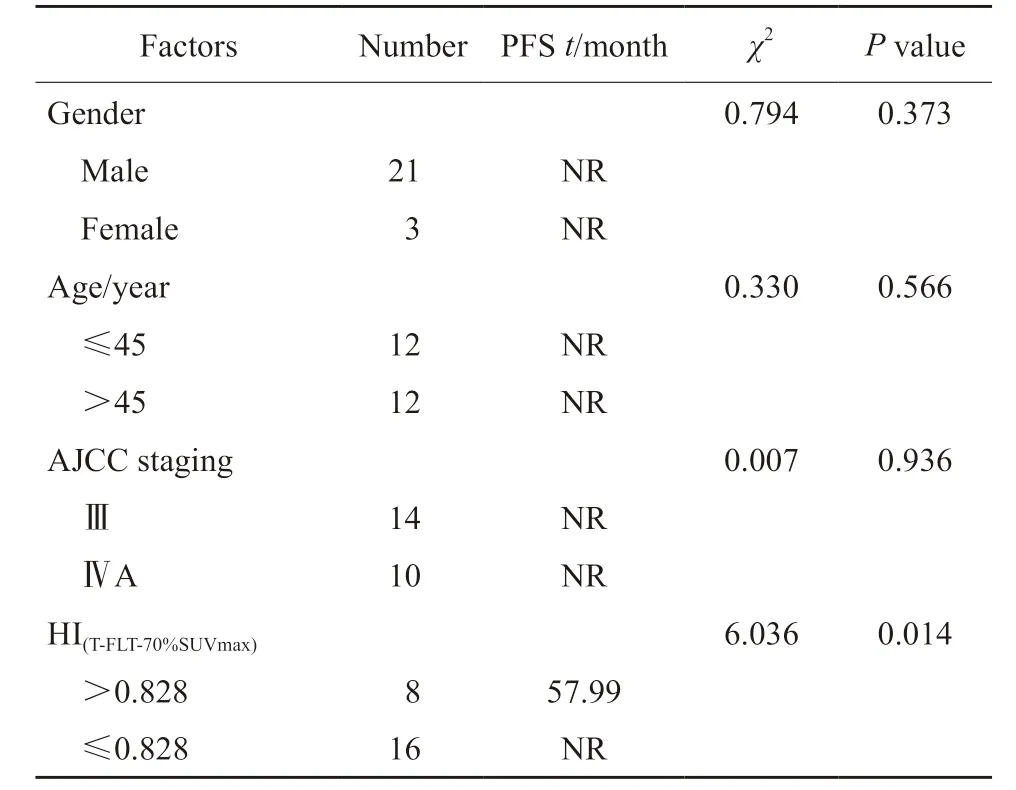
表2 鼻咽癌患者临床指标及PET/CT参数对PFS的单因素分析结果(n=24)Tab.2 Univariate analysis results of clinical indexes and PET/CT parameters on PFS in patients with NPC (n=24)
3 讨 论
本研究旨在评估和比较18F-FLT和18F-FDG PET/CT显像参数预测局部晚期鼻咽癌患者放化疗预后能力。结果显示,基于18F-FLT PET/CT显像的肿瘤HI可以早期预测接受联合放化疗的局部晚期鼻咽癌患者的预后,为临床精准个体化治疗提供潜在的理论支持。
作为功能成像技术,PET/CT已经广泛应用于临床肿瘤学领域,包括肿瘤的诊断、分期以及复发监测、疗效预测等[12]。前期,我们通过SUVmax、SUVmean、PTV/MTV、TLT/TLG等参数分别评估18F-FLT和18F-FDG PET/CT预测鼻咽癌放化疗的早期效果。结果显示,18F-FLT和18F-FDG PET/CT均具有预测鼻咽癌消退的能力,但18F-FLT PET/CT并未表现出明显优于18F-FDG PET/CT的预测能力[11]。对比前期研究,引入肿瘤异质性参数HI(HI=SUVmean/ SUVmax)[13-14],并与SUVmax、SUVmean、MTV(PTV)、TLG(TLT)等常规参数共同评估局部晚期鼻咽癌患者的预后,结果仅见HI(T-FLT-70%SUVmax)与局部晚期鼻咽癌放化疗后复发/转移具有相关性(P<0.05)。以HI(T-FLT-70%SUVmax)=0.828为最佳界值进行生存分析,结果显示,肿瘤HI越高,患者PFS越短(P=0.014),与前期我们基于18F-FDG PET/CT肿瘤HI预测复发鼻咽癌碳离子放疗预后的研究结果一致[13]。同时,其ROC曲线的AUC值为0.80,均高于基于18F-FLT PET/CT显像的常规参数,SUVmax、MTV、TLT预测局部复发鼻咽癌碳离子放疗预后的AUC值为0.6、0.69和0.72[15]。
肿瘤的治疗存在个体差异。目前已证实,此治疗差异可能归因于细胞代谢、增殖、血管生成、肿瘤坏死以及肿瘤纤维化等因素,即肿瘤内异质性[13]。但就目前的诊疗技术,其肿瘤异质性很难被直接量化。近年来,研究者通过使用纹理分析[16]、变异系数[17]、累积SUV-体积直方图[18]、累积SUV-体积直方图下面积[18]和分形分析[19]等方法研究基于PET/CT显像的肿瘤内异质性与肿瘤预后的相关性,均取得令人满意的结果。如Nakajo等[20]对基于18F-FLT和18F-FDG PET/CT图像进行纹理分析,并通过强度变异性以及大小区域变异性作为HI来预测结直肠癌复发。结果显示,HI值越高,预后越差。Paulina等[10]对基于18F-FLT和18F-FDG PET/CT的图像进行分析,使用累积SUV-体积直方图作为HI来预测宫颈癌患者预后,结果显示,两种显像剂的HI值越高,预后越差,这都与本文结果高HI预后越差一致。但是上述反映HI的方法均过于复杂,缺乏临床实用性。而本文采用SUVmean/SUVmax作为肿瘤异质性的指标进行预后分析,方法简单、参数易得,易于临床推广,并且本课题组前期研究结果也证实基于18F-FDG PET/CT显像肿瘤内HI是预测局部复发鼻咽癌碳离子放疗效果的独立预测因子,具有良好的预测能力[13]。
因此,本研究提出基于18F-FLT PET/CT肿瘤内异质性参数,对于预测局部晚期鼻咽患者放化疗效果具有潜在价值,可以指导临床个体化治疗。同时本研究存在一些不足:① 本研究为回顾性研究,且样本量较小,目前所得结论仍需大样本研究进一步验证。② 事件数较少,无法进行多因素分析。③ 研究表明EBV DNA水平是鼻咽癌患者预后的显著影响因素,但由于缺乏相关临床数据,在此未行相关讨论。
利益冲突:所有作者均声明不存在利益冲 突。

