雷帕霉素缓解奶牛乳腺上皮细胞炎症反应的作用机制
徐连彬,任怡飞,兰伟,侯鹏飞,刘红云
(浙江大学动物科学学院奶业科学研究所,杭州 310058)
乳腺炎是奶牛的常见疾病,严重影响动物福利和牧场的经济效益[1]。大肠埃希菌是一种革兰氏阴性菌,也是临床型乳腺炎的常见致病菌。有研究表明,来自大肠埃希菌的内毒素脂多糖(lipopolysaccharide,LPS)以剂量依赖的方式引起奶牛乳腺组织的炎症反应[2]。在实际生产中,牧场通常采用抗生素来治疗奶牛的乳腺炎[3]。然而,抗生素的滥用通常会引起细菌的耐药性,进而威胁动物安全和公共卫生健康[4-5]。因此,开发针对乳腺炎的新型防治方法迫在眉睫。
雷帕霉素(rapamycin,RAP)是一种大环内酯类免疫抑制剂,可抑制哺乳动物雷帕霉素靶蛋白的活性。前人的研究发现,雷帕霉素同样具有抵抗炎症的作用。在载脂蛋白-E敲除小鼠中,雷帕霉素抑制单核细胞的趋化性并减缓动脉粥样硬化斑块的发展[6];口服雷帕霉素可减轻小鼠炎症的进展[7]。有证据表明,核因子-κB(nuclear factor-κB,NF-κB)和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路对炎症起始及抗炎因子的产生具有重要的调控作用[8-9]。然而,人们关于雷帕霉素对奶牛乳腺上皮细胞(mammary alveolar cell-T,MAC-T)炎症反应的影响及作用机制还缺乏进一步的认识。本研究旨在探究雷帕霉素能否通过NFκB/MAPK 通路缓解LPS诱导的MAC-T细胞炎症,相关结果可为评估雷帕霉素治疗乳腺炎的应用前景提供借鉴。
1 材料与方法
1.1 试验材料
试验细胞:MAC-T 细胞由美国佛蒙特大学赵凤启教授馈赠。
1.2 试剂
LPS(货号:L2630)购自美国Sigma 公司;达尔伯克改良依格尔培养基(Dulbecco’s modified Eagle medium,DMEM)和胎牛血清(货号:10091155)购自美国Gibco 公司;青霉素和链霉素混合液(货号:CP010)购自杭州科易生物技术有限公司;二喹啉甲酸(bicinchoninic acid, BCA)蛋白浓度测定试剂盒(货号:P0012S)、蛋白质印迹法(Western blotting)封闭液(货号:P0235)、细胞计数试剂盒-8(cell counting kit-8,CCK8)、NF-κB 激活-核转运检测试剂盒(货号:SN368)、Cy3 标记山羊抗兔IgG(货号:A0516)、4′,6-二脒基-2-苯基吲哚二盐酸盐[2-(4-amidinophenyl)-6-indolecarbamidine dihydrochloride,DAPI]细胞核染色液(货号:C1002)和Annexin VFITC/PI 细胞凋亡试剂盒(货号:C1062L)均购自上海碧云天生物技术有限公司;蛋白质印迹法及免疫荧光染色实验中采用的磷酸化/总的c-Jun N 末端激酶(c-Jun N-terminal kinase,JNK)一抗购自杭州华安生物技术有限公司;p38 MAPK(货号:4511/9212)、NF-κB p65(货号:8242/3033)和内参βactin(货号:3700)一抗购自美国CST(Cell Signaling Technology)公司;白介素-8(interleukin-8,IL-8)、白介素-1β(interleukin-1β, IL-1β)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)酶联免疫试剂盒购自上海酶联生物技术有限公司。
1.3 细胞培养与处理
MAC-T 细胞生长于含25 mmol/L 葡萄糖、10%胎牛血清、100 IU/mL 青霉素和100 IU/mL 链霉素的DMEM(对照组培养基,记为CK)中。细胞贴壁后,弃去培养基并替换为含不同质量浓度(0、1、10、100 μg/mL)LPS 的新鲜培养基,分别培养6、12 和24 h 以获得合适的LPS 处理浓度和时间。随后,在对照培养基(CK)和合适的LPS 处理条件下分别添加不同浓度(0、10、50 和100 mmol/L)的雷帕霉素,以确定雷帕霉素的适宜处理浓度。结果表明:100 μg/mL LPS 处理24 h 显著增加了培养基上清液中IL-8、IL-1β和TNF-α的浓度;同时,10 mmol/L 雷帕霉素显著降低了LPS 诱导的IL-1β和TNF-α分泌量。故选择100 μg/mL LPS和10 mmol/L雷帕霉素作为后续的处理条件。
为研究雷帕霉素对LPS 诱导的炎症的调节作用,分别在以下4种培养基中处理MAC-T细胞24 h,以确定雷帕霉素对LPS 诱导的炎症反应的影响:1)不添加LPS和雷帕霉素的对照培养基(CK);2)在对照培养基中添加100 μg/mL LPS(记为LPS100);3)在对照培养基中添加10 mmol/L的雷帕霉素(记为RAP10);4)在对照培养基中添加100 μg/mL LPS 和10 mmol/L 雷帕霉素(记为LPS100+RAP10)。每组6个重复,处理结束后,收集细胞和上清液用于后续测定。
1.4 细胞活力和凋亡测定
将100 μL 5×104mL-1MAC-T细胞接种于96孔板中,细胞贴壁后用LPS或雷帕霉素刺激24 h,处理结束后,弃去培养基并替换为含10 μL CCK8的新鲜培养基后继续处理4 h。采用SpectraMAX M5酶标仪(美国Molecular Devices公司)测定每孔在550 nm波长下的吸光度以计算细胞活力变化。采用Annexin V-FITC/PI 细胞凋亡检测试剂盒测定处理后MAC-T 细胞的凋亡情况,具体操作如下:以5×104mL-1的密度将MAC-T细胞接种于6孔板中,处理结束后采用胰酶消化细胞并转移至离心管中,按比例加入Annexin V-FITC 和PI 2 种染料,并设置Annexin V-FITC和PI双染组、Annexin V-FITC或PI单染组以及不加染料的阴性对照组;避光孵育15 min后采用流式细胞仪(美国BD公司)进行检测。
1.5 细胞炎症因子浓度测定
对细胞进行上述处理后,吸取培养基至离心管中,在4 ℃条件下,以3 000 r/min离心15 min后收集上清液。参考上海酶联生物技术有限公司相关试剂盒的操作说明检测相关炎症因子的浓度。
1.6 免疫荧光测定
免疫荧光检测参考NF-κB激活-核转运检测试剂盒的操作说明。处理结束后用磷酸盐缓冲液(phosphate buffered saline,PBS)冲洗细胞并对细胞进行固定和透化;封闭结束后,在4 ℃条件下,将细胞与p65 抗体孵育过夜,随后采用Cy3 标记山羊抗兔IgG室温孵育1 h,并加入细胞核染色液室温染色5 min;最后,向细胞中滴加适量抗荧光淬灭封片液并用盖玻片封片,于IX81-FV1000激光共聚焦显微镜(日本Olympus公司)下进行观察。
1.7 蛋白免疫印迹分析
蛋白免疫印迹分析参考前期研究中描述的方法[10],即吸取20 μg蛋白质,经十二烷基硫酸钠-聚丙烯酰胺(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)凝胶电泳分离后转移至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上,在室温条件下封闭2 h,并分别与磷酸化蛋白质和总的JNK、p38 及p65 一抗在4 ℃条件下孵育过夜;之后,采用辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔二抗于室温下继续孵育2 h并用化学发光免疫分析系统检测条带的灰度。
1.8 数据统计与分析
试验数据表示为平均值±标准差,采用SAS 9.2软件的MIXED程序进行数据分析,统计模型包括处理的固定效应和试验批次的随机效应。采用Tukey HSD 检验对组间的差异进行分析,以P<0.05 表示差异有统计学意义。采用Origin 2018软件绘图。
2 结果与分析
2.1 LPS 对MAC-T 细胞炎症因子分泌的影响
不同浓度的LPS处理不同时间对MAC-T细胞炎症因子分泌的影响不同。与对照组(CK)相比,100 μg/mL LPS 处理24 h 显著增加了培养基上清液中IL-8的浓度(P<0.05,图1A),而IL-1β和TNF-α浓度则在这3个处理时间点均显著升高(P<0.05,图1B~C)。如图2A 所示,与对照组相比,100 μg/mL LPS处理后,蓝色DAPI标记的细胞核区域内红色标记的p65蛋白明显增加,表明LPS促进了p65蛋白从细胞质到细胞核的转移。此外,100 μg/mL LPS处理未显著改变MAC-T细胞的活力与凋亡(图2B)。
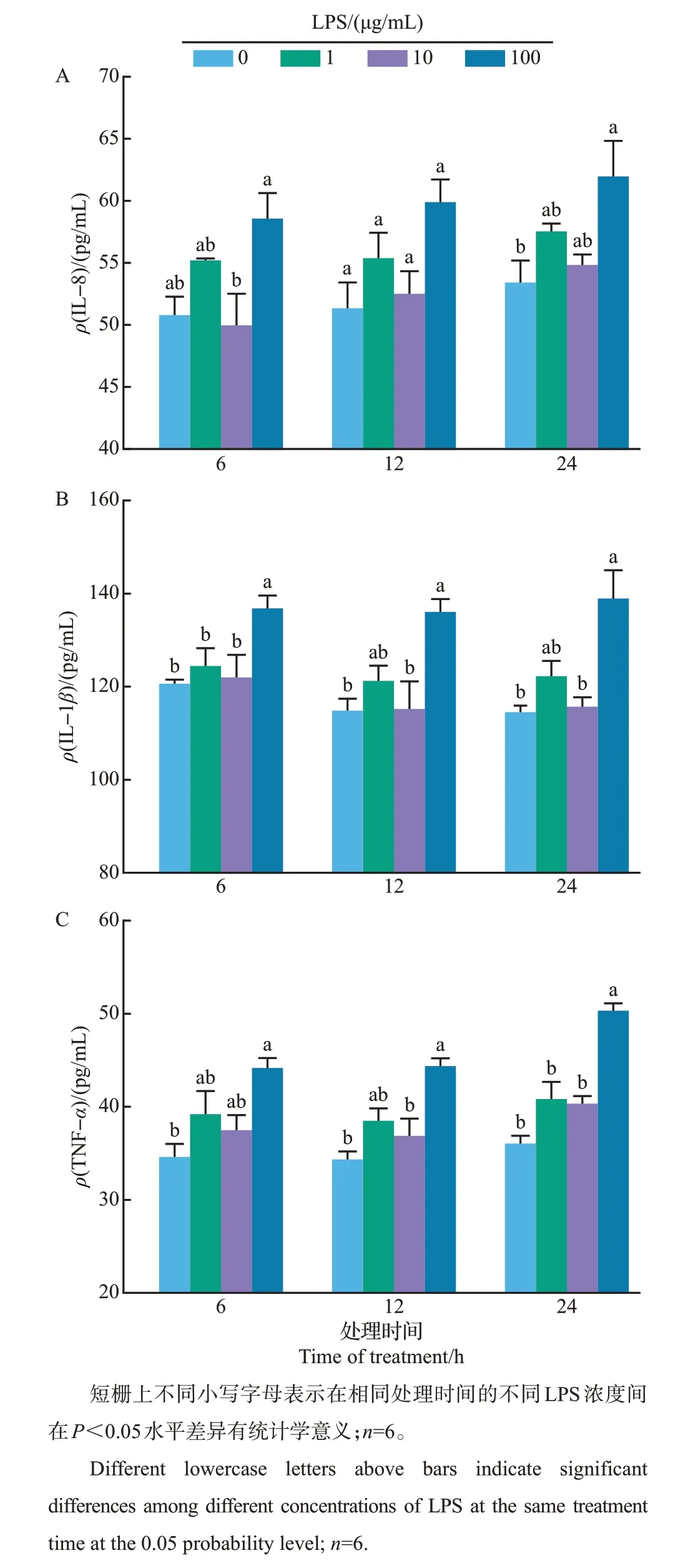
图1 不同浓度LPS对MAC-T细胞炎症因子分泌的影响Fig.1 Effects of different concentrations of LPS on inflammatory cytokine secretions in MAC-T cells

图2 100 μg/mL LPS 对MAC-T 细胞NF-κB 通路、活力和凋亡的影响Fig.2 Effects of 100 μg/mL LPS on NF-κB signaling pathway,viability and apoptosis of MAC-T cells
2.2 雷帕霉素对MAC-T细胞炎症因子分泌的影响
由图3A 可知,不同浓度的雷帕霉素处理未改变细胞培养基上清液中IL-1β和TNF-α的浓度。然而,与对照组相比,添加10 mmol/L雷帕霉素显著抑制了LPS 刺激的IL-1β和TNF-α的分泌(P<0.05,图3B),鉴于雷帕霉素对乳蛋白合成的抑制作用,故选取该浓度为后续的处理条件。
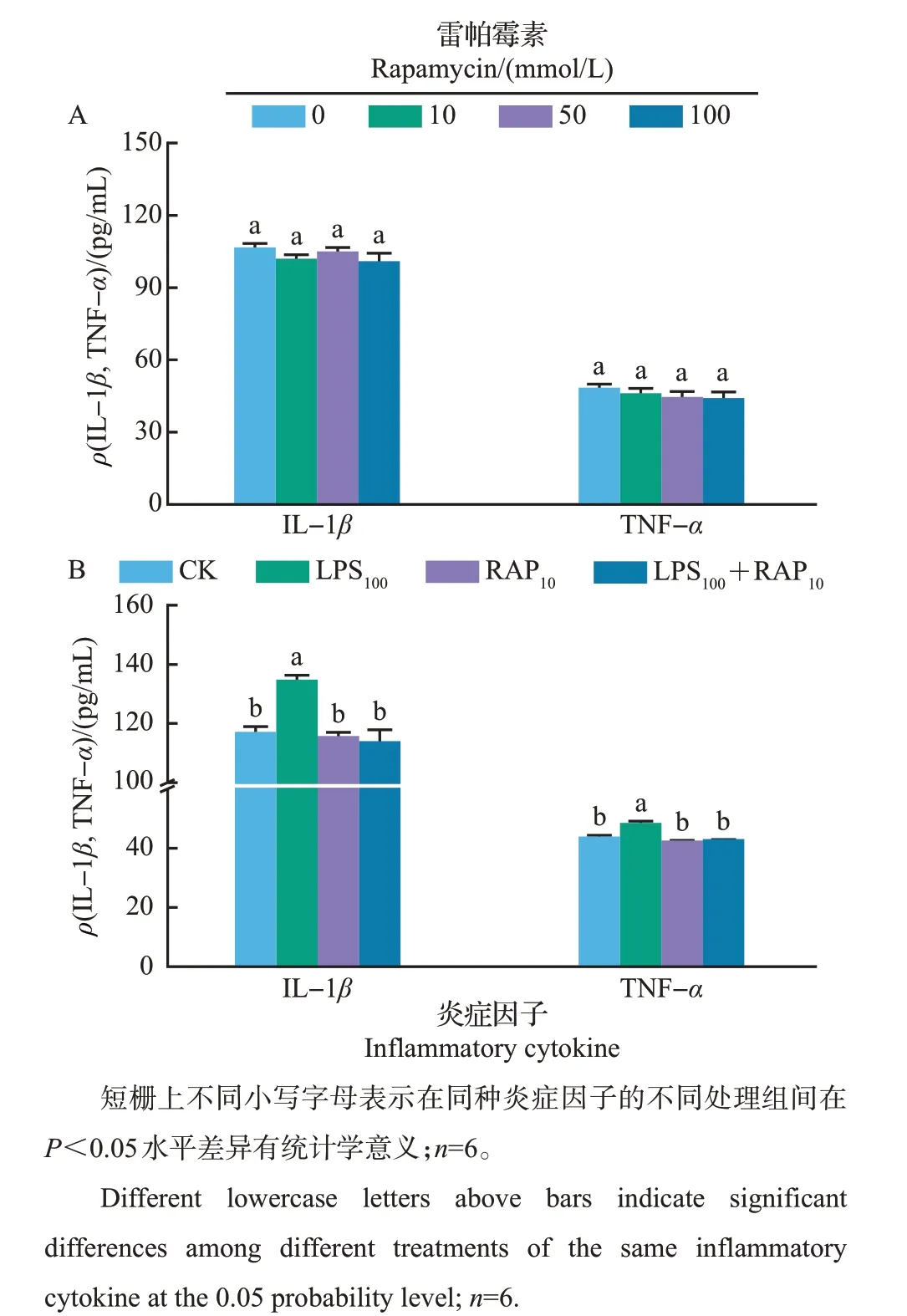
图3 不同浓度雷帕霉素对MAC-T 细胞炎症因子分泌的影响Fig.3 Effects of different concentrations of rapamycin oninflammatory cytokine secretions in MAC-T cells
2.3 雷帕霉素对MAC-T 细胞NF-κB 信号通路的影响
与对照组相比,100 μg/mL LPS 处理细胞24 h显著增加了NF-κB 信号通路中p65 蛋白的磷酸化水平(P<0.05,图4A),同时促进了p65 蛋白从细胞质向细胞核的转移(图4B)。与对照组相比,雷帕霉素单独处理不影响MAC-T 细胞p65 蛋白的磷酸化水平(P>0.05);然而,在LPS 处理基础上添加雷帕霉素降低了p65蛋白的磷酸化水平并抑制其向核转移(P<0.05,图4A~B)。

图4 LPS 和雷帕霉素对MAC-T 细胞NF-κB 信号通路的影响Fig.4 Effects of LPS and rapamycin on NF-κB signaling pathway of MAC-T cells
2.4 雷帕霉素对MAC-T细胞MAPK通路的影响
由图5 可知:与对照组相比,LPS100处理增加了MAPK 通路中JNK 和p38 蛋白的磷酸化水平,而雷帕霉素单独处理则降低了2 种蛋白的磷酸化水平(P<0.05);相比LPS100处理组,LPS100+RAP10组MAC-T细胞中JNK 和p38 蛋白的磷酸化水平显著下降(P<0.05)。
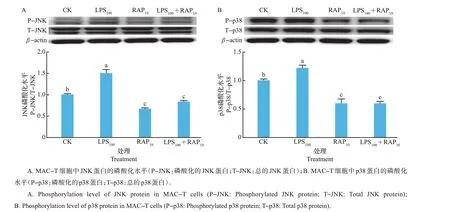
图5 LPS和雷帕霉素对MAC-T细胞MAPK信号通路的影响Fig.5 Effects of LPS and rapamycin on MAPK signaling pathway of MAC-T cells
3 讨论与结论
乳腺炎是奶牛中的常见疾病,多由细菌感染引起[11]。传统抗生素在乳腺炎治疗中的滥用导致细菌耐药性增加和药物残留等诸多问题[1]。以往研究表明,雷帕霉素具有一定的抗炎作用,但其在奶牛乳腺上皮细胞中的作用效果及具体机制尚不明确。而本研究发现,添加雷帕霉素后可通过NF-κB/MAPK信号通路缓解MAC-T细胞的炎症反应。
NF-κB 信号通路在奶牛乳腺炎症反应中具有重要的调节作用[12]。在未受刺激的细胞中,NF-κB二聚体通过与其抑制分子IκB相互作用被隔离在细胞质中[13]。当LPS 刺激时,IκB 被磷酸化,导致其与NF-κB解离,进而转移至细胞核中并促进炎症因子产生[14]。本研究中,LPS 处理显著增加了NF-κB 通路中p65 蛋白的磷酸化水平并促进其向细胞核转移,提示细胞炎症模型构建成功。此外,雷帕霉素添加可有效抑制LPS刺激的炎症因子分泌和p65蛋白向细胞核转移,提示雷帕霉素对MAC-T 细胞的炎症反应具有一定的缓解作用。这与BAO 等[15]报道的结果类似,即雷帕霉素引起的mTORC1抑制降低了巨噬细胞中鞭毛蛋白诱导的TNF-α和IL-6 分泌。与此相反,另有研究报道,增加雷帕霉素的使用可能会引起一些炎症反应,例如淋巴细胞性肺泡炎和肾小球肾炎等[16-17]。因此,雷帕霉素治疗乳腺炎的具体效果及机制还需要进一步研究与验证。
MAPK 信号通路与奶牛乳腺炎症的起始存在一定关系,其主要包括3 个级联蛋白:JNK1/2/3、胞外信号相关激酶(extracellular signal-related kinases,ERK1/2)和p38-MAPK[18]。MUNOZ等[9]指出,MAPK通路的激活信号是神经炎症的重要调节因子,并在神经退行性疾病中发挥重要作用。这一报道与我们观察到的LPS刺激JNK和p38蛋白的磷酸化水平上升相一致。已有研究表明,p38-MAPK轴可调节神经胶质细胞炎症因子的合成与分泌[19-20]。本研究中,雷帕霉素的添加抑制了LPS 对p38 和JNK 蛋白磷酸化水平的刺激作用,提示MAPK信号通路可能介导了雷帕霉素对MAC-T细胞炎症反应的调节。
综上所述,雷帕霉素的添加缓解了LPS 诱导的MAC-T细胞炎症反应。在该过程中,NF-κB/MAPK信号通路可能发挥了重要的调节作用。

