白茶花青素苷的结构鉴定与分析
胡金祥,叶钰珊,蔡梅生,张青碧,李博,吴媛媛,屠幼英,何普明*
(1.浙江大学农业与生物技术学院茶学系,杭州 310058;2.福鼎市茶业发展领导小组办公室,福建 宁德 355200;
3.福鼎市茶业管理局,福建 宁德 355200)
花青素苷是以花青素为苷元经糖基化形成的糖苷类物质,是花青素的主要存在形态,广泛分布于植物中。目前,已被分离鉴定的花青素苷超过635 种,其花青素配基以飞燕草素、矢车菊素(又称芙蓉花素)、天竺葵素、芍药素、矮牵牛素和锦葵素为主。研究表明,花青素苷具有抗氧化和清除自由基[1]、消炎抑菌[2]、降血压[3]、降脂减肥[3]、降血糖[3]、抗癌[4]、改善视力[5]、保护肝脏[6]和心脑血管[7]等生理功效。作为一种天然无害、有益健康的药食两用资源,花青素苷在食品、化妆品、医药保健品等领域具有十分广阔的开发利用前景。
茶树[Camellia sinensis(L.) O. Kuntze]中普遍存在花青素苷[8]。吕海鹏等[9]用高效液相色谱(high performance liquid chromatography, HPLC)法检测出紫娟烘青绿茶花青素苷的主要组分为矢车菊素-3-O-半乳糖苷(0.227 0 mg/g)、天竺葵素-3,5-二葡萄糖苷(0.083 5 mg/g)、锦葵素(0.070 5 mg/g)和天竺葵素(0.046 3 mg/g)。LÜ 等[1]采用HPLC 法和液相色谱-质谱联用(liquid chromatography-mass spectrometry,LC-MS)技术在不同加工工艺的紫娟茶(绿茶、红茶及乌龙茶)中均检测到8种花青素苷:矢车菊素-3-O-半乳糖苷、天竺葵素-3,5-二葡萄糖苷、矢车菊素-3-O-葡萄糖苷、矢车菊素、飞燕草素、芍药素、天竺葵素和锦葵素,其中矢车菊素-3-O-半乳糖苷含量最高。目前,对茶叶花青素苷的研究主要集中在红紫化茶树鲜叶及其相关制品上,鲜有关于茶树绿色芽叶花青素苷的研究报道。本研究选用白茶作为研究材料,通过HPLC-MS 法初步鉴定了白茶中主要的花青素苷组分,分析了白茶花青素苷的组成特点与含量,旨在为白茶花青素苷组分分析提供科学支撑。
1 材料与方法
1.1 材料与试剂
白茶样品(白毫银针、白牡丹、贡眉和寿眉)由福建省鼎白茶业有限公司、福建省六妙白茶股份有限公司、福建省大沁茶业有限公司、福建省裕荣香茶业有限公司和福建省福鼎市西坑孔家茶业有限公司无偿提供。所有茶样经磨碎后密封保存,备用。
甲醇、甲酸、盐酸、乙醚、三氯甲烷、乙酸乙酯均为分析纯,购于国药集团化学试剂上海有限公司;乙腈(色谱纯),购于美国TEDIA公司;矢车菊素-3-O-葡萄糖苷标准品(纯度>98%),购于大连美仑生物技术有限公司;Amberlite XAD-7HP 离子交换大孔吸附树脂(20~60目),购于上海源叶生物科技有限公司。
1.2 仪器与设备
ZORBAX SB-C18 HPLC 柱(4.6 mm×250 mm,5 μm)(美国Agilent 公司);LC-2010AHT 型HPLC仪(日本Shimadzu 公司);5804R 离心机(德国Eppendorf公司);GR150A型磨粉机(合肥荣事达小家电有限公司);KQ-500E型超声波清洗器(江苏省昆山市超声仪器有限公司);Venticell 111 电热恒温鼓风干燥箱(德国MMM公司);AL104电子天平(瑞士Mettler Toledo 公司);SHB-111A 循环水式多用真空泵(上海豫康科教仪器设备有限公司);RE-2000B 旋转蒸发浓缩仪(上海亚荣生化仪器厂);6460型LC-MS仪(美国Agilent公司)。
1.3 方法
1.3.1 花青素苷的提取
参照文献[10-11]及预实验的结果,采用超声波辅助、酸性甲醇提取法提取供试白茶中的花青素苷,提取条件为1%盐酸-甲醇(体积比1∶99)溶液、料液质量体积比1∶25,在室温条件下超声波辅助提取30 min,提取2 次,离心、合并上清液,然后将初提的白茶花青素苷浸提液在35 ℃条件下真空旋转蒸发浓缩至近干,加入少量蒸馏水后继续旋转蒸发至无甲醇残留。得到的花青素苷水溶液依次用乙醚、三氯甲烷、乙酸乙酯萃取至有机层呈无色,以除去其中的脂溶性色素、咖啡碱和除花青素苷外的茶多酚等物质。萃取水层过XAD-7HP 树脂层析柱,先用2 L 0.1%盐酸溶液洗脱以除去可溶性糖、氨基酸等杂质,再用2 L 0.1%盐酸-甲醇溶液洗脱至无有色物质流出,收集洗脱液,在35 ℃条件下旋转蒸发至无甲醇残留,加入少量蒸馏水溶解后,过0.22 μm有机滤膜,于4 ℃冰箱中保存,备用。
1.3.2 标准品溶液的配制
精确称取5 mg 矢车菊素-3-O-葡萄糖苷标准品并完全溶于5 mL 1%盐酸-甲醇溶液中,取0.3 mL 该溶液定容至10 mL 比色管中,过0.45 μm 有机滤膜,备用。
1.3.3 HPLC-MS 分析条件
HPLC 分析条件:ZORBAX SB-C18 HPLC 柱(4.6 mm×250 mm,5 μm),流动相A为1%甲酸溶液,流动相B为乙腈,其中,B相体积分数在0~55 min内从10% 匀速增加至40%;柱温30 ℃;流速0.8 mL/min;进样量10 μL;检测波长520 nm。
MS分析条件:采用电喷雾电离源,正离子扫描模式,分子量扫描范围为50~1 000 kDa。运用PeakView 1.2软件分析质谱数据。
花青素苷含量计算公式:
w(花青素苷)/(μg/g)=[标准品质量浓度/(μg/mL)×提取液总体积/L×花青素苷峰面积×1 000]÷(标准品峰面积×样品质量/g).
1.3.4 数据分析
试验数据使用SPSS 25.0 软件进行统计分析,并使用t检验进行组间差异显著性分析。
2 结果与分析
2.1 白茶花青素苷组分结构鉴定
2.1.1 HPLC 分析
自制白茶(寿眉)花青素苷的HPLC分析结果如图1所示。在花青素苷特征检测波长520 nm处共检测到13个色谱峰,表明白茶可能含有13种花青素苷单体,其色谱峰保留时间均匀分布在7~40 min内。
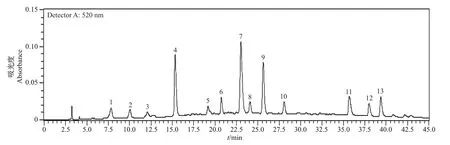
图1 白茶(寿眉)花青素苷的HPLC分析Fig.1 HPLC analysis of anthocyanins extracted from white tea(Shoumei)
2.1.2 MS 分析
自制白茶(寿眉)花青素苷组分的MS裂解碎片如表1所示。MS/MS(MS2)裂解的主要碎片离子有质荷比(m/z)303、287和271,表明白茶花青素苷苷元可能有3~4种,其中,m/z287对应矢车菊素,m/z271对应天竺葵素,m/z303对应的花青素苷苷元在茶叶中已发现有翘摇紫苷元(又称三策啶)和飞燕草素2种同分异构体。上述苷元的结构式见图2。
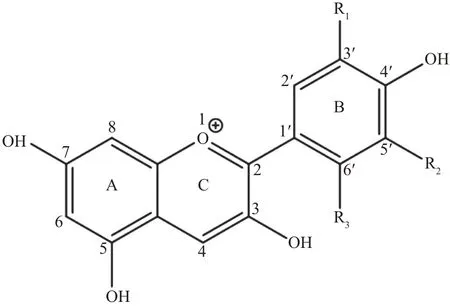
图2 4种花青素苷苷元的结构式Fig.2 Structural formulas of four anthocyanin aglycones
翘摇紫苷元和飞燕草素这2种同分异构体的分子量相同,从质谱信息上很难分辨,需要进行多级质谱或核磁共振等分析才能确定其准确结构。
由色谱峰的保留时间和母离子M+m/z可知,13个花青素苷中有2对同分异构体,即峰5与峰6、峰8与峰9。这2对同分异构体需要考虑的情况有:1)己糖有多种同分异构体;2)糖基与苷元的连接位置不同,糖苷化位点可能在花青素苷苷元的C-3、C-5和C-7 上;3)对香豆酰基存在2 种顺反异构体,即Z构型和E构型;4)双糖的连接方式有2种,即—G1—G2和—G2—G1。
由于糖基十分容易裂解,不能生成稳定的碎片离子,MS图基本不能显示糖基的碎片离子,因此只能根据丢失碎片离子的分子量进行解析。由表1可知:m/z162 的丢失碎片离子为一分子己糖(分子量180=162+18)残基,同分子量的己糖可能为葡萄糖或半乳糖;m/z308的丢失碎片离子为一分子半乳糖(分子量180)和一分子鼠李糖(分子量164)缩合去掉一分子水(分子量18)而形成的双糖残基,即芸香糖基(分子量308=180+164-18-18);还可能为一分子己糖(分子量180)和一分子对香豆酸(分子量164)缩合失去一分子水而形成的对香豆酰己糖残基。

表1 白茶(寿眉)花青素苷组分的质谱数据Table 1 MS data of anthocyanins of white tea (Shoumei)
由反向色谱出峰原理及文献[12-16]可得出花青素苷的保留时间顺序为:1)飞燕草素<矢车菊素<矮牵牛素<天竺葵素<芍药素<锦葵素;2)飞燕草素-3-O-半乳糖苷<飞燕草素-3-O-葡萄糖苷<矢车菊素-3-O-半乳糖苷<矢车菊素-3-O-葡萄糖苷<矢车菊素-3-O-芸香糖苷<天竺葵素-3-O-葡萄糖苷;3)飞燕草素-3-O-芸香糖苷<矢车菊素-3-O-芸香糖苷<天竺葵素-3-O-芸香糖苷;4)矢车菊素-3-O-葡萄糖苷<天竺葵素-3-O-葡萄糖苷<矢车菊素;5)飞燕草素-3-O-[6-(Z)对香豆酰]吡喃半乳糖苷<矢车菊素-3-O-[6-(Z)对香豆酰]吡喃半乳糖苷<飞燕草素-3-O-[6-(E)对香豆酰]吡喃半乳糖苷<矢车菊素-3-O-[6-(E)对香豆酰]吡喃半乳糖苷。
2.1.3 白茶花青素苷组分结构推测
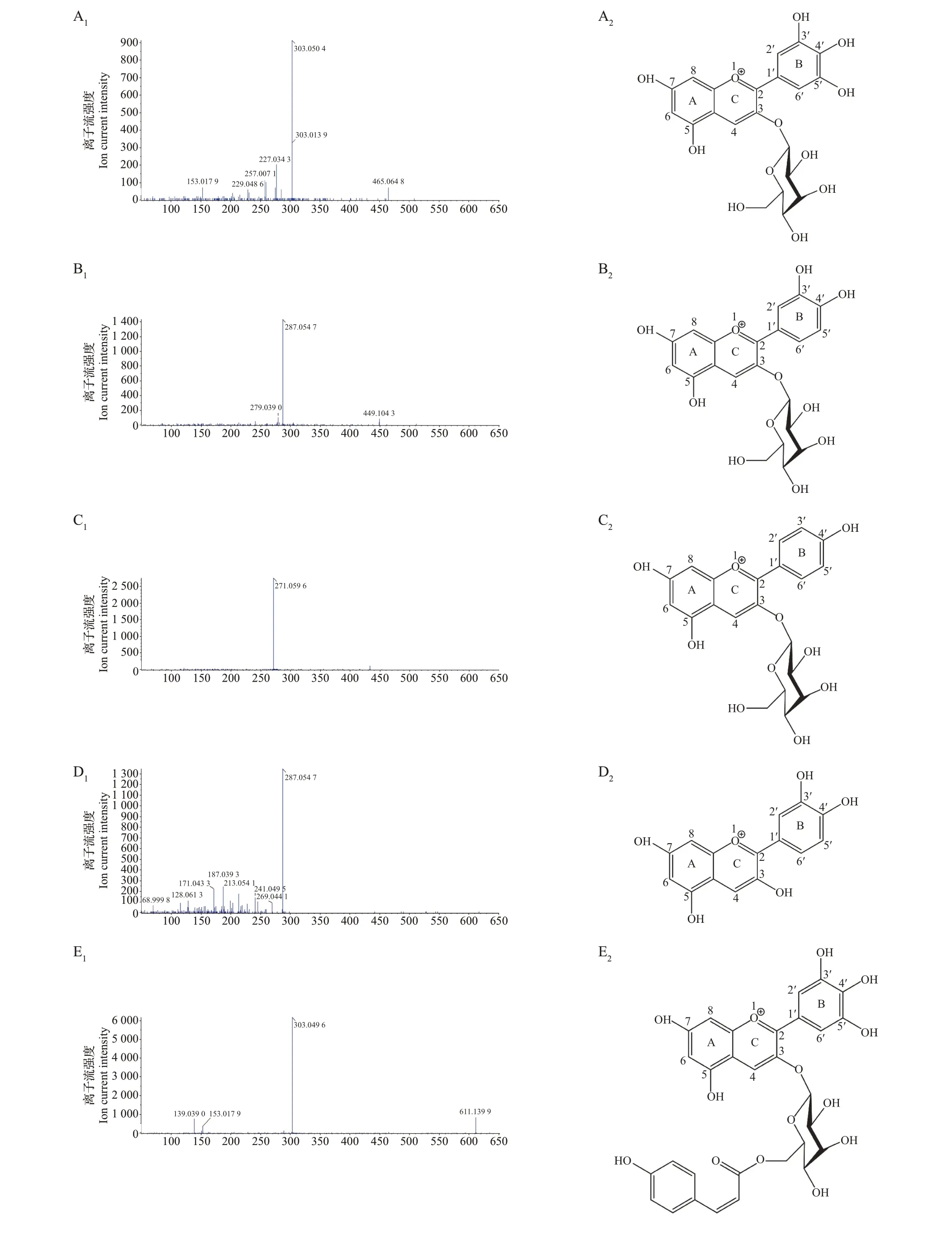
色谱峰1 的质谱图如图3A1所示,其母离子M+m/z465,子离子MS2m/z303,表明色谱峰1 对应的苷元为飞燕草素;MS 碎片的裂解规律为m/z465→m/z303,表明丢失部分为一分子己糖,相同质荷比的己糖有葡萄糖和半乳糖,故色谱峰1 可能为一分子己糖连接于糖苷配基飞燕草素(C15H11O7+)的糖苷化位点(C-3、C-5、C-7)上所形成的飞燕草花青素苷,其保留时间为7.8 min,结合文献[10,16-17]和花青素苷保留时间顺序,推测峰1 为飞燕草素-3-O-半乳糖苷,其结构式如图3A2所示。
色谱峰2 的质谱图如图3B1所示,其母离子M+m/z449,子离子MS2m/z287,表明色谱峰2 对应的苷元为矢车菊素;MS 碎片的裂解规律为m/z449→m/z287,表明丢失部分为一分子己糖,相同质荷比的己糖有葡萄糖和半乳糖,故色谱峰2 可能为一分子己糖连接于糖苷配基矢车菊素(C15H11O6+)的糖苷化位点(C-3、C-5、C-7)上所形成的矢车菊花青素苷,其保留时间为10.0 min,结合文献[10,16-17]和花青素苷保留时间顺序,推测峰2 为矢车菊素-3-O-半乳糖苷,其结构式如图3B2所示。
色谱峰3 的质谱图如图3C1所示,其母离子M+m/z433,子离子MS2m/z271,表明色谱峰3 对应的苷元为天竺葵素;MS 碎片的裂解规律为m/z433→m/z271,表明丢失部分为一分子己糖,相同质荷比的己糖有葡萄糖和半乳糖,故色谱峰3 可能为一分子己糖连接于糖苷配基天竺葵素(C15H11O5+)的糖苷化位点(C-3、C-5、C-7)上所形成的天竺葵花青素苷,其保留时间为12.1 min,结合文献[15,18-19]和花青素苷保留时间顺序,推测峰3 为天竺葵素-3-O-半乳糖苷,其结构式如图3C2所示。
色谱峰4 的质谱图如图3D1所示,其母离子M+m/z287,子离子MS2m/z287,表明色谱峰4 对应的苷元为矢车菊素;MS 碎片的裂解规律为m/z287→m/z287,表明峰4 为未被糖苷化的矢车菊素(C15H11O6+)单体,其保留时间为15.3 min,结合文献[1,15,18,20-21]和花青素苷保留时间顺序,推测峰4为矢车菊素,其结构式如图3D2所示。
色谱峰5和色谱峰6的质谱图如图3E1、F1所示,其分子离子峰均为母离子M+m/z611、子离子MS2m/z303,表明这2 个色谱峰对应的苷元均为飞燕草素;MS碎片的裂解规律均为m/z611→m/z303,表明丢失部分均可能为一分子芸香糖或一分子对香豆酰己糖,相同质荷比的己糖有葡萄糖和半乳糖,故色谱峰5和色谱峰6可能为一分子芸香糖或一分子对香豆酰己糖连接于飞燕草素(C15H11O7+)的糖苷化位点(C-3、C-5、C-7)上所形成的飞燕草花青素苷,其保留时间分别为19.2 和20.7 min,保留时间差约为1.5 min,推断它们的极性相似,可能为顺反异构体,结合文献[13,17,22]和花青素苷保留时间顺序,推测峰5为飞燕草素-3-O-[6-(Z)对香豆酰]吡喃半乳糖苷,峰6 为飞燕草素-3-O-[6-(E)对香豆酰]吡喃半乳糖苷,其结构式如图3E2、F2所示。
色谱峰7 的质谱图如图3G1所示,其母离子M+m/z611,子离子MS2m/z303,表明峰7 对应的苷元为飞燕草素;MS 碎片的裂解规律为m/z611→m/z449→m/z303,表明丢失部分可能为一分子芸香糖,故色谱峰7 可能为一分子芸香糖连接于飞燕草素(C15H11O7+)的糖苷化位点(C-3、C-5、C-7)上所形成的飞燕草花青素苷,其保留时间为23.0 min,结合文献[10,23]和花青素苷保留时间顺序,推测峰7 为飞燕草素-3-O-芸香糖苷,其结构式如图3G2所示。
色谱峰8和色谱峰9的质谱图如图3H1、I1所示,其分子离子峰均为母离子M+m/z595、子离子MS2m/z287,表明这2 个峰对应的苷元均为矢车菊素;MS 碎片的裂解规律均为m/z595→m/z287,表明丢失部分可能为一分子芸香糖或一分子对香豆酰己糖,相同质荷比的己糖有葡萄糖和半乳糖,故色谱峰8和色谱峰9可能为一分子芸香糖或一分子对香豆酰己糖连接于矢车菊素(C15H11O6+)的糖苷化位点(C-3、C-5、C-7)上所形成的矢车菊花青素苷,其保留时间接近,分别为24.1和25.6 min,推断它们的极性相似,可能为顺反异构体,结合文献[13-14,22]和花青素苷保留时间顺序,推测峰8为矢车菊素-3-O-[6-(Z)对香豆酰]吡喃半乳糖苷,峰9 为矢车菊素-3-O-[6-(E)对香豆酰]吡喃半乳糖苷,其结构式如图3H2、I2所示。
色谱峰10的质谱图如图3J1所示,其母离子M+m/z579,子离子MS2m/z271,表明峰10对应的苷元为天竺葵素;MS 碎片的裂解规律为m/z579→m/z417→m/z271,表明丢失部分可能为一分子芸香糖,故峰10 可能为一分子芸香糖连接于天竺葵素(C15H11O5+)的糖苷化位点(C-3、C-5、C-7)上所形成的天竺葵花青素苷,其保留时间为28.1 min,结合文献[10,23]和花青素苷保留时间顺序,推测峰10为天竺葵素-3-O-芸香糖苷,其结构式如图3J2所示。

图3 白茶花青素苷峰1~10(A~J)的质谱图及结构式Fig.3 Mass spectra and structural formulas of white tea anthocyanin peaks 1-10(A-J)
2.2 白茶花青素苷组成及含量分析
由表2 可见,从白毫银针、白牡丹、贡眉和寿眉中共检测出12种花青素苷组分,通过HPLC-MS技术鉴定出9种组分。在所有茶样中均检测出矢车菊素、飞燕草素-3-O-[6-(Z)对香豆酰]吡喃半乳糖苷、飞燕草素-3-O-[6-(E)对香豆酰]吡喃半乳糖苷、飞燕草素-3-O-芸香糖苷。其中,含量最高的白茶花青素苷为矢车菊素(44.38~69.15 μg/g),其次是飞燕草素-3-O-[6-(Z)对香豆酰]吡喃半乳糖苷(6.67~16.02 μg/g)。
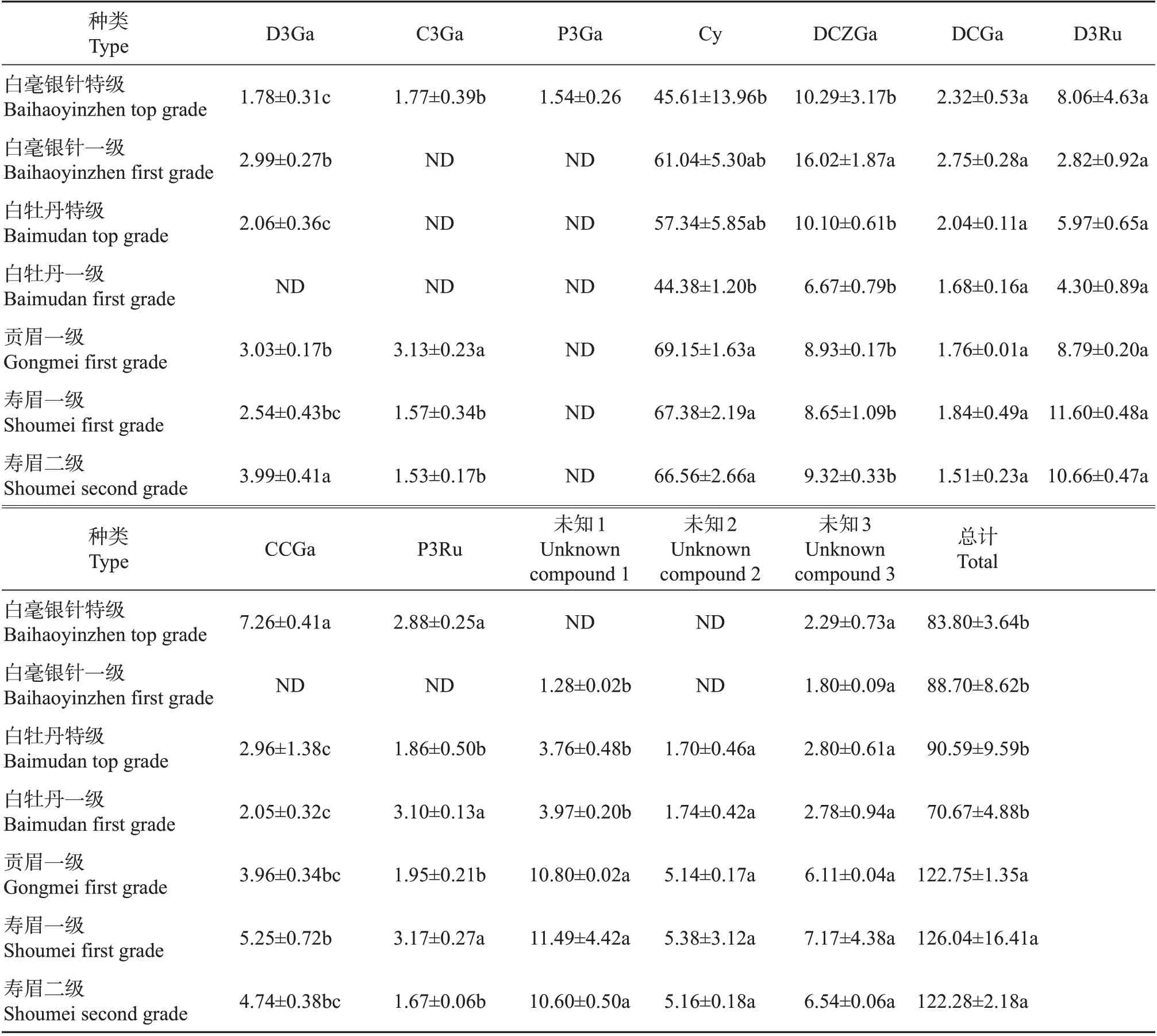
表2 白茶花青素苷组成及含量Table 2 Composition and contents of anthocyanins of white teaμg/g
白毫银针特级、白毫银针一级、白牡丹特级、白牡丹一级、贡眉一级、寿眉一级和寿眉二级的花青素苷总量分别为83.80、88.70、90.59、70.67、122.75、126.04 和122.28 μg/g,排序为寿眉一级>贡眉一级>寿眉二级>白牡丹特级>白毫银针一级>白毫银针特级>白牡丹一级,且贡眉和寿眉的花青素苷含量显著高于白毫银针和白牡丹,表明白茶花青素苷含量与原料嫩度有关,嫩度较高的白茶的花青素苷含量较少。
3 讨论与结论
本研究采用HPLC-MS 技术,对经过有机溶剂萃取、XAD-7HP 离子交换大孔吸附树脂初步纯化的寿眉花青素苷粗品进行分析,共检测出13种花青素苷组分,根据MS数据并结合相关文献,初步鉴定出其中10 种花青素苷组分。由于MS 数据有限,未获得最后3 个峰(11~13 号峰)的化学结构,需进一步分离纯化以确定其结构。
本研究中白茶花青素苷总量为70.67~126.04 μg/g,与文献[20,24]报道的结果(0.01%~0.02%)相当。白茶花青素苷组成复杂多样,以矢车菊素、飞燕草素及其衍生物为主,而天竺葵素及其衍生物含量较低,与前人的研究结论[25]一致。SAITO 等在日本富含花青素苷茶树品种‘Sunrouge’中只检测到了与飞燕草素和矢车菊素类相关的花青素苷[26]。与亚洲品种相比,KERIO 等在肯尼亚紫芽茶树品种‘TRFK306’中除检测到了白茶中含有的3 种花青素苷苷元外,还检测到了锦葵素,且锦葵素而非矢车菊素为花青素中含量最高的组分,天竺葵素的含量与其他花青素相比也较高[21]。亚洲与非洲茶树品种间花青素苷成分的巨大差异可能与地理因素有关。另外,白毫银针花青素苷总量随等级(嫩度)的降低呈上升趋势,这与紫化茶树品种花青素苷在幼嫩芽叶中积累较多的研究结果[25,27]相反。由此可见,花青素苷在茶叶中的积累差异很大,提示其含量受茶树品种、生长季节和生长地域等多种因素的影响。对于同一地区由非紫化品种原料制成的干茶,其含量主要受季节的影响,夏、秋季含量稍高,而等级较低的贡眉和寿眉常在这一时期制作,这可能是其花青素苷总量随原料嫩度的降低而升高的原因。
本文以目前研究中较少涉及的商品白茶为材料,建立了白茶花青素苷组分的HPLC分析方法,通过酸性甲醇超声波辅助提取、有机溶剂萃取、XAD-7HP 离子交换大孔吸附树脂分离、HPLC-MS 等技术,推测出白茶样品中的10 种花青素苷组分,初步探明了白茶花青素苷含量的整体特征,为白茶花青素苷组分分析提供了科学依据。

