BUB1表达对结直肠癌细胞增殖、凋亡及PLK1/PTEN信号通路的影响*
于 鹏,地力木热提·艾买提,丁志翔,段绍斌
(新疆医科大学附属中医医院·新疆维吾尔自治区中医医院普外一科,乌鲁木齐 830011)
结直肠癌是世界上第三大常见癌症,其年度病死率在世界排名第3位[1]。尽管近年来通过外科手术、化疗、放疗等手段已大大改善了结直肠癌的治疗效果,但患者的5年生存率依然很低[2]。因此,探索结直肠癌的发病机制可以为临床干预提供有效的指导,从而改善患者的长期预后。苯并咪唑出芽抑制解除同源物蛋白1(budding uninhibited by benzimidazoles 1,BUB1)是纺锤体关卡的组成部分,其异常表达会导致染色体不稳定和非整倍体细胞的产生,最终传代促进肿瘤的发生[3]。已有研究报道,BUB1基因在原发性肝癌患者中高表达,并促进肝癌细胞增殖[4]。而Polo样激酶1(Polo-like kinase 1,PLK1)/10号染色体上缺失的磷酸酶及张力蛋白同源基因(phosphatase and tensin homolog deleted on chromosome ten,PTEN)信号通路中的PLK1在肝癌细胞中表达上调,进而干扰PTEN蛋白的核转位,抑制免疫细胞功能,最终促进肿瘤的进展[5],但BUB1及PLK1/PTEN信号通路在结直肠癌中的具体作用尚未见报道。因此,本研究首先检测了BUB1在不同结直肠癌细胞系中的表达,然后利用RNA干扰(siRNA)技术抑制BUB1的表达并观察细胞的增殖与凋亡情况,并探究其内部的分子机制,以期为结直肠癌的临床治疗提供理论依据。
1 资料与方法
1.1 结直肠癌组织标本及细胞系
收集2018年8月至2020年8月在本院确诊的结直肠癌患者癌组织及邻近癌旁组织共125对。所有提供标本的患者均经病理检查确诊,术前未接受过放化疗。所有患者均签署知情同意书,本研究经本院伦理委员会批准。所有组织标本均保存在液氮中。人结直肠癌细胞系SW1116、SW480、HCT116、HT-29与人正常结肠黏膜上皮细胞NCM460均购自中国科学院上海细胞库。
1.2 主要试剂与仪器
针对BUB1 mRNA相应的靶点设计的2对siRNA BUB1序列(si-BUB1-1、si-BUB1-2)及其阴性对照(si-NC)均由广州基迪奥生物科技有限公司合成;蛋白提取试剂盒、BCA试剂盒、LipofectamineTM2000转染试剂盒均购自美国Thermo Fisher公司;CCK-8试剂盒购自武汉默沙克生物科技有限公司;Annexin V-FITC细胞凋亡检测试剂盒购自上海碧云天生物科技有限公司;DMEM培养基、胎牛血清(FBS)均购自美国Sigma-Aldrich公司;电化学发光(ECL)试剂盒购自北京百奥莱博科技有限公司;BUB1、Bax、Bcl-2、PLK1、PTEN、GAPDH兔抗多克隆抗体(anti-BUB1、anti-Bax、anti-Bcl-2、anti-PLK1、anti-PTEN、anti-GAPDH)、辣根过氧化物酶(HRP)标记的羊抗兔IgG二抗均购自美国Abcam公司;细胞培养箱购自德国Sigma公司;流式细胞仪购自美国BD公司。
1.3 细胞培养与转染
人结直肠癌细胞系SW1116、SW480、HCT116、HT-29与人正常结肠黏膜上皮细胞NCM460均置于含10% FBS的DMEM培养基中,并在37 ℃、5% CO2的培养箱中培养。取对数生长期的SW480细胞,利用LipofectamineTM2000转染试剂盒对细胞进行分组转染,并分组为:空白组(细胞未转染)、si-NC组(细胞转染si-NC)、si-BUB1-1组(细胞转染si-BUB1-1)、si-BUB1-2组(细胞转染si-BUB1-2),每组设置6个复孔。
1.4 Western blot检测细胞中BUB1、PLK1、PTEN、Bax、Bcl-2表达
收集各组细胞,分别在各组细胞中加入含有蛋白酶抑制剂的RIPA裂解缓冲液,于冰上裂解30 min。30 min后,将裂解的细胞在4 ℃下以12 000×g离心10 min,使用BCA蛋白浓度测定试剂盒对提取的蛋白上清液进行定量。将等量的蛋白质(50 μg)加入到12%十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)中进行电泳分离,并转移到聚偏氟乙烯(PVDF)膜上。用5%脱脂牛奶封闭2 h后,将膜与一抗anti-BUB1(1∶2 000)、anti-PLK1(1∶1 000)、anti-PTEN(1∶3 000)、anti-Bax(1∶1 000)、anti-Bcl-2(1∶2 000)、anti-GAPDH(1∶2 000)于4 ℃下孵育过夜。将膜在室温下用TBST洗3次,加入HRP标记的羊抗兔二抗于室温条件下孵育1 h。使用ECL化学发光试剂可视化蛋白。对蛋白条带进行扫描,以GAPDH为内参,对蛋白质的灰度值进行量化分析。每个样品设置6个复孔。
1.5 CCK-8法检测细胞增殖
将空白组、si-NC组、si-BUB1-1组、si-BUB1-2组SW480细胞以5×103/孔接种于96孔板中,分别在0、24、48和72 h时加入10 μL CCK-8试剂。37 ℃孵育2 h后,测量450 nm波长处的吸光度(A)值,每组设置6个复孔。
1.6 流式细胞术检测细胞凋亡
分别收集转染48 h的空白组、si-NC组、si-BUB1-1组、si-BUB1-2组SW480细胞,用预冷的磷酸盐缓冲液(PBS)洗3次,加入200 μL结合缓冲液轻轻重悬细胞,然后分别向每管中加入膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)和碘化丙啶(PI)各10 μL,轻轻混匀,冰浴避光放置2 h,进行流式细胞仪检测,每组设置6个复孔,最后使用FlowJo V10软件对数据进行分析。
1.7 统计学处理
2 结 果
2.1 BUB1在结直肠癌组织和细胞中的表达
BUB1在结直肠癌组织(0.69±0.07)中的表达水平显著高于癌旁组织(0.15±0.02),差异有统计学意义(t=82.930,P<0.001),见图1。与NCM460细胞(0.13±0.01)比较,SW1116(0.42±0.04)、SW480(0.76±0.06)、HCT116(0.62±0.05)、HT-29(0.67±0.04)细胞中BUB1表达水平都显著升高(F=201.223,P<0.05),且BUB1表达水平在SW480细胞中最高,因此,选择SW480细胞进行后续研究,见图2。

A:癌旁组织;B:结直肠癌组织。
2.2 抑制BUB1表达对SW480细胞中BUB1表达的影响
si-BUB1-1组(0.14±0.02)、si-BUB1-2组(0.12±0.02)SW480细胞中BUB1表达水平显著低于空白组(0.75±0.07)和si-NC组(0.74±0.06),差异有统计学意义(F=325.570,P<0.05),空白组和si-NC组比较差异无统计学意义(P>0.05),见图3。
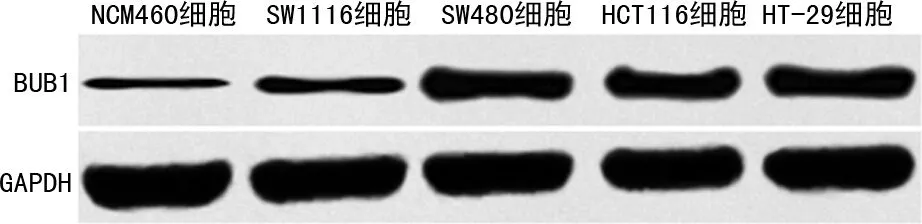
图2 Western blot检测各组细胞中BUB1表达

图3 Western blot检测各组细胞中BUB1表达
2.3 抑制BUB1表达对SW480细胞增殖的影响
与空白组和si-NC组比较,si-BUB1-1组、si-BUB1-2组SW480细胞在转染24、48、72 h的增殖能力降低,差异有统计学意义(P<0.05),空白组与si-NC组比较差异无统计学意义(P>0.05),见表1。
2.4 抑制BUB1表达对SW480细胞凋亡的影响
与空白组和si-NC组比较,si-BUB1-1组、si-BUB1-2组SW480细胞凋亡率、Bax表达水平显著升高,Bcl-2表达水平显著降低(P<0.05),空白组与si-NC组比较差异无统计学意义(P>0.05),见图4、5,表2。
表1 各组SW480细胞在转染0、24、48、72 h时的增殖情况比较(A值,
2.5 抑制BUB1表达对PLK1/PTEN信号通路相关蛋白的影响
与空白组和si-NC组比较,si-BUB1-1组、si-BUB1-2组细胞中PLK1表达水平显著降低,PTEN蛋白表达水平显著升高(P<0.05),空白组与si-NC组比较,2种蛋白表达水平差异无统计学意义(P>0.05),见图6、表3。
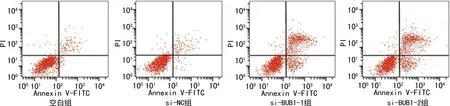
图4 流式细胞术检测各组细胞凋亡情况

图5 Western blot检测各组细胞中Bax、Bcl-2蛋白表达

表2 各组细胞凋亡率及凋亡相关蛋白Bax、Bcl-2表达比较

图6 Western blot检测各组细胞中PLK1、PTEN蛋白表达

表3 各组细胞中PLK1、PTEN蛋白表达比较
3 讨 论
结直肠癌的发展是一个复杂的过程,涉及多个基因的调控,对涉及这些关键基因调控机制的研究可能为精确治疗结直肠癌患者提供良好的策略[6]。BUB1是1种纺锤体检测点蛋白,在有丝分裂过程中对维持染色体正确分离、减少异倍体产生发挥着重要作用[7]。已有研究表明BUB1在多种恶性肿瘤中呈异常表达,并通过影响肿瘤细胞增殖、凋亡、侵袭、迁移及肿瘤干细胞活性等参与恶性肿瘤发生发展[8-9];余旭等[10]报道BUB1在乳腺癌组织中高表达,且与乳腺癌的不良预后及免疫细胞浸润相关;庾麒等[11]发现BUB1的高表达与原发性肝癌的临床分期、淋巴结转移、远处转移、T分期有关;潘峰[12]的研究表明BUB1高表达可提示非小细胞肺癌患者的预后不良,有望成为肺癌早期诊断及不良预后的有效检测标志物及分子治疗靶点;白晓斌等[13]研究表明BUB1表达水平上调能够促进胶质母细胞瘤细胞的生长和增殖,并和胶质母细胞瘤患者的不良预后相关。在本研究中,通过检测BUB1在人结直肠癌细胞系SW1116、SW480、HCT116、HT-29中的表达发现,BUB1在结直肠癌细胞系中高表达,且在SW480细胞中的表达最高,因此后续选用SW480细胞为研究对象。
肿瘤细胞的无限增殖与肿瘤细胞的凋亡被抑制有关[14]。有研究利用siRNA技术下调肝癌细胞中BUB1的表达后能够降低肝癌细胞的增殖能力,促进细胞凋亡,诱导肝癌细胞发生S期阻滞[15]。本研究结果显示,通过siRNA技术下调BUB1的表达后,SW480细胞增殖能力降低、细胞凋亡率升高,促凋亡蛋白Bax表达下调,抗凋亡蛋白Bcl-2表达下调。提示BUB1在结直肠癌中发挥着促癌作用,抑制BUB1表达可部分改变结直肠癌的恶性表型,但其中的作用机制,尚需进一步研究。
近年来,PLK1/PTEN信号通路在肿瘤的研究中备受关注。据报道,PLK1是细胞周期和致癌作用的关键调节剂,可作为诊断性生物标志物和抗癌靶标[16];下调PLK1的表达水平可使膀胱癌细胞的凋亡明显增加,迁移能力显著降低,细胞内氧化应激状态减低[17];PLK1抑制剂BI-2536可抑制人肝癌细胞的增殖及迁移能力,PLK1可作为肝癌治疗中的新靶点[18]。越来越多的证据表明,PTEN蛋白在恶性肿瘤中具有抑癌功能[19];PTEN蛋白在非小细胞肺癌中低表达,且与肿瘤分化程度呈显著相关[20];过表达PTEN蛋白可抑制结直肠癌细胞增殖和侵袭并促进细胞凋亡,抑制细胞内增殖相关蛋白CDK1、侵袭相关蛋白基质金属蛋白酶2(MMP-2)和抗凋亡蛋白Bcl-2的表达,促进凋亡蛋白Bax的表达[21]。本研究结果显示,抑制BUB1表达后,PLK1/PTEN信号通路中PLK1表达水平下调,PTEN蛋白表达上调。提示抑制BUB1表达可能通过调控PLK1/PTEN信号通路中PLK1、PTEN蛋白的表达来抑制细胞增殖,促进细胞凋亡。
综上所述,BUB1在结直肠癌细胞中高表达,抑制BUB1表达可抑制细胞增殖,促进细胞凋亡,该机制可能与PLK1/PTEN信号通路中PLK1表达下调,PTEN蛋白表达上调有关。该研究仅在体外细胞水平上证明了BUB1表达对结直肠癌细胞增殖、凋亡及PLK1/PTEN信号通路的影响,后续体内实验尚需进一步深入研究。

