溃疡性结肠炎肠黏膜内PKM2表达的变化及临床意义*
步 楠,李姗姗,苏 越,潘克明
(黑龙江省佳木斯市中医医院消化内科 154002)
溃疡性结肠炎(ulcerative colitis,UC)是一类重要累及结直肠黏膜及黏膜下层的非特异性炎症性肠病,以肠黏膜病变复发与缓解交替发生为特征[1-2],发病机制尚不十分清楚,临床上也缺乏靶向治疗手段及特异性筛查指标。丙酮酸激酶(pyruvate kinase,PK)家族包括PKL、PKR、PKM1、PKM2 4种亚型,其中PKM2被证实在UC发病中起保护作用,敲除PKM2使葡聚糖硫酸钠诱导的UC小鼠病变加重、造成肠黏膜内炎性反应激活及肠黏膜屏障损伤[3]。但目前尚缺乏PKM2在UC发病中所起作用的临床证据。因此,本研究将以UC患者为对象,首先分析UC肠黏膜内PKM2表达的变化,而后从病情加重、炎性反应激活、肠黏膜屏障损伤的角度分析PKM2表达变化的临床意义,旨在为阐明PKM2在UC发病中的作用提供临床依据。
1 资料与方法
1.1 一般资料
选择2017年1月至2020年6月在本院诊断为UC的患者,60例活动期UC患者作为活动期UC组、40例缓解期UC患者作为缓解期UC组,纳入标准:(1)符合《炎症性肠病诊断与治疗的共识意见(2018年·北京)》[4]中活动期UC或缓解期UC的诊断标准;(2)临床资料、肠黏膜标本完整;(3)取得患者知情同意。排除标准:(1)合并其他自身免疫性疾病;(2)合并恶性肿瘤、急慢性感染、糖尿病;(3)伴有心、肝、肾、肺功能不全。另取同期在本院诊断为肠息肉的60例患者作为对照组。3组患者一般资料比较,差异无统计学意义(P>0.05),见表1。

表1 3组间一般资料的比较
1.2 免疫组织化学检测 PKM2的表达
取3组肠黏膜组织标本适量,制作病理切片后采用SABC-AP免疫组织化学试剂盒(上海信帆生物科技公司)对切片PKM2进行染色,按照说明书完成操作。在显微镜下观察染色强度及阳性染色细胞比例。染色强度计分如下:无染色0分、浅棕黄色1分、棕黄色2分、棕褐色3分;阳性染色细胞比例计分如下:<5%为0分、6%~25%为1分、26%~50%为2分、51%~75%为3分、76%~100%为4分。2项评分相乘,0~1分为阴性、≥2分为阳性。
1.3 实时荧光定量PCR(qRT-PCR)检测PKM2 mRNA的表达
取3组肠黏膜组织标本适量,采用TRIzol试剂盒(北京天根公司)提取组织中的总RNA,将总RNA反转录为cDNA,对cDNA进行qRT-PCR扩增,按照说明书完成操作。PCR的20 μL反应体系为cDNA 1 μL、反应混合液10 μL、上下游引物各0.6 μL、去离子水7.8 μL;PCR的反应程序为:95 ℃预变性3 min;95 ℃ 15 s、特异性退火温度(PKM2 58.0 ℃、β-actin 60.0 ℃)25 s、72 ℃ 30 s,30个循环。完成PCR反应后得到循环曲线及循环阈值(Ct),以β-actin为内参,按照公式2-ΔΔCt计算PKM2 mRNA表达水平。
1.4 Western blot检测PKM2、闭锁连接蛋白-1(ZO-1)、闭合蛋白(Occludin)、密封蛋白-1(Claudin-1)的表达
取3组肠黏膜组织标本适量,加入组织裂解液后匀浆,匀浆液于4 ℃、12 000×g离心20 min,分离上清液并采用BCA法检测蛋白浓度,根据检测结果将含有30 μg蛋白的上清液标本用于Western blot实验。在十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)中电泳分离蛋白,电转移至硝酸纤维素(NC)膜,5%脱脂牛奶封闭NC膜1~2 h,用HMGA2一抗(1∶1 000稀释)、β-actin一抗(1∶5 000稀释)4 ℃孵育过夜;次日,孵育过氧化物酶(HPR)标记的二抗(1∶5 000稀释)1 h,最后在凝胶成像系统内成像得到PKM2、ZO-1、Occludin、Claudin-1及β-actin的蛋白条带,在ImageJ软件中计算条带灰度值,根据蛋白条带灰度值计算PKM2、ZO-1、Occludin、Claudin-1的表达水平。
1.5 活动期UC病情的评估
参照《炎症性肠病诊断与治疗的共识意见(2018年·北京)》[4],采用Mayo临床评分、Mayo内镜评分、Geboes指数评估活动期UC患者的病情。
1.6 实验室指标的检测
由医院检验科完成以下实验室指标的测定:中性粒细胞/淋巴细胞比值(neutrophils-lymphocytes ratio,NLR)、单核细胞/淋巴细胞比值(monocyte-lymphocytes ratio,MLR)、血小板/淋巴细胞比值(platelet-to-lymphocyte ratio,PLR)、C反应蛋白(C-reactive protein,CRP)、红细胞沉降率(erythrocyte sedimentation rate,ESR)。
1.7 ELISA检测炎症细胞因子水平
取活动期UC组患者适量的肠黏膜组织标本,加入组织裂解液后匀浆,采用ELISA试剂盒(上海西唐公司)检测匀浆液中肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)的水平,按照试剂盒说明书完成操作。
1.8 统计学处理
2 结 果
2.1 3组患者肠黏膜PKM2表达水平的比较
采用免疫组织化学法、荧光定量PCR法、Western blot法检测PKM2的表达情况。经统计学分析,与对照组比较,缓解期UC组肠黏膜PKM2的阳性表达率、mRNA表达水平、蛋白表达水平差异无统计学意义(P>0.05);与对照组、缓解期UC组比较,活动期UC组肠黏膜PKM2的阳性表达率、mRNA表达水平、蛋白表达水平均明显降低,差异有统计学意义(P<0.05)。见图1、2,表2。

A:活动期UC组;B:缓解期UC组;C:对照组。

图2 Western blot法检测肠黏膜PKM2的表达水平
表2 活动期UC组、缓解期UC组与对照组肠黏膜PKM2表达的比较
2.2 活动期UC组患者中PKM2阳性表达与阴性表达患者病情的比较
与活动期UC组中PKM2阳性表达患者比较,PKM2阴性表达患者的Mayo临床评分、Mayo内镜评分、Geboes指数均明显增加,差异有统计学意义(P<0.05),见表3。

表3 活动期UC组中PKM2阳性表达与阴性表达患者病情的比较
2.3 活动期UC组患者中PKM2阳性表达与阴性表达患者实验室指标、黏膜屏障标志物的比较
与活动期UC组中PKM2阳性表达患者比较,PKM2阴性表达患者的ESR、CRP、NLR、MLR、PLR水平均明显增加,差异有统计学意义(P<0.05),见表4。

表4 活动期UC组中PKM2阳性表达与阴性表达患者实验室指标的比较
2.4 活动期UC组中PKM2阳性表达与阴性表达患者肠黏膜屏障标志物的比较
与活动期UC组中PKM2阳性表达患者比较,PKM2阴性表达患者肠黏膜内ZO-1、Occludin、Claudin-1的蛋白表达水平均明显降低,差异有统计学意义(P<0.05),见图4、表5。
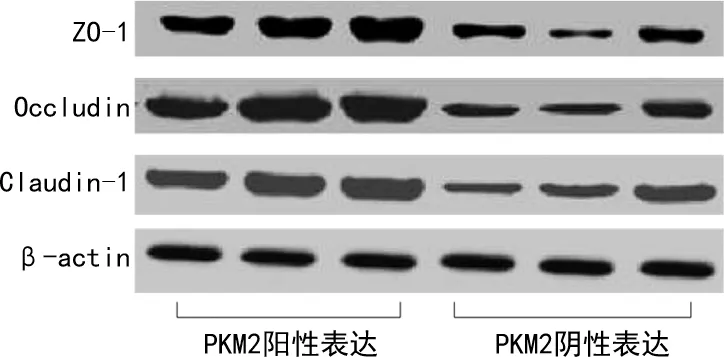
图3 Western blot检测肠黏膜ZO-1、Occludin、Claudin-1的表达

表5 活动期UC组中PKM2阳性表达与阴性表达患者肠黏膜屏障标志物表达的比较
2.5 活动期UC组中PKM2阳性表达与阴性表达患者肠黏膜炎症细胞因子的比较
与活动期UC组中PKM2阳性表达患者比较,PKM2阴性表达患者肠黏膜内TNF-α、IL-6水平均明显增加,差异有统计学意义(P<0.05),见表6。

表6 活动期UC组中PKM2阳性表达与阴性表达患者肠黏膜内炎症细胞因子的比较
3 讨 论
PKM2是PK家族的成员之一,既能在糖酵解过程中起到催化作用,也能在基因表达调控中起到转录辅助因子作用。目前已知在宫颈癌[5]、食管癌[6]、前列腺癌[7]等恶性肿瘤的发病过程中PKM2参与多种癌基因表达的调控,恶性肿瘤病灶内高表达的PKM2介导了促增殖、抗凋亡等生物学效应。近年关于UC发病机制的研究不断深入,多项研究证实肠黏膜上皮细胞过度凋亡与UC的发病密切相关[8-9]。1项PKM2与UC相关的动物实验结果显示,在葡聚糖硫酸钠诱导的UC小鼠中,敲除PKM2使肠黏膜病理改变加重[3],提示PKM2表达降低或缺失可能参与UC的发病。
本研究以UC患者为对象,首先通过检测PKM2表达的方式探究PKM2在UC发病中的作用。经免疫组织化学、荧光定量PCR及Western blot 3种方法检测PKM2的表达,3种方法的检测结果一致,即与缓解期UC及结肠息肉患者比较,活动期UC患者肠黏膜PKM2的表达水平明显降低。SUN等[3]的动物实验证实PKM2在UC发病过程中起保护作用、能够减轻UC病变。Mayo临床评分、Mayo内镜评分、Geboes指数是目前临床上评估活动期UC病情的常用手段[10-11],本研究分析了PKM2表达与UC病情的关系,结果显示:PKM2阴性表达患者的Mayo临床评分、Mayo内镜评分、Geboes指数更高,表明PKM2表达缺失与活动期UC病情加重有关,与PKM2在UC小鼠中介导的肠黏膜保护作用结论一致。
UC是一类非特异性炎症介导的炎症性肠病,临床上多项实验室指标能够评估炎性反应程度,与UC病情发展变化相关。CRP和ESR是评价多种自身免疫性疾病活动的指标,NLR、MLR、PLR是新近发展起来的炎症指标。中性粒细胞和单核细胞在炎性反应激活过程中能够释放多种炎症介质,UC肠黏膜内2种细胞的浸润均明显增多[12-13],淋巴细胞在炎性反应中的作用较为复杂,多数研究认为在炎症激活过程中淋巴细胞的成熟受阻[14],因此NLR和MLR的升高反映了UC发病过程中炎性反应的过度激活[15-16]。本研究通过上述实验室指标的分析进一步验证PKM2在活动期UC病情发展变化中的作用,PKM2阴性表达患者的ESR、CRP、NLR、MLR、PLR水平较高,表明活动期UC发病过程中PKM2表达缺失与炎性反应的过度激活有关,这与PKM2表达缺失与活动期UC病情加重有关的结果一致,进一步提示肠黏膜内PKM2表达缺失与活动期UC病情加重有关。
SUN等[3]和步楠等[17]在UC小鼠中通过基因敲除的方法证实了PKM2参与肠黏膜内炎性反应的调控。在敲除PKM2后,UC小鼠肠黏膜内细胞因子TNF-α、IL-6的表达水平增加,同时细胞间紧密连接蛋白ZO-1、Occludin、Claudin-1的表达水平降低。TNF-α、IL-6具有促炎活性,在UC发病过程中其生成增多介导了肠黏膜炎性反应的激活[18];ZO-1、Occludin、Claudin-1能够维持肠黏膜上皮细胞间的紧密连接,在UC发病过程中其表达降低造成了黏膜屏障损伤[19-20]。本研究发现活动期UC发病过程中PKM2阴性表达患者肠黏膜内TNF-α、IL-6的表达水平增加,ZO-1、Occludin、Claudin-1的表达水平降低,与PKM2在UC小鼠中调控炎性反应及肠黏膜屏障的作用吻合,提示PKM2表达缺失可能通过激活炎性反应,加重肠黏膜屏障损伤的方式参与活动期UC的发病。
综上所述,本研究认为肠黏膜内PKM2表达降低与活动期UC的发病有关,并且肠黏膜内PKM2表达缺失与活动期UC病情加重、炎性反应激活、肠黏膜屏障损伤有关。本研究的上述临床检测数据为今后探究UC发病机制及防治靶点提供了新思路。

