microRNAs调控平滑肌细胞表型转化及其在心血管疾病中的作用*
闫学科, 宋自芳
华中科技大学同济医学院附属协和医院肝胆外科,武汉 430022
成熟的血管平滑肌细胞(vascular smooth muscle cells,VSMCs)并不是终末分化的细胞,其具有一定的可塑性[1]。成熟的VSMCs处于分化静止状态,保持着收缩表型,呈典型的纺锤状,含丰富的肌纤维,在调节血管张力和保持血管壁的完整性中起着重要的作用[2]。内皮受损后,处于血管壁中层的平滑肌细胞得以与血液中刺激因子以及细胞外因子接触,从而触发血管平滑肌细胞的表型转化,由分化状态转变为去分化状态,合成表型代替收缩表型,以标志基因平滑肌α-肌动球蛋白(smooth muscle α-actin,α-SMA)、h1-钙调蛋白(calponin)、平滑肌肌球蛋白重链(smooth muscle myosin heavy chain,SM-MHC)和平滑肌22α(smooth muscle 22α,SM22α)表达下降,增殖、迁移能力增强,蛋白质合成分泌水平提升为特征,从而引起一系列的血管疾病[3]。
microRNAs(miRNAs)是一类由内源基因编码的长度约为22 bp核苷酸的非编码单链RNA分子,其在细胞内具有多种重要的调节作用[4]。miRNAs主要在基因的转录后水平发挥调控作用,一方面抑制mRNA的翻译;另一方面诱导mRNA的降解[5](图1)。研究表明,miRNAs参与大量的细胞生理和病理过程,调控细胞的增殖、迁移、凋亡、周期过程等等,与血管平滑肌细胞的生长调控以及心血管疾病的发生密不可分[6]。因此,更好地了解miRNAs在血管平滑肌细胞表型转化中的调节作用对有效地治疗心血管疾病至关重要。

图1 miRNAs调控平滑肌细胞表型转化模式图Fig.1 Pattern of miRNAs regulating the phenotypic modulation in smooth muscle cells
1 miRNAs对VSMCs表型转化的调节
1.1 miRNAs调控VSMCs增殖、迁移能力
血管平滑肌细胞的增殖、迁移能力增强是血管损伤后新内膜形成的重要病理过程,多种miRNAs分子,细胞因子以及信号通路参与其发生发展。骨形态发生蛋白4(bone morphogenetic protein 4,BMP4)通过激活miR-21,进而下调胞质分裂作用因子(dedicator of cytokinesis,DOCK)蛋白家族的表达,从而促进血管平滑肌细胞收缩性,抑制细胞迁移[7];血小板源性生长因子(platelet derived growth factor,PDGF)刺激诱导VSMCs增强的增殖迁移能力可被miR-21和miR-663所逆转[8-9];miR-24有助于新内膜病变的形成[10];核因子-κB(nuclear factor-κB,NF-κB)p65激活诱导表达增加的miR-17靶向抑制视网膜母细胞瘤(retinoblastoma,RB)蛋白进而促进VSMCs的增殖[11];受细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)上调的miR-31靶向大肿瘤抑制同源物2(large tumor suppressor homolog 2,LATS2)促进VSMCs增殖能力[12],而上调的miR-133靶向抑制转录因子Sp1表达从而抑制VSMCs的增殖迁移能力[13];Jagged-1/Notch通路:miR-143/145簇是血管平滑肌细胞中Jagged-1/Notch信号传导的新转录靶标,通过Jagged-1激活Notch受体导致miR-143/145上调,表现为VSMCs收缩蛋白表达增加和增殖能力降低[14];转化生长因子(transform growth factor-β,TGF-β)/Smad通路:抑制miR-26a通过增强Smad信号,抑制SMC的增殖迁移能力[15]。
1.2 miRNAs调控VSMCs凋亡
平滑肌细胞的凋亡在表型转化过程中也发挥重要的作用。受到不同的细胞外刺激,相应的miRNA发挥不同的作用,从而调控新内膜增生。在过氧化氢(H2O2)诱导下,miR-21作用其下游程序性细胞死亡蛋白4(programmed cell death 4,PDCD4)以保护细胞避免凋亡和死亡[16-17]。沉默miR-155-5p靶向Fos促癌蛋白(Fos proto-oncogene,FOS)和锌指蛋白(zinc finger protein,ZIC)减缓细胞凋亡从而抑制腹主动脉瘤(abdominal aortic aneurysm,AAA)的形成[18]。过表达miR-26a通过靶向PTEN/AKT/mTOR通路减缓细胞凋亡[19]。此外,如miR-17-5p、miR-138和miR-210分别靶向调控信号传导及转录激活蛋白3(signal transducer and activator of transcription 3,STAT3)[20]、巨噬细胞刺激因子1(macrophage stimulating 1,MST1)[21]以及E2F转录因子(E2F transcription factor 3,E2F3)[22]介导细胞抗凋亡作用;在氧化低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)刺激的VSMCs中,敲低miR-148b,而过表达miR-155可抑制细胞凋亡[23-24];在血管紧张素Ⅱ(Angiotensin Ⅱ,Ang Ⅱ)的作用下,过表达miR-96-5p靶向活化T细胞核因子5蛋白(nuclear factor of activated T cells 5,NFAT5)促进细胞凋亡[25];在肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)刺激的小鼠VSMCs中,miR-494通过靶向B细胞淋巴瘤2样蛋白11(B-cell lymphoma 2-like 11,BCL2L11)促进细胞凋亡[26];在PDGF-BB刺激的VSMCs中,miR-149-5p靶向神经纤维蛋白2(neuropilin 2,NRP2)促进细胞凋亡[27]。在小鼠动脉夹层模型中,miR-22,miR-26b可以抑制细胞凋亡[28-29],而下调miR-145,miR-17诱导VSMC凋亡[30-31]。
1.3 miRNAs调控VSMCs周期进程
血管平滑肌细胞的周期进程与增殖密切相关,与新内膜增生密切相关。PDGF-BB刺激促进的细胞周期可被过表达的miR-612所抑制[32]。AngⅡ诱导加快的细胞周期受miR-155阻滞[33]。在高血压模型中,miR-155靶向抑制p27表达促进周期进展[34],而miR-208靶向p21促进细胞周期进展[35]。过表达miR-96-5p靶向NFAT5提高G1/G2期,减少S期细胞比例[25]。miR-379诱导VSMC在G0/G1期阻滞[36]。miR-362-3p靶向血小板反应蛋白解整合素金属肽酶1(A disintegrin and metalloproteinase with thrombospondin 1,ADAMTS1)将细胞周期阻滞在G1/S期[37]。miR-142-5p靶向B细胞转位基因3(B-cell translocation gene 3,BTG3)抑制细胞周期进展[38]。miR-365靶向细胞周期蛋白D1(Cyclin D1)阻滞细胞周期进程[39-40]。miR-146b-3p靶向磷脂酰肌醇-4,5-二磷酸3-激酶催化亚基(phosphatidylinositol-4,5-bisphosphate 3-kinase catalytic subunit gamma,PIK3CG)抑制细胞周期进程[41]。miR-377-3p靶向NRP2抑制细胞周期蛋白的表达[42]。
1.4 miRNAs调控VSMCs从干细胞的分化
研究表明,参与新内膜增生的平滑肌细胞由不同细胞分化而来。miRNAs调节胚胎干细胞(embryonic stem cell,ESC)分化为SMCs:①蛋白水平,miR-10靶向抑制组蛋白去乙酰化酶4(histone deacetylase 4,HDAC4)[43],miR-34a上调去乙酰化酶(sirtuin,SIRT1)[44]促进分化过程;②转录组水平,miR-214靶向抑制RNA结合蛋白QKI促进VSMC从ESCs的分化[45];③基因水平,miR-22通过靶向甲基CpG结合蛋白2(methyl CpG binding protein 2,MeCP2)[46],miR-29a靶向抑制转录因子YY1促进ESCs分化为VSMCs[47]。此外,miRNAs也能调节外膜祖细胞分化为SMCs,如miR-30c-5p靶向骨保护素(osteoprotegerin,OPG)调节表达干细胞抗原(stem cell antigen-1,Sca-1)的外膜祖细胞分化为SMCs[48]。
不同miRNAs在VSMCs中的作用见表1。
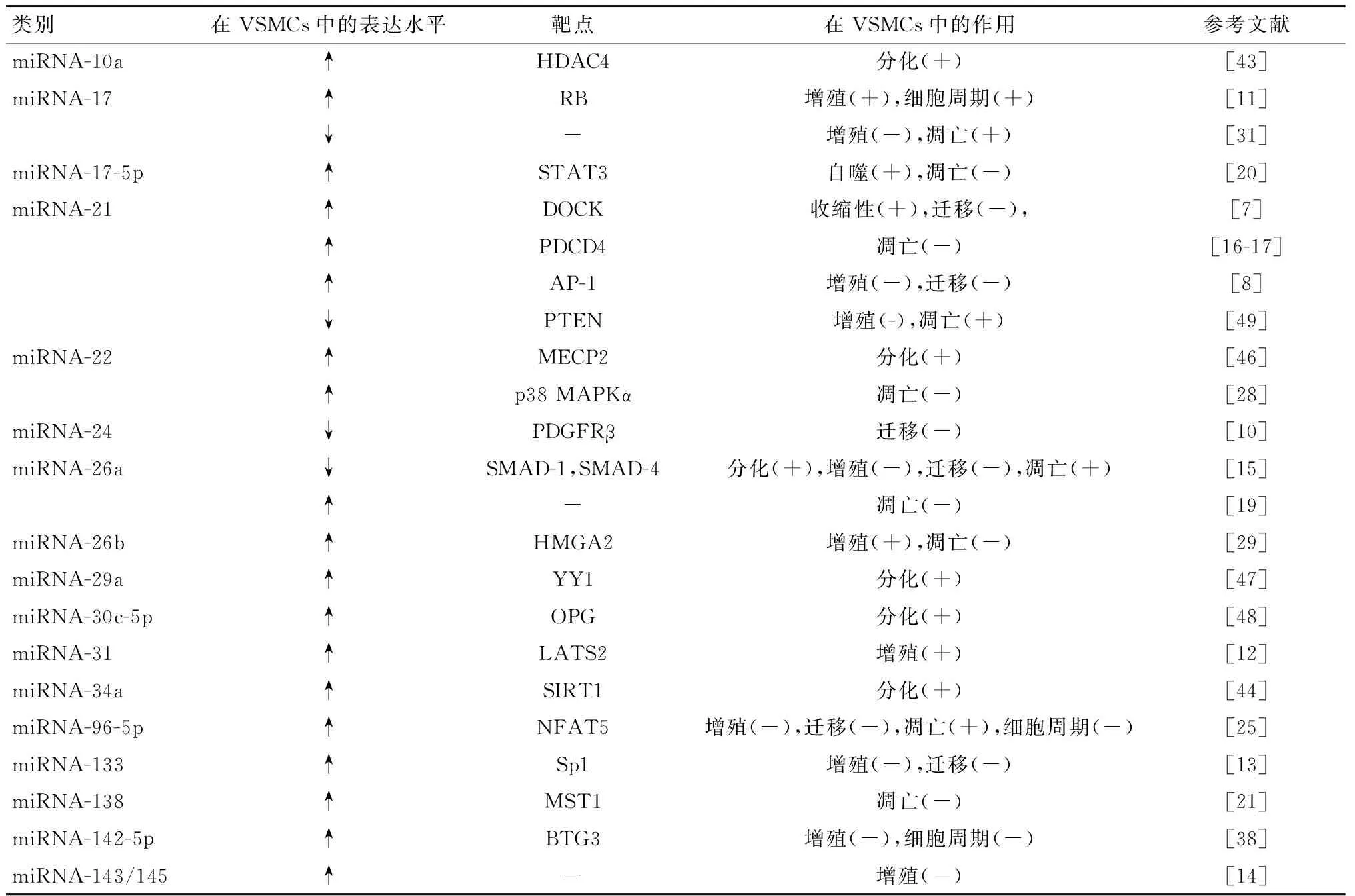
表1 不同miRNAs在VSMCs中的功能Table 1 Different known miRNAs and their functions in VSMCs
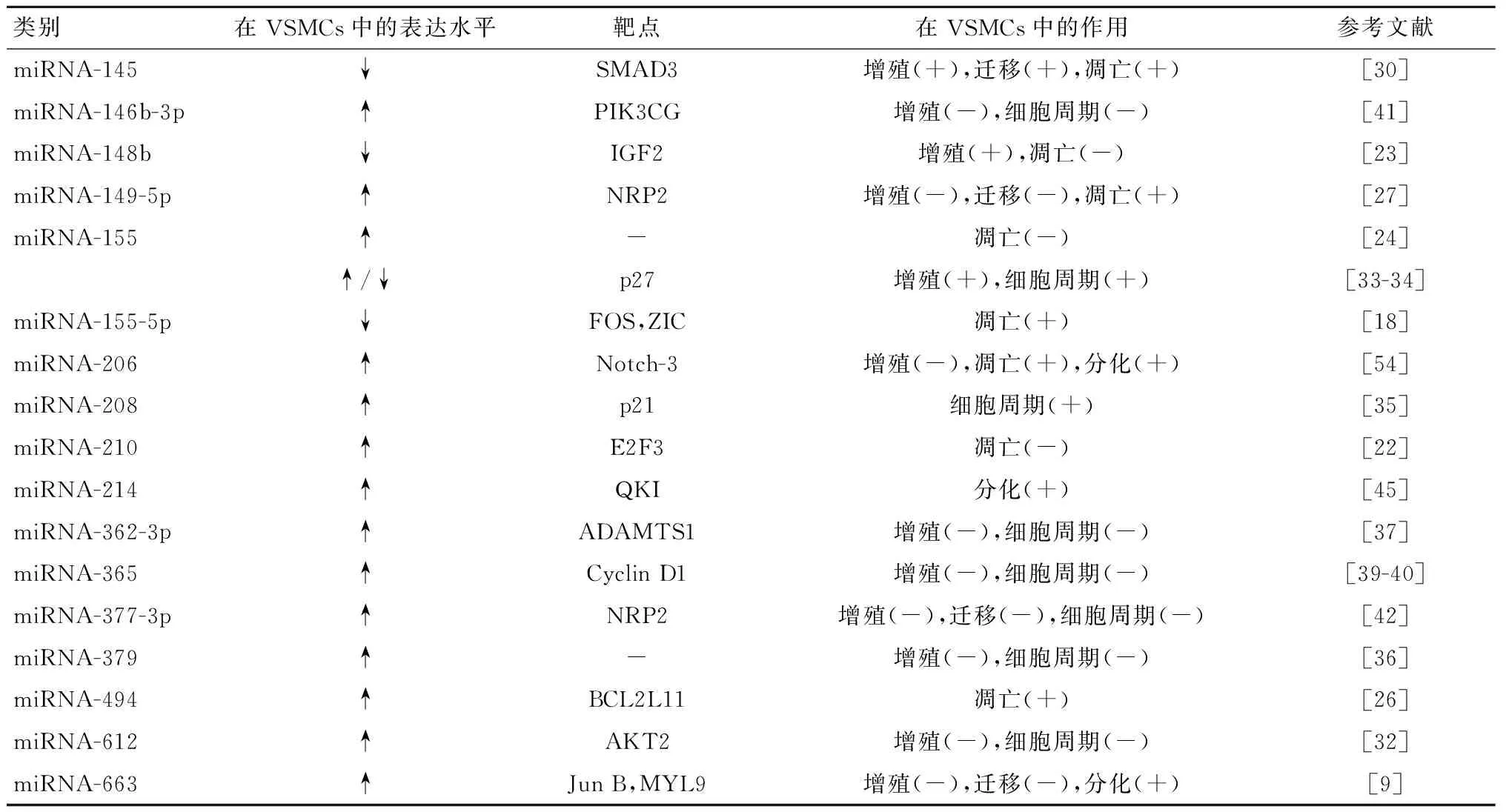
续表1
2 miRNAs在心血管疾病中的作用
2.1 肺动脉高压
肺动脉高压(pulmonary arterial hypertension,PAH)是以血管壁细胞异常的增殖、迁移和凋亡为基础,以肺血管重塑为特征的循环系统疾病[50]。研究表明,多种miRNAs分子参与此病理过程。在骨形态发生蛋白受体2型(bone morphogenetic protein receptor type 2,BMPR2)相关的PAH中,雌激素代谢产物16αOHE通过miR-29介导细胞代谢的调节加剧患者病情[51],而敲除miR-145可以改善BMPR2突变患者的病情[52]。此外,miR-1介导超氧化物产生增加,诱导内皮细胞功能障碍,在PAH中发挥重要作用[53]。在PAH患者的人肺动脉平滑肌细胞中,表达下调的miR-204靶向蛋白酪氨酸磷酸酶2(SH2-containing protein tyrosine phos-phatase-2,SHP2)进而激活NFAT,从而维持肺动脉平滑肌细胞的增殖能力和凋亡抗性;而过表达miR-206靶向Notch-3抑制细胞增殖能力和诱导凋亡,改善病情[54-55]。
2.2 主动脉瘤
主动脉瘤(aortic aneurysm,AA)形成的细胞机制十分复杂,尽管胸、腹主动脉瘤有着相似的解剖外观,以及细胞外基质的改变和平滑肌细胞的丧失,但它们是不同的疾病,以腹主动脉瘤最常见[56]。在胸主动脉中,miR-21敲除通过损伤TGF-β/Smad3信号通路加剧AngⅡ诱导的胸主动脉瘤[57];而在腹主动脉瘤(AAA)中,表达增加的miR-21下调了人第10号染色体缺失的磷酸酶(phosphatase and tensin homolog deleted on chromosome ten,PTEN)的表达,导致AKT的磷酸化和激活进而诱导细胞增殖并减少凋亡,对主动脉瘤膨胀具有保护作用[49]。此外,作为AAA患者疾病进展的血浆生物标志物,miR-24[58]靶向壳多糖酶3样蛋白1(chitinase-3-like protein 1,CHI3L1)促进平滑肌细胞因子的产生以及内皮细胞粘附分子的表达改变动物模型中的AAA进展,而miR-195[59]则通过调节细胞外基质蛋白(如胶原蛋白、蛋白多糖、弹性蛋白和弹性微纤维相关蛋白)改善病情;同时,增强细胞外基质合成的靶点分子还有miR-29[60]。
2.3 动脉粥样硬化
动脉粥样硬化(atherosclerosis,AS)是一种常见的心脑血管病,其发生发展涉及内皮细胞、单核/巨噬细胞、平滑肌细胞等。此外,非编码RNA可以调节细胞凋亡、焦亡、自噬、增殖和单核细胞迁移,参与动脉粥样硬化的形成过程[61]。在AS患者平滑肌细胞中,下调miR-17-5p靶向Ⅲ型组蛋白去乙酰化酶(sirtuin 7,SIRT7)进而诱导增殖并促进凋亡,从而延缓动脉硬化进展[62],miR-210靶向抑制激活蛋白C(activated protein C,APC)从而影响Wnt信号转导保护平滑肌细胞,稳定斑块[63];而在巨噬细胞中,抑制miR-155[64]或miR-21[65]的表达分别靶向B细胞淋巴瘤6(B-cell lymphoma 6,Bcl6)和双特异性磷酸酶(dual specificity phosphatase 8,Dusp-8)调节细胞迁移、粘附,限制动脉粥样硬化斑块形成;此外,拮抗miR-29作用于细胞外基质靶基因胶原蛋白Ⅰ(collagen I,col1A)和胶原蛋白Ⅲ(collagen Ⅲ,col3A)促进斑块重塑[66]。
2.4 支架再狭窄
内膜增生引起的支架再狭窄(instent restenosis,ISR)是冠状动脉支架植入术的主要局限之一[67]。研究发现,在ISR动脉中,miR-21和miR-140-3p的表达显著下调,针对miR-21的新型局部洗脱支架的应用可以有效预防内膜增生和活化炎症细胞功能造成的ISR[68-69];而拮抗miRNA-140-3p通过下调c-Myb促癌基因和Bcl-2减缓PDGF-BB诱导的细胞增殖[70]。
2.5 钙化和成骨分化
血管钙化(vascular calcification,VC)被定义为脉管系统中以磷酸钙复合物形式的矿物沉积[71]。VSMCs钙化以及向成骨样细胞分化表现为碱性磷酸酶(alkaline phosphatase,ALP)活性,骨钙素分泌以及Runt相关转录因子2(Runt-related transcription factor 2,Runx2)表达下降。其中Runx2是间充质细胞向成骨样细胞分化的必要条件。BMP2下调miR-30b/30c促进血管钙化[72],而过表达miR-205则通过靶向Runx2抑制成骨样分化[73]。
3 其他非编码RNAs通过miRNAs调控平滑肌细胞表型转化
非编码RNA相互作用网络十分复杂,彼此之间可以相互调控从而影响细胞生物学功能。在ox-LDL刺激的VSMCs中,沉默lncRNA TUG1靶向上调miR-148b的表达抑制细胞增殖而促进凋亡[23];此外,lncRNA CDKN2B-AS1一方面靶向下调miR-126-5p,进而上调靶基因酪氨酸磷酸酶非受体7型(protein tyrosine phosphatase non-receptor type 7,PTPN7)的表达,一方面抑制PI3K/AKT信号通路,从而抑制细胞增殖加速凋亡[74]。在PDGF-BB刺激的VSMCs中,lncRNA GAS5表达下调,过表达后可靶向抑制miR-21上调PDCD4抑制增殖迁移[75];而高表达的lncRNA XR007793靶向miR-23b进而上调叉头蛋白O4(forkhead box O4,FOXO4)的表达从而促进细胞增殖迁移[76]。在动脉瘤模型中,如AAA中,circ CBFB靶向抑制miR-28-5p抵抗凋亡[77],lncRNA LBX2-AS1与miR-4685-5p/LBX2(ladybird homeobox 2,瓢虫同源盒2)轴形成正反馈环促进细胞凋亡抵抗增殖[78];在TAA中,表达上调的lncRNA H19和lncRNA HIF1A-AS1分别靶向miR-1-3p/ADAM10(a disintegrin and metalloproteinase 10,分解素和金属蛋白酶10)轴和Let-7g/APAF1(apoptotic protease-activating factor 1,凋亡蛋白酶激活因子1)轴抑制细胞增殖,促进凋亡[79-80];而在颅内动脉瘤(intracranial aneurysm,IA)中,lncRNA ANRIL靶向下调miR-7,从而上调碱性成纤维细胞生长因子(fibroblast growth factor 2,FGF2)表达,进而促进细胞增殖抑制凋亡[81]。此外,还有很多长链和环状非编码RNA通过靶向不同的miRNAs调控平滑肌细胞表型转化过程(表2)。

表2 不同lncRNAs和circRNAs通过miRNAs在VSMCs中的调控作用Table 2 Different known lncRNAs and circRNAs and their regulative functions in VSMCs via miRNAs
4 总结与展望
综上所述,众多的miRNAs通过不同途径参与血管平滑肌细胞的生长调控,并与一系列的心血管疾病发生相关。随着用于识别复杂非编码RNA分子及其靶标新技术的出现,在新内膜形成中鉴定独特的控制VSMCs表型的分子信号途径变得更容易,越来越多的miRNA转录本的发现,使得更多的miRNA被识别作为血管平滑肌细胞内稳态调控的参与者。而且随着针对平滑肌细胞表型调控机制研究的不断完善,miRNA与心血管疾病之间隐秘联系的揭露逐渐开辟了新的诊疗领域,许多miRNA早已成为不同病理学过程的生物学标志物或者治疗靶点。更有研究证明miRNA在细胞内发挥的生物学效应不局限于它本身,而是多种非编码RNA相互调控的过程。对该网络体系机制的进一步探索,在不久的将来会改善整个心血管疾病的诊疗过程。
但是靶向miRNA的治疗仍存在一定的局限性,比如虽然在癌症中针对非编码RNA的治疗已有了很大进展,如专业纳米技术和RNA引导精密药的发展[88],但由于其广泛的重叠性和多靶点,在心血管疾病针对这些靶点的治疗中,额外的致瘤风险不可避免。而且越来越多的证据表明miRNA的表达具有时序性和组织特异性。在不同组织、器官、细胞类型和生长发育过程中,miRNA的表达谱有很大差异,每种miRNA针对的数个甚至上百个潜在靶基因,在不同的细胞或同一细胞的不同状态下发挥功能性靶标的作用也有所不同。这些研究结果不但说明miRNA及其靶标具有时空动态变化的特性,而且也提示miRNA在机体内发挥作用的复杂性,这使得将miRNA作为治疗靶点仍面临许多困难[89]。

