高脂饮食诱导的子宫内膜不典型增生小鼠肠道菌群微生物组学研究*
李艳辉, 赵 蓉, 肖诚瑀, 汪宏波
华中科技大学同济医学院附属协和医院妇产科,武汉 430022
子宫内膜癌是全球最常见的女性生殖系统恶性肿瘤之一[1]。高脂饮食和雌激素暴露都被证实与子宫内膜癌的发生发展密切相关[2-3],然而高脂饮食诱发子宫内膜病变的作用机制尚未阐明。子宫内膜从出现增生改变至恶变可能是一个连续演变过程,其中相关的发病因素及分子机制一直是科学研究的热点[4-6]。研究表明高脂饮食下产生的肥胖,将引起过量雌激素的产生和胰岛素抵抗,诱发机体代谢状态改变,可能驱动肿瘤的发生[6-7];另一方面,高脂饮食可通过改变脂肪酸氧化代谢[8]、炎症反应[9]等直接参与肿瘤、心脑血管病等疾病的发生。但高脂饮食是否通过肥胖相关作用之外的途径诱发子宫内膜病变,值得进一步探讨。
人类肠道微生物群包含数千种细菌,总共有200万个基因,大约是人类基因总数的150倍[10-11]。大量研究证实肠道微生物群与宿主间存在相互作用,肠道微生物群可以通过调节炎症、诱导DNA损伤、产生与肿瘤发生相关的代谢物等方式促进各种癌症的发生[12-14]。饮食可调节肠道微生物群的组成和功能,进而影响宿主的生理和病理状态[15-16]。值得注意的是,目前关于肠道微生物群、高脂饮食与妇科肿瘤间相互关系的研究仍非常有限,而揭示肠道微生物在高脂饮食所致子宫内膜病变过程中的作用及可能的机制,将有助于子宫内膜病变的防治。
本研究通过高脂饮食喂养构建小鼠子宫内膜病变模型,探讨高脂饮食在诱导子宫内膜病变中的作用;并采用宏基因组学对高脂饮食和持续雌激素干预下小鼠的肠道微生物群进行研究,为进一步探究微生物群失调在高脂饮食相关子宫内膜癌变中的作用提供依据和研究方向。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 54只清洁级6周龄CD-1(ICR)雌性小鼠(北京维通利华公司),18~25 g,饲养于华中科技大学同济医学院实验动物中心无病原体(SPF)动物房,每5只一笼,饲养温度(25±2)℃,湿度(55±5)%,维持12 h的光/暗循环。本动物实验经华中科技大学动物保护与利用委员会批准许可。
1.1.2 主要试剂 小鼠喂养用高脂饲料(D19452,脂肪、糖水化合物及蛋白供能占比分别为60%、20%、20%)购自北京华阜康有限公司;生化级17β-雌二醇购自美国Sigma-Aldrich公司;小鼠血清三酰甘油(TG)检测试剂盒购自南京建成生物工程研究所;苏木精-尹红(HE)染色试剂盒购自赛维尔生物科技有限公司;QIAamp DNA Stool Mini Kit试剂盒为德国QIAGEN公司产品。
1.2 实验方法
1.2.1 实验动物分组 实验小鼠经正常饮食喂养1周后,随机分为对照组、高脂饲料喂养组(HFD组)、17β-雌二醇喂养组(E2干预组)。对照组小鼠给予正常热量饲料喂养;HFD组小鼠采用高脂饲料持续喂养26周;E2干预组小鼠在给予正常热量饲料喂养下,每日一次性经口给予500 μg/kg的17β-雌二醇[17-18]。每组18只小鼠,每周称重记录体重变化。
1.2.2 标本收集 在分组处理后的第13周每组随机选取6只小鼠,第26周取各组剩余的12只小鼠。在小鼠的子宫内膜增殖期(通过阴道涂片观察),经麻醉后取其眼静脉血2 mL。小鼠断颈处死后,取下腹竖切口于子宫颈与子宫体交界部切下子宫,立即称重。称重后在体视显微镜下纵向剖开子宫。于冰上切取各只小鼠的部分子宫标本用于后续的组织学检查。
1.2.3 小鼠子宫内膜组织学评估 小鼠子宫标本经石蜡包埋,切片(5 μm),苏木精-伊红染色。由2名病理医师各自独立阅片,并根据2014年修订的WHO子宫内膜病变分类,将子宫内膜病变分为子宫内膜增生不伴不典型性(EH)和子宫内膜不典型增生(AH)两类[19]。
1.2.4 小鼠粪便标本的收集 由于饮食和环境因素能迅速改变肠道微生物群,本研究使用的药物、饲料、饮用水和鼠笼均进行了严格消毒控制,以避免潜在的交叉污染。在小鼠处死前1 d每小时收集1次粪便球。新鲜小鼠粪便收集于单个无菌离心试管内,并迅速转移至-80℃低温冰箱冷冻保存,直到DNA提取。
1.2.5 宏基因组测序分析 采用宏基因组测序方法测定各组小鼠肠道微生物群。采用QIAamp DNA Stool Mini Kit试剂盒从9份小鼠粪便标本(4份来自对照组小鼠,2份来自出现子宫内膜非典型增生的HFD组小鼠,3份来自出现子宫内膜非典型增生的E2干预组小鼠)中提取总DNA。基因组DNA经超声波破碎仪随机打断成长度为350 bp的片段,经末端修复、3′端加polyA、链接测序接头、纯化、PCR扩增等步骤完成DNA文库制备。Nanodrop初步测定DNA纯度,琼脂糖凝胶电泳检测DNA完整性。Qubit对回收的文库进行定量,算出实际浓度后,采用Illumina Hiseq二代高通量测序仪对细菌16S rDNA序列进行测序,得到所有对象样本的肠道微生物群16S rDNA V3~V4可变区的原始序列。
1.2.6 生物信息学分析 测序得到的原始数据经序列去重过滤、聚类。总共生成了54.9 Gb高质量数据,平均每个样本6.1 Gb。数据经过滤,并去除宿主基因,创建非冗余基因集用于后续数据分析。对所有序列进行分类单元(OTU)聚类分析及物种分类学分析。α多样性是反映物种多样性、丰富度、均匀度的综合指标。使用R语言进行α多样性分析。采用PICRUSt方法预测微生物群的功能差异,从COG功能分类和KEGG代谢途径(第3层)两个方面进行差异比较。
1.3 统计学方法
使用R语言进行α多样性分析、物种组成分析、微生物群差异分析。两组间比较采用t检验或Mann-Whitney U检验,三组间比较采用Kruskal-Wallis检验。使用PICRUSt软件进行功能预测分析。以P<0.05为差异具有统计学意义。
2 结果
2.1 高脂饮食对小鼠体重及血脂水平的影响
每周测量各组小鼠体重,结果显示:自处理第2周开始,HFD组小鼠体重显著高于对照组及E2干预组(均P<0.01);HFD组小鼠外周血三酰甘油水平亦显著高于对照组和E2干预组(均P<0.05);但E2干预组与对照组小鼠的体重及血清三酰甘油水平并无显著差异。见图1。

A:各组小鼠干预过程中平均体重变化趋势;B:干预第13周及第26周时各组小鼠血清三酰甘油水平比较;Control:正常饮食饲养组,E2:E2干预组,HFD:高脂饲料喂养组;与Control组比较,*P<0.05 **P<0.01图1 各组小鼠体重、血清三酰甘油水平的变化Fig.1 Changes in body weight and serum triglyceride level of each group
2.2 高脂饮食干预诱导小鼠子宫内膜增生
各组小鼠在干预的第13周和第26周分批处死,切除的子宫大体观显示:E2干预组小鼠的子宫体积明显增大,而HFD组与对照组小鼠子宫在外观上并无明显差异。称重结果显示:第26周,E2干预组小鼠的子宫质量显著高于HFD及对照组[(8.58±0.30)gvs.(7.33±0.18)g,(7.16±0.22)g,P<0.01]。见图2。

A:各组小鼠子宫大小大体观代表性图片;B:各组小鼠子宫质量比较;C干预第13周各组小鼠子宫内膜典型组织学表现(HE染色),D:干预第26周各组小鼠子宫内膜典型组织学表现(HE染色),100×视野中黑框区域在400×视野中放大;Control:正常饮食饲养组;E2:E2干预组;HFD:高脂饲料喂养组;**P<0.01图2 各组小鼠子宫大小及内膜改变Fig.2 Changes of uterine size and endometrium of mice in each group
分组干预第13周,66.7%(4/6)E2干预组小鼠子宫内膜呈现出子宫内膜增生不伴有不典型性状态,且子宫内膜腺体/间质比例明显增加;而HFD组和对照组小鼠子宫内膜组织学检查均为正常。但至第26周,83.3%(10/12)的HFD组及91.7%(11/12)的E2干预组小鼠子宫内膜呈现增生状态;其中,16.7%(2/12)的HFD组小鼠及25.0%(3/12)的E2干预组小鼠,其子宫内膜呈现腺体形状不规则,腺上皮呈复层结构并向腺腔内突出,子宫内膜细胞呈异型性、细胞极性丧失、细胞核异型性,提示出现子宫内膜不典型增生;对照组小鼠子宫内膜结构均正常。但持续26周的高脂饮食(HFD)组和E2干预组均未观察到子宫内膜癌变的发生。见图2。
2.3 肠道微生物群物种组成分析
宏基因组测序分析结果显示:共测得119个门、2234个属以及9043种细菌。其中HFD组测得113个门,1917个属,7274种细菌;E2干预组测得104个门,1907个属,7039种细菌;对照组测得119个门,2152个属,8427种细菌。3组中排名前5的主要组成物种均为拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、未分类菌门(unclassified bacteria)和脱铁杆菌门(Deferribacteres)。
2.4 组间肠道微生物群物种差异分析
在门水平,与对照组比较,HFD组的拟杆菌门丰度显著降低,而厚壁菌门丰度显著增多;与之相反,E2干预组与对照组比较呈现拟杆菌门丰度增加而厚壁菌门丰度的降低。见图3A、3B。
在属水平,与对照组比较,HFD组的Bacteroides属(23.850%vs.10.710%)、Prevotella属(12.800%vs.3.395%)和Clostridium属(9.081%vs.6.613%)相对丰度降低,而non-classified pFirmicutes属(5.585%vs.9.864%)相对丰度增加;E2干预组较对照组Clostridium属(6.613%vs.1.512%)和unclassified fLachnospiraceae属(9.948%vs.3.903%)相对丰度降低,而Bacteroides属(23.85%vs.50.98%)和Prevotella属(12.8%vs.16.79%)相对丰度增加。LEfSe分析亦提示HFD组与对照组小鼠肠道微生物群组成差异显著,尤其是HFD组产短链脂肪酸的优势菌属(Faecalibacterium和Ruminococcus)和丁酸的优势菌属(Clostridium,Butyrivibrio,Fusobacterium)丰度显著降低。见图3C、3D。

A:3组小鼠在门水平上的物种组成分析;B:3组小鼠肠道微生物群在门水平,排名前5位的微生物群占比差异分析;C:3组小鼠在属水平上的肠道微生物种组成分析;D:高脂饮食组与对照组小鼠在属水平的肠道微生物群LEfSe分析;E:3组小鼠在种水平的物种组成分析;F:高脂饮食组与对照组小鼠在种水平的物种组成差异分析;Ctrl:正常饮食饲养组;E2:E2干预组;HFD:高脂饲料喂养组;*P<0.05,**P<0.01图3 各组小鼠肠道菌群物种差异分析Fig.3 Bioinformatics analysis of gut microbiome flora
在种水平,3组丰度最高的优势菌种均为Bacteroidessp.CAG:927,unclassified gBacteroides,Prevotellasp.CAG:1031,FirmicutesbacteriumASF500和Bacteroidesuniformis。差异分析显示:HFD组中Bacteroidessp.CAG:927和Prevotellasp.CAG:1031的相对丰度降低,而Bacteroidesfragilis种相对丰度显著升高。这是值得注意的,因为这一菌种在林奇综合征患者的粪便样本中明显过多,而林奇综合征会导致子宫内膜癌和其他肿瘤的易感性增加[20]。见图3E、3F。
2.5 肠道微生物群多样性比较
采用Shannon指数表示α多样性。HFD组Shannon指数高于对照组,但差异无统计学意义(P=0.2667);E2干预组与对照组小鼠的α多样性无显著差异(P>0.999)。见图4。
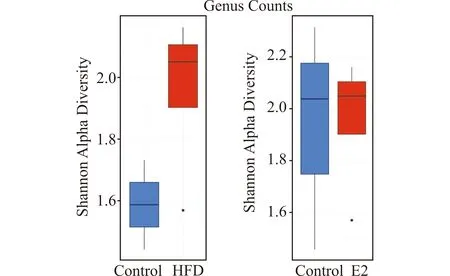
Control:正常饮食饲养组;E2:E2干预组;HFD:高脂饲料喂养组图4 各组小鼠肠道菌群在属水平的α多样性指数比较Fig.4 Comparison of the α diversity(Shannon index)of each group
2.6 功能预测分析
COG功能分类注释结果显示:与对照组相比,HFD组肠道微生物群基因在细胞运动、转运和分解代谢功能类群中的相对丰度较高;而E2干预组在细胞骨架功能类群中的相对丰度降低。见图5A、5B。
KEGG代谢途径分析结果显示:与对照组相比,HFD组肠道微生物群基因在氧化磷酸化、β内酰胺抵抗、组氨酸代谢、cAMP抵抗、铁死亡、凋亡等亚类显著富集;而在氨酰-tRNA生物合成、甘油糖脂代谢、胰高血糖素等亚类丰度显著下降。见图5C、5D。

A:HFD组与对照组微生物群差异基因的COG功能分类注释结果;B:E2干预组与对照组微生物群差异基因的COG功能分类注释结果;C:HFD组与对照组微生物群差异基因的KEGG代谢途径分析结果;D:E2干预组与对照组微生物群差异基因的KEGG代谢途径分析结果;Ctrl:正常饮食饲养组,E2:E2干预组,HFD:高脂饲料喂养组图5 各组肠道菌群功能差异分析Fig.5 Variance analysis of function of gut microbiome flora in each group
3 讨论
本研究采用高脂饮食连续喂养CD-1小鼠,发现高脂饮食可诱导子宫内膜不典型增生的发生,且其发生率与目前已明确的子宫内膜不典型增生诱发因素——持续无孕激素抵抗的雌激素刺激相当(16.7%vs.25.0%)。这一结果再次验证了高脂饮食是子宫内膜不典型增生的危险因素。流行病学调查结果显示:高脂饮食与多种肿瘤的发生率升高相关,包括胰腺癌[21]、肠道肿瘤[8]以及子宫内膜癌[22]等。而在动物模型中,Cheng等[17]采用高脂饮食和(或)17-β雌二醇喂养C57BL/6小鼠12周,发现高脂饮食促进了小鼠子宫内膜腺体的增殖(与本研究中第13周收集的小鼠子宫内膜标本组织学观测结果一致)。Wilkinson等[22]在一种遗传性易患子宫内膜癌的大鼠——BDⅡ/Han鼠中分别给予高脂饮食喂养15个月,9只正常饮食组大鼠及12只高脂饮食组大鼠内均有4只大鼠出现子宫内膜癌变。虽然高脂饮食干预下的BDⅡ/Han大鼠子宫内膜癌发病率并无显著增加,但作者推测其原因可能主要与研究的样本量过少相关。高脂饮食导致子宫内膜病变的机制,目前尚不完全清楚。除了高脂饮食下人体和动物模型产生的肥胖,诱发机体代谢状态改变驱动子宫内膜病变的发生[6-7]外,是否还存在其他机制值得进一步探讨。越来越多的研究认为肠道微生物群在机体的健康及疾病状况中发挥了重要作用。肠道微生物群的组成可以决定个体从食物中获取能量的功效,而与之相对的膳食组成的变化亦可改变肠道微生物群组成[23]。因此本研究探讨了高脂饮食喂养对小鼠肠道微生物群的影响,及其可能在子宫内膜病变中的作用。
本研究中宏基因组学技术分析结果显示高脂饮食喂养组小鼠肠道微生物群的α多样性较对照组有较明显的升高(虽然未达统计学差异),并且高脂饮食组与正常饮食对照组及17β-雌二醇组比较,肠道微生物群物种组成上差异显著。例如,与正常饮食对照组比较,肠道微生物群中拟杆菌门(Bacteroidetes)丰度在HFD组中显著降低,而厚壁菌门(Firmicutes)丰度在HFD组显著增多,这与许多研究结果相一致[24-25]。LEfSe分析也发现高脂饮食喂养组中产短链脂肪酸的优势菌属(Faecalibacterium和Ruminococcus)和丁酸的优势菌属(Clostridium,Butyrivibrio,Fusobacterium)丰度显著降低,与之前的研究结果相似[26]。产丁酸盐的基因丰度降低被认为是肥胖和汉族2型糖尿病人群的共同特征[26];同时产短链脂肪酸、丁酸的肠道微生物群的普遍减少与许多人类疾病相关[27]。高脂饮食也可使肠道微生物群的生物学功能及代谢途径发生改变[25]。本研究中,KEGG代谢途径分析显示,相较对照组,高脂饮食喂养组的肠道微生物群基因在氧化磷酸化、铁死亡、凋亡等亚类富集显著。上述由高脂饮食喂养诱导的肠道微生物群基因组发生显著上调的代谢途径中,需特别关注的是铁死亡。铁死亡作为一种新型的程序性细胞死亡形式,其在内膜癌的发生发展中的作用正在引起关注[20]。此外高脂饮食喂养诱导小鼠肠道微生物群基因组的氨酰-tRNA生物合成、甘油糖脂代谢、胰高血糖素等亚类下降,提示高脂饮食诱导了小鼠氨基酸、糖类、脂质代谢的紊乱;而先前的研究已经揭示高脂饮食诱导的胰岛素抵抗[28]、炎症反应[29]等均可诱发机体的代谢紊乱,并被认为是促进子宫内膜病变的关键环节。
另一个需要考虑的问题是上述肠道微生物组成及功能改变到底是由高脂饮食还是肥胖所致。Xiao等[24]的研究应用有肥胖倾向BL6和肥胖抵抗的Sv129小鼠对高脂饮食诱导肥胖的不同敏感性,以及它们对COX活性抑制剂的不同反应,鉴定了到底是高脂饮食还是肥胖在小鼠肠道微生物群变化中起到更大作用。结果显示小鼠肠道微生物群的明显变化更多源于高脂饮食喂养,而非肥胖。基于这一结论,我们推测高脂饮食喂养亦可能在本研究中主导了小鼠肠道微生物群组成及基因功能改变。
本研究仍有以下不足之处:首先,因高脂饮食(HFD)及17-β雌二醇(E2)干预组内分别只有2只、3只小鼠出现子宫内膜的不典型增生,致使进行宏基因组测序的样本数量相对较少。其次,虽然小鼠和人类具有相似的肠道微生物群组成和功能,但仍不能完全代表高脂饮食、肥胖对人体肠道微生物群和子宫内膜病变的影响。最后,未进行粪菌移植来验证肠道微生物群的改变对子宫内膜病变的影响,导致本研究缺乏肠道微生物群紊乱参与子宫内膜病变的直接证据。上述的不足需要我们在今后的研究中进一步完善。
本研究通过长达26周的高脂饮食喂养,在CD-1小鼠中构建出子宫内膜不典型增生模型;并通过宏基因组学技术验证了高脂饮食对小鼠肠道微生物群组成及功能的影响。高脂饮食诱导的小鼠肠道微生物群失调可能与子宫内膜增生甚至癌变相关,值得未来进一步的研究探索。

