li-pilo颞叶癫痫大鼠认知障碍与年龄的相关性*
李 承, 罗小青, 孙瑞迪, 刘明洋, 江 军
华中科技大学同济医学院附属武汉儿童医院临床神经电生理室,武汉 430016
颞叶癫痫(temporal lobe epilepsy,TLE)是青少年和成人最常见的局灶性癫痫之一,约三分之一的患者具有耐药性,手术切除病灶是一种潜在的治疗方法[1]。海马硬化是TLE患者最常见的组织病理学改变[2]。临床发现TLE的一个主要问题是其认知共患病,并且认知障碍会随着患病时间的推移逐渐加重,对患者生活质量的影响甚至比癫痫发作更大[2]。TLE常见的认知障碍症状,不仅限于记忆缺陷,还可能涉及语言、执行功能、注意力和处理速度等[3]。研究发现TLE认知障碍可能在发病时就已经存在,甚至在癫痫发作之前,提示两者可能存在共同发病机制[4]。由于TLE的认知功能损伤机制尚不清楚,其治疗选择有限。
我们前期研究发现氯化锂-匹罗卡品(li-pilo)可致癫痫大鼠海马N-甲基-D-天冬氨酸受体2B(NR2B-containing N-methyl-D-aspartate receptor,NR2B)表达或活性降低及海马长时程增强(long-term potentiation,LTP)减弱,并与认知障碍形成有关[5-6]。近期的一些研究提示了癫痫认知障碍与年龄的相关性[7-8]。本研究采用li-pilo复制癫痫大鼠模型,造模后根据大鼠年龄分为1个月(1 M)、2个月(2 M)及3个月(3 M)癫痫模型,探讨li-pilo癫痫大鼠认知障碍与年龄的相关性及其可能机制。
1 材料与方法
1.1 实验动物
清洁级新生SD大鼠36只,购自华中科技大学实验动物中心。出生第21天断奶后,每6只子鼠一笼,于自然光下饲养,自由饮食、饮水。
1.2 主要试剂及仪器
匹罗卡品、氯化锂、硫酸阿托品、氯化镁、氯化钙(Sigma公司);氯化钠、氯化钾、磷酸二氢钠、碳酸氢钠、葡萄糖(国产分析纯);小鼠抗NR2B单克隆抗体、兔抗NR2B(pTyr1472)多克隆抗体(Sigma公司)。Morris水迷宫(RD 1101-MWM,上海移数信息科技有限公司);RM6240多道生理记录仪(成都仪器厂);针形电极(成都仪器厂);振动切片机(ZQP-86型,上海之信仪器有限公司);微电极操纵仪(MX160L,成都仪器厂);微电极放大器(SWF-2W,成都仪器厂)。
1.3 癫痫大鼠模型的建立及评估
新生SD大鼠随机分为氯化锂-匹罗卡品(li-pilo)模型组、生理盐水对照组。出生后第21天,模型组大鼠首先经腹腔注射氯化锂(127 mg/kg),20 h后注射硫酸阿托品(1 mg/kg),30 min后再注射匹罗卡品(25 mg/kg);生理盐水组腹腔注射等量生理盐水。抽搐行为评价采用修改后的Racine分级标准[9],即0级:无反应;Ⅰ级:耳面部抽搐;Ⅱ级:肌阵挛,但无直立位;Ⅲ级:肌阵挛,伴直立位;Ⅳ级:全身强直阵挛发作;Ⅴ级:全身强直阵挛发作,并失去体位控制。制备癫痫模型,出现反复强直-阵挛发作,即癫痫持续状态(SE),1 h后给予10%水合氯醛3 mL/kg腹腔注射解除抽搐。选择点燃后出现Racine Ⅳ级以上表现并存活的大鼠进行实验。
1.4 Morris水迷宫实验评估癫痫模型大鼠认知功能
模型建立后根据大鼠年龄分为1月龄癫痫模型组(1 M TLE组)、1月龄正常对照组(1 M Control组)、2月龄癫痫模型组(2 M TLE组)、2月龄正常对照组(2 M Control组)、3月龄癫痫模型组(3 M TLE组)、3月龄正常对照组(3 M Control组),每组6只大鼠。进行Morris水迷宫实验,比较大鼠平均潜伏期、运动总路程来评估其认知功能。每次实验历时5 d,每日于固定时间段训练4次,以大鼠每日4次训练的平均值作为当日的学习成绩。
1.5 离体海马脑片的制备
每组取3只大鼠,腹腔注射水合氯醛麻醉大鼠后断头,迅速取出大脑,放置在低于4℃的冰人工脑脊液(ACSF)中。用502胶将组织块固定在振动切片机的切片槽里,倒入适当的冰ACSF,用振动切片机把含有海马的大脑部分切成脑片(横切面),厚度500 μm。
1.6 离体脑片海马CA1区场电位(fEPSP)记录
将脑片移至界面型记录槽,用温ACSF以1~2 mL/min的流速持续灌流脑片,ACSF温度控制在(30±1)℃,持续充入含有95%O2和5%CO2的混合气体。在解剖显微镜下将双极不锈钢刺激电极置于海马CA1的Schaffer侧支通路上,记录微电极置于海马的CA1区,其尖端置于脑片表面下约200 μm处。场电位经微电极放大器放大后,输出信号用数据采集系统RM6240进行信号的记录、分析和处理。LTP的引导应用了2串频率为100 Hz的高频刺激,每串持续1 s,间隔为10 s。数据处理以高频刺激前场电位的波幅或斜率的均值作为基础值,以高频刺激后的波幅或斜率的均值与该脑片基础值的百分比表示LTP。
1.7 Western blot检测海马NR2B表达
每组取3只大鼠,Western blot方法检测其海马NR2B表达水平。提取海马组织蛋白,采用BCA法测定蛋白浓度,采用8% SDS-PAGE分离样品,转膜,封闭,分别滴加一抗β-actin(1∶1000)、鼠抗NR2B单克隆抗体(1∶500),4℃孵育过夜;洗膜后二抗(1∶2000)室温孵育1 h,PBST洗膜,ECL化学发光显影,采用Bio-Rad ChemiDocXRS +成像系统拍照,用Image J软件进行灰度值分析,比较各组蛋白表达差异。
1.8 统计学方法
采用SPSS 16.0统计学软件进行统计分析,实验数据均以“均数±标准差”表示。水迷宫实验、海马场电位LTP的结果比较采用单因素方差分析;Western blot结果采用非配对t检验进行分析。以P<0.05表示差异具有统计学意义。
2 结果
2.1 癫痫大鼠学习记忆功能呈年龄依赖性减退
模型建立后分别对1月龄、2月龄及3月龄癫痫大鼠及对照大鼠通过Morris水迷宫实验观察比较平均潜伏期及运动总路程,评估其学习记忆功能与年龄相关性。结果(图1)显示:①1月龄癫痫大鼠第1~5天平均潜伏期及运动总路程与年龄匹配对照大鼠比较均未见明显改变,提示1月龄癫痫大鼠学习记忆功能无明显减退。②2月龄癫痫大鼠在第1~3天平均潜伏期及运动总路程与年龄匹配对照大鼠比较无明显改变,第4~5天平均潜伏期及运动总路程显著高于年龄匹配对照大鼠,提示2月龄癫痫大鼠学习记忆功能出现一定程度减退。③3月龄癫痫大鼠在第1~5天平均潜伏期及运动总路程均显著高于年龄匹配对照大鼠,提示3月龄癫痫大鼠学习记忆功能出现明显减退。

A:1月龄大鼠平均潜伏期;B:2月龄大鼠平均潜伏期;C:3月龄大鼠平均潜伏期;D:1月龄大鼠平均运动路程;E:2月龄大鼠平均运动路程;F:3月龄大鼠平均运动路程;Control:正常对照组;TLE:癫痫模型组;与年龄匹配对照组大鼠比较,*P<0.05;n=6图1 不同年龄癫痫大鼠与年龄匹配对照大鼠认知功能比较Fig.1 Comparison of cognitive function between epilepsy rats of different ages and the age-matched controls
2.2 癫痫大鼠海马LTP呈年龄依赖性减弱
水迷宫行为学实验结束后,记录离体脑片场电位评估LTP与年龄相关性(图2)。结果显示:①1、2及3月龄正常对照组间相比,基础场电位斜率与幅值无显著差异,高频刺激后,海马场电位斜率与幅值也未见显著差异,提示正常大鼠在1~3月龄范围内LTP无显著差异。②1月龄癫痫模型、2月龄癫痫模型及3月龄癫痫模型大鼠相比较,各组海马基础场电位斜率与幅值无显著差异,但高频刺激后,2月龄癫痫模型大鼠海马场电位斜率较1月龄癫痫模型组显著减弱,3月龄癫痫模型组海马场电位斜率又比2月龄癫痫模型组显著减弱,提示癫痫大鼠海马LTP维持期在1~3月龄范围内出现年龄依赖性缩短。

A:1月龄、2月龄、3月龄正常对照组大鼠海马场电位的斜率;B:1月龄、2月龄、3月龄模型组大鼠海马场电位的斜率;C:1月龄、2月龄、3月龄正常大鼠海马场电位的幅值;D:1月龄、2月龄、3月龄模型大鼠海马场电位的幅值;fEPSP:场电位;Control:正常对照组;TLE:癫痫模型组;HFS:高频刺激;n=3图2 不同病程癫痫大鼠及年龄匹配对照大鼠海马脑片场电位Fig.2 Comparison of field potential in hippocampus between the epilepsy rats in different disease status and the age-matched controls
2.3 癫痫大鼠海马NR2B表达水平呈年龄依赖性降低
Western blot方法检测各组大鼠海马NR2B表达水平。结果(图3)显示:①1、2及3月龄正常对照组间比较,其海马NR2B表达水平未见显著差异,提示正常大鼠在1~3月龄范围内NR2B表达水平无明显变化。②1月龄癫痫模型、2月龄癫痫模型及3月龄癫痫模型组大鼠比较,2月龄癫痫模型大鼠海马NR2B表达水平较1月龄癫痫模型组明显降低,3月龄癫痫模型组较2月龄癫痫模型组显著降低,提示1~3月龄癫痫大鼠海马NR2B表达水平呈年龄依赖性降低。
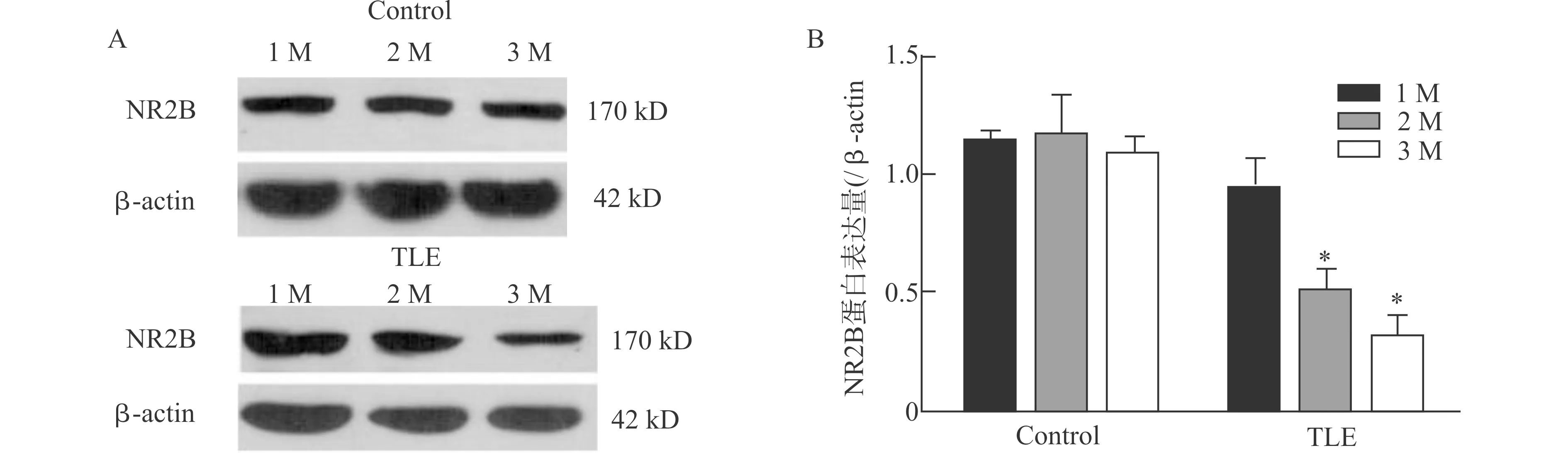
A:1月龄、2月龄、3月龄正常对照组及模型组大鼠海马Western blot结果;B:1月龄、2月龄、3月龄正常对照组及模型组大鼠海马NR2B表达水平统计图;Control:正常对照组;TLE:癫痫模型组;与1月龄模型组大鼠比较,*P<0.05;n=3图3 不同病程癫痫大鼠及年龄匹配对照大鼠海马NR2B表达水平Fig.3 Comparison of expression of hippocampal NR2B between epilepsy rats in different disease status and the age-matched controls
3 讨论
前期研究发现癫痫大鼠认知障碍与海马LTP减弱相关,同时还发现癫痫大鼠海马NR2B表达水平降低[9]。本研究发现在1~3月龄范围,癫痫大鼠海马NR2B表达进行性降低,海马LTP进行性减弱,可能导致癫痫大鼠认知功能进行性减退,提示癫痫大鼠认知障碍与年龄相关,同时还进一步证实海马LTP及NR2B参与癫痫认知障碍的发生发展。
认知障碍是影响TLE患者生存质量的一个主要问题,普遍认为癫痫的认知共病通常与潜在的病因、癫痫发作的年龄、癫痫发作的频率、发作间期异常放电以及抗癫痫药物相关[7]。近年来研究发现癫痫认知障碍与年龄也有明显相关性。Hermann等[7]报道TLE患者与年龄和性别匹配的健康对照组相比,在4年内出现进行性认知障碍。另有研究提示WAG/Rij失神癫痫大鼠模型存在年龄依赖性学习和记忆缺陷[8]。我们的研究也发现随着癫痫病程延长,癫痫大鼠认知功能也出现进行性减退。这些研究均强调了认知障碍与年龄的相关性。
研究报道认知障碍更容易出现在早发性、药物依赖性癫痫以及频繁发作的个体中,如癫痫性脑病,同时短暂的发作间期痫性放电也会导致短暂的认知障碍[10]。有证据表明随着时间的推移,不可控的癫痫发作可能会对认知能力产生负面影响,同时发作间期放电还与学习和记忆的改变有关[11]。在我们的研究中,正常大鼠在1~3月龄范围内,认知障碍未见明显减退,但癫痫大鼠认知功能明显减退,并随着月龄增加,出现进行性减退,提示癫痫发作及发作间期异常放电可能对癫痫大鼠认知功能产生负面影响。
海马组织是学习记忆的关键部位,由于其特殊脆弱性(不耐缺氧、缺血及神经毒性物质),也参与癫痫、阿尔茨海默病等神经精神疾病的病理生理过程[12]。海马LTP的形成在细胞水平上与记忆过程有着相似分子机制。LTP分为诱导期和维持期,其中维持期与记忆的储存密切相关[13]。NR2B是兴奋性谷氨酸受体NMDAR一种亚基,参与LTP维持[14]。我们研究中发现海马NR2B表达年龄依赖性降低,海马LTP也呈现年龄依赖性减弱,提示癫痫认知障碍的可能机制:NR2B表达降低,继而海马LTP维持受损,最终导致癫痫大鼠认知功能减退。我们后续还会通过正反干预等手段继续研究三者之间相关性。
多项证据表明,癫痫患者的认知功能障碍可能与病理性脑老化和神经退行性病变相关机制有关[15]。引人注目的是,难治性慢性癫痫患者表现出脑老化晚期的影像学特征和心室加速扩张,类似于阿尔茨海默病等神经退行性认知障碍的特征[16]。与癫痫和认知障碍相关的其他疾病中,如唐氏综合征和脆性X综合征,也发现APP和淀粉样蛋白-b42等神经退行性病变物质增加[17-18]。这些联系增加了癫痫超兴奋网络引发神经退行性病变的可能性,同时也提示癫痫认知障碍与大脑加速老化有关。本实验中癫痫大鼠认知障碍是否也与大脑老化加速有关,目前尚不清楚,有待进一步研究。

